Handlingspotensial - Action potential

I fysiologi oppstår et handlingspotensial ( AP ) når membranpotensialet til et bestemt cellested raskt stiger og faller: denne depolarisasjonen får deretter tilstøtende steder til å depolarisere på samme måte. Handlingspotensialer forekommer i flere typer dyreceller , kalt eksitable celler, som inkluderer nevroner , muskelceller , endokrine celler og i noen planteceller .
I nevroner spiller handlingspotensialer en sentral rolle i celle-til-celle kommunikasjon ved å sørge for-eller med hensyn til saltende ledning , hjelpe-forplantning av signaler langs neuronets axon mot synaptiske boutoner som ligger i enden av et axon; disse signalene kan deretter koble seg til andre nevroner ved synapser, eller til motorceller eller kjertler. I andre celletyper er deres hovedfunksjon å aktivere intracellulære prosesser. I muskelceller, for eksempel, er et handlingspotensial det første trinnet i kjeden av hendelser som fører til sammentrekning. I betaceller i bukspyttkjertelen provoserer de frigjøring av insulin . Handlingspotensialer i nevroner er også kjent som " nerveimpulser " eller " pigger ", og den tidsmessige sekvensen av handlingspotensialer generert av et nevron kalles dets " piggetog ". Et nevron som avgir et handlingspotensial, eller nerveimpuls, sies ofte å "fyre".
Handlingspotensialer genereres av spesielle typer spenningsstyrte ionekanaler innebygd i en celles plasmamembran . Disse kanalene stenges når membranpotensialet er nær cellens (negative) hvilepotensial , men de begynner raskt å åpne seg hvis membranpotensialet øker til en nøyaktig definert terskelspenning, og depolariserer transmembranpotensialet. Når kanalene åpnes, tillater de en innadgående strøm av natriumioner , som endrer den elektrokjemiske gradienten, noe som igjen gir en ytterligere økning i membranpotensialet mot null. Dette får da flere kanaler til å åpne seg, og produserer en større elektrisk strøm over cellemembranen og så videre. Prosessen fortsetter eksplosivt til alle tilgjengelige ionekanaler er åpne, noe som resulterer i et stort oppsving i membranpotensialet. Den raske tilstrømningen av natriumioner får polariteten til plasmamembranen til å reversere, og ionekanalene inaktiveres deretter raskt. Når natriumkanalene lukkes, kan natriumioner ikke lenger komme inn i nevronet, og de blir deretter aktivt transportert tilbake ut av plasmamembranen. Kaliumkanaler aktiveres deretter, og det er en utadgående strøm av kaliumioner, som returnerer den elektrokjemiske gradienten til hviletilstanden. Etter at et handlingspotensial har oppstått, er det et forbigående negativt skifte, kalt afterhyperpolarisering .
I dyreceller er det to primære typer handlingspotensialer. Den ene typen genereres av spenningsgaterte natriumkanaler , den andre av spenningsstyrte kalsiumkanaler . Natriumbaserte handlingspotensialer varer vanligvis i under ett millisekund, men kalsiumbaserte handlingspotensialer kan vare i 100 millisekunder eller lenger. I noen typer nevroner gir langsomme kalsiumspiker drivkraften for et langt utbrudd av raskt utsendte natriumspyd. I hjertemuskelceller , derimot, gir en innledende rask natriumspike en "primer" for å provosere den raske begynnelsen av en kalsiumspike, som deretter gir muskelsammentrekning.
Oversikt
Nesten alle cellemembraner i dyr, planter og sopp opprettholder en spenningsforskjell mellom utsiden og innsiden av cellen, kalt membranpotensialet . En typisk spenning over en dyrecellemembran er -70 mV. Dette betyr at det indre av cellen har en negativ spenning i forhold til utsiden. I de fleste celletyper forblir membranpotensialet vanligvis ganske konstant. Noen celletyper er imidlertid elektrisk aktive i den forstand at spenningene deres svinger over tid. I noen typer elektrisk aktive celler, inkludert nevroner og muskelceller, har spenningssvingningene ofte form av en rask oppadgående spike etterfulgt av et raskt fall. Disse opp-og-ned-syklusene er kjent som handlingspotensialer . I noen typer nevroner skjer hele opp-og-ned-syklusen på noen få tusendels sekund. I muskelceller varer et typisk handlingspotensial omtrent en femtedel av et sekund. I noen andre typer celler og planter kan et handlingspotensial vare tre sekunder eller mer.
De elektriske egenskapene til en celle bestemmes av strukturen til membranen som omgir den. En cellemembran består av et lipiddobbelt lag av molekyler der større proteinmolekyler er innebygd. Lipiddobbeltlaget er svært motstandsdyktig mot bevegelse av elektrisk ladede ioner, så det fungerer som en isolator. De store membraninnstøpte proteiner gir derimot kanaler som ioner kan passere gjennom membranen. Handlingspotensialer drives av kanalproteiner hvis konfigurasjon bytter mellom lukkede og åpne tilstander som en funksjon av spenningsforskjellen mellom det indre og ytre av cellen. Disse spenningssensitive proteiner er kjent som spenningsstyrte ionekanaler .
Prosess i en typisk nevron

Alle celler i dyrets kroppsvev er elektrisk polarisert - med andre ord, de opprettholder en spenningsforskjell over cellens plasmamembran , kjent som membranpotensialet . Denne elektriske polarisasjonen er et resultat av et komplekst samspill mellom proteinstrukturer som er innebygd i membranen som kalles ionepumper og ionekanaler . I nevroner varierer typene ionekanaler i membranen vanligvis på tvers av forskjellige deler av cellen, noe som gir dendritene , aksonet og cellekroppen forskjellige elektriske egenskaper. Som et resultat kan noen deler av membranen til et nevron være eksitabel (i stand til å generere handlingspotensialer), mens andre ikke er det. Nyere studier har vist at den mest spennende delen av et nevron er delen etter axonhellingen (punktet der axon forlater cellelegemet), som kalles det første segmentet, men akson og cellelegeme er også eksitable i de fleste tilfeller .
Hver spennende membranplast har to viktige nivåer av membranpotensial: hvilepotensialet , som er verdien membranpotensialet opprettholder så lenge ingenting forstyrrer cellen, og en høyere verdi som kalles terskelpotensialet . På axonhellingen til et typisk nevron er hvilepotensialet rundt –70 millivolt (mV) og terskelpotensialet er rundt –55 mV. Synaptiske innganger til et nevron får membranen til å depolarisere eller hyperpolarisere ; det vil si at de får membranpotensialet til å stige eller falle. Handlingspotensialer utløses når nok depolarisering akkumuleres til å bringe membranpotensialet opp til terskelen. Når et handlingspotensial utløses, skyter membranpotensialet brått oppover og skyter deretter like plutselig nedover, og slutter ofte under hvilenivået, hvor det forblir i en periode. Handlingspotensialets form er stereotyp; dette betyr at stigning og fall vanligvis har omtrent samme amplitude og tidsforløp for alle handlingspotensialer i en gitt celle. (Unntak diskuteres senere i artikkelen). I de fleste nevroner skjer hele prosessen på omtrent en tusendels sekund. Mange typer nevroner avgir aksjonspotensialer konstant med hastigheter på opptil 10–100 per sekund. Noen typer er imidlertid mye roligere, og kan gå i minutter eller lenger uten å gi noen handlingspotensialer.
Biofysisk grunnlag
Handlingspotensialer skyldes tilstedeværelsen i en cellemembran av spesielle typer spenningsstyrte ionekanaler . En spenningsstyrt ionekanal er et transmembranprotein som har tre viktige egenskaper:
- Den er i stand til å anta mer enn én konformasjon.
- Minst en av konformasjonene skaper en kanal gjennom membranen som er gjennomtrengelig for bestemte typer ioner.
- Overgangen mellom konformasjoner påvirkes av membranpotensialet.
Således har en spenningsstyrt ionekanal en tendens til å være åpen for noen verdier av membranpotensialet, og stengt for andre. I de fleste tilfeller er imidlertid forholdet mellom membranpotensial og kanaltilstand sannsynlig og innebærer en tidsforsinkelse. Ionkanaler bytter mellom konformasjoner på uforutsigbare tidspunkter: Membranpotensialet bestemmer overgangshastigheten og sannsynligheten per tidsenhet for hver type overgang.
Spenningsgatede ionekanaler er i stand til å produsere handlingspotensialer fordi de kan gi opphav til positive tilbakemeldingsløkker : Membranpotensialet styrer tilstanden til ionekanalene, men tilstanden til ionekanalene styrer membranpotensialet. I noen situasjoner kan således en økning i membranpotensialet føre til at ionekanaler åpnes og derved forårsake en ytterligere økning i membranpotensialet. Et handlingspotensial oppstår når denne positive tilbakemeldingssyklusen ( Hodgkin -syklusen ) fortsetter eksplosivt. Tids- og amplitudebanen for handlingspotensialet bestemmes av de biofysiske egenskapene til de spenningsgaterte ionekanalene som produserer det. Det finnes flere typer kanaler som kan produsere den positive tilbakemeldingen som er nødvendig for å generere et handlingspotensial. Spenningsgaterte natriumkanaler er ansvarlige for de raske handlingspotensialene som er involvert i nerveledning. Langsommere handlingspotensialer i muskelceller og noen typer nevroner genereres av spenningsstyrte kalsiumkanaler. Hver av disse typene kommer i flere varianter, med forskjellig spenningsfølsomhet og ulik tidsmessig dynamikk.
Den mest intensivt undersøkte typen spenningsavhengige ionekanaler omfatter natriumkanalene som er involvert i rask nerveledning. Disse er noen ganger kjent som Hodgkin-Huxley natriumkanaler fordi de først ble preget av Alan Hodgkin og Andrew Huxley i deres nobelprisvinnende studier av biofysikken til handlingspotensialet, men kan lettere refereres til som Na V- kanaler. ("V" står for "spenning".) En Na V -kanal har tre mulige tilstander, kjent som deaktivert , aktivert og inaktivert . Kanalen er bare permeabel for natriumioner når den er i aktivert tilstand. Når membranpotensialet er lavt, bruker kanalen mesteparten av tiden i deaktivert (lukket) tilstand. Hvis membranpotensialet er hevet over et visst nivå, viser kanalen økt sannsynlighet for overgang til aktivert (åpen) tilstand. Jo høyere membranpotensialet er, desto større er sannsynligheten for aktivering. Når en kanal har aktivert, vil den til slutt gå over til den inaktiverte (lukkede) tilstanden. Den pleier da å forbli inaktivert en stund, men hvis membranpotensialet blir lavt igjen, vil kanalen til slutt gå tilbake til deaktivert tilstand. Under et handlingspotensial går de fleste kanalene av denne typen gjennom en syklus deaktivert → aktivert → inaktivert → deaktivert . Dette er imidlertid bare befolkningens gjennomsnittlige oppførsel - en individuell kanal kan i prinsippet gjøre en overgang når som helst. Sannsynligheten for at en kanal overgår fra den inaktiverte tilstanden direkte til den aktiverte tilstanden er imidlertid svært lav: En kanal i den inaktiverte tilstanden er ildfast til den har gått tilbake til den deaktiverte tilstanden.
Resultatet av alt dette er at kinetikken til Na V- kanalene styres av en overgangsmatrise hvis hastigheter er spenningsavhengige på en komplisert måte. Siden disse kanalene selv spiller en stor rolle for å bestemme spenningen, kan systemets globale dynamikk være ganske vanskelig å finne ut. Hodgkin og Huxley nærmet seg problemet ved å utvikle et sett med differensialligninger for parameterne som styrer ionekanaltilstandene, kjent som Hodgkin-Huxley-ligningene . Disse ligningene har blitt grundig modifisert av senere forskning, men danner utgangspunktet for de fleste teoretiske studier av potensiell biofysikk.
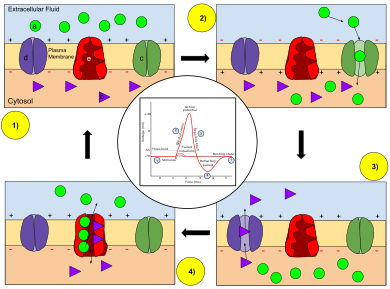
Nøkkel: a) Natrium (Na + ) ion. b) Kalium (K + ) ion. c) Natriumkanal. d) Kaliumkanal. e) Natrium-kaliumpumpe.
I stadiene av et handlingspotensial endres permeabiliteten til nevronmembranen. I hviletilstand (1) har natrium- og kaliumioner begrenset evne til å passere gjennom membranen, og nevronet har en netto negativ ladning inni. Når handlingspotensialet er utløst, aktiverer depolarisasjonen (2) av nevronet natriumkanaler, slik at natriumioner kan passere gjennom cellemembranen inn i cellen, noe som resulterer i en netto positiv ladning i nevronet i forhold til den ekstracellulære væsken. Etter at aksjonspotensialtoppen er nådd, begynner nevronet repolarisering (3), hvor natriumkanalene lukkes og kaliumkanaler åpnes, slik at kaliumioner kan krysse membranen inn i den ekstracellulære væsken og returnere membranpotensialet til en negativ verdi. Til slutt er det en ildfast periode (4), hvor de spenningsavhengige ionekanalene inaktiveres mens Na + og K + -ionene går tilbake til hvilestatusfordelingene over membranen (1), og nevronet er klart til å gjenta prosessen for det neste handlingspotensialet.
Etter hvert som membranpotensialet økes, åpnes natriumionkanaler , slik at natriumioner kan komme inn i cellen. Dette etterfølges av åpningen av kaliumionkanaler som tillater utgang av kaliumioner fra cellen. Den innadgående strøm av natriumioner øker konsentrasjonen av positivt ladede kationer i cellen og forårsaker depolarisering, hvor potensialet til cellen er høyere enn cellens hvilepotensial . Natriumkanalene stenger på toppen av handlingspotensialet, mens kalium fortsetter å forlate cellen. Utstrømningen av kaliumioner reduserer membranpotensialet eller hyperpolariserer cellen. For små spenningsøkninger fra hvile, overskrider kaliumstrømmen natriumstrømmen og spenningen går tilbake til sin normale hvileverdi, vanligvis −70 mV. Men hvis spenningen øker forbi en kritisk terskel, vanligvis 15 mV høyere enn hvileverdien, dominerer natriumstrømmen. Dette resulterer i en løpende tilstand der den positive tilbakemeldingen fra natriumstrømmen aktiverer enda flere natriumkanaler. Dermed brenner cellen og produserer et handlingspotensial. Frekvensen som et nevron fremkaller handlingspotensialer blir ofte referert til som en avfyringshastighet eller nevral avfyringshastighet .
Strømmer produsert ved åpning av spenningsgatede kanaler i løpet av et handlingspotensial er vanligvis betydelig større enn den opprinnelige stimulerende strømmen. Dermed bestemmes amplituden, varigheten og formen på handlingspotensialet i stor grad av egenskapene til den eksiterende membranen og ikke amplituden eller varigheten av stimulus. Denne alt-eller-ingenting- egenskapen til handlingspotensialet skiller den fra graderte potensialer som reseptorpotensialer , elektrotoniske potensialer , undergrensning av membranpotensialoscillasjoner og synaptiske potensialer , som skaleres med størrelsen på stimulus. Det eksisterer en rekke handlingspotensialtyper i mange celletyper og cellekammer, bestemt av typer spenningskanaler, lekkasjekanaler , kanalfordelinger, ioniske konsentrasjoner, membrankapasitans, temperatur og andre faktorer.
De viktigste ionene som er involvert i et handlingspotensial er natrium- og kaliumkationer; natriumioner kommer inn i cellen, og kaliumioner forlater og gjenoppretter likevekten. Forholdsvis få ioner trenger å krysse membranen for at membranspenningen kan endre seg drastisk. Ionene som byttes ut under et handlingspotensial, gjør derfor en ubetydelig endring i de indre og ytre ioniske konsentrasjonene. De få ionene som krysser, pumpes ut igjen ved kontinuerlig virkning av natrium -kaliumpumpen , som sammen med andre ionetransportører opprettholder det normale forholdet mellom ionekonsentrasjoner over membranen. Kalsium- kationer og klorid- anioner er involvert i noen typer av aksjonspotensialer, slik som hjertets aksjonspotensial og virkningspotensialet i encellede alger Acetabularia hhv.
Selv om handlingspotensialer genereres lokalt på flekker av eksitabel membran, kan de resulterende strømmer utløse handlingspotensialer på nabostrekninger av membran, noe som utløser en domino-lignende forplantning. I motsetning til passiv spredning av elektriske potensialer ( elektrotonisk potensial ) genereres handlingspotensialer på nytt langs eksiterende membranstrekninger og forplanter seg uten forfall. Myeliniserte seksjoner av aksoner er ikke eksiterende og produserer ikke handlingspotensialer, og signalet forplantes passivt som elektrotonisk potensial . Umyeliniserte flekker med jevne mellomrom, kalt Ranviers noder , genererer handlingspotensialer for å øke signalet. Denne typen signaloverføring gir en gunstig avveining av signalhastighet og aksondiameter , kjent som saltende ledning . Depolarisering av aksonterminaler utløser generelt frigjøring av nevrotransmitter inn i den synaptiske kløften . I tillegg har det blitt registrert tilbakeproduserende handlingspotensialer i dendritene til pyramidale nevroner , som er allestedsnærværende i neocortex. Disse antas å ha en rolle i spike-timing-avhengig plastisitet .
I Hodgkin - Huxley membrankapasitansmodellen var overføringshastigheten til et handlingspotensial udefinert, og det ble antatt at tilstøtende områder ble depolarisert på grunn av frigjort ionforstyrrelse med nabokanaler. Målinger av ionediffusjon og radier har siden vist at dette ikke er mulig. Videre bestred motstridende målinger av entropiendringer og timing kapasitansmodellen som å virke alene. Alternativt antyder Gilbert Lings adsorpsjonshypotese at membranpotensialet og handlingspotensialet til en levende celle skyldes adsorpsjonen av mobile ioner på adsorpsjonssteder av celler.
Modning av de elektriske egenskapene til handlingspotensialet
Et nevrons evne til å generere og spre en handlingspotensial endres under utvikling . Hvor mye membranpotensialet av et neuron endres som resultat av en strømpuls er en funksjon av membranen inngangsmotstand . Når en celle vokser, blir flere kanaler lagt til membranen, noe som forårsaker en nedgang i inngangsmotstand. Et modent nevron gjennomgår også kortere endringer i membranpotensialet som svar på synaptiske strømmer. Nevroner fra en ilder lateral geniculate kjerne har en lengre tidskonstant og større spenningsavbøyning ved P0 enn de gjør ved P30. En konsekvens av den synkende varigheten av handlingspotensialet er at signalets troskap kan bevares som respons på høyfrekvent stimulering. Umodne nevroner er mer utsatt for synaptisk depresjon enn potensering etter høyfrekvent stimulering.
I den tidlige utviklingen av mange organismer bæres handlingspotensialet faktisk først av kalsiumstrøm i stedet for natriumstrøm . Den åpning og lukking kinetikk av kalsiumkanaler i løpet av utvikling er langsommere enn for de spenningsstyrte natriumkanaler som vil bære aksjonspotensialet i de modne neuroner. De lengre åpningstidene for kalsiumkanalene kan føre til handlingspotensialer som er betydelig langsommere enn for modne nevroner. Xenopus -nevroner har i utgangspunktet handlingspotensialer som tar 60–90 ms. Under utviklingen reduseres denne tiden til 1 ms. Det er to årsaker til denne drastiske nedgangen. For det første blir den innadgående strømmen hovedsakelig båret av natriumkanaler. For det andre øker den forsinkede likeretteren , en kaliumkanalstrøm , til 3,5 ganger sin opprinnelige styrke.
For at overgangen fra et kalsiumavhengig virkningspotensial til et natriumavhengig handlingspotensial skal fortsette må nye kanaler legges til membranen. Hvis Xenopus -nevroner vokser i et miljø med RNA -syntese eller proteinsyntesehemmere, forhindres denne overgangen. Selv den elektriske aktiviteten til selve cellen kan spille en rolle for kanaluttrykk. Hvis handlingspotensialer i Xenopus -myocytter blokkeres, forhindres eller forsinkes den typiske økningen i natrium- og kaliumstrømtetthet.
Denne modningen av elektriske egenskaper er sett på tvers av arter. Xenopus natrium- og kaliumstrømmer øker drastisk etter at et nevron går gjennom den siste fasen av mitose . Natriumstrømtettheten til rottekortikale nevroner øker med 600% i løpet av de to første postnatale ukene.
Nevrotransmisjon
Anatomi av et nevron
| Nevron |
|---|
Flere celletyper støtter et handlingspotensial, for eksempel planteceller, muskelceller og hjertets spesialiserte celler (der oppstår hjertekraftpotensialet ). Imidlertid er den viktigste spennende cellen nevronet , som også har den enkleste mekanismen for handlingspotensialet.
Nevroner er elektrisk exciterbare celler som generelt består av en eller flere dendritter, en enkelt soma , en enkelt axon og en eller flere aksonterminaler . Dendritter er mobilprojeksjoner hvis hovedfunksjon er å motta synaptiske signaler. Deres fremspring, kjent som dendritiske pigger , er designet for å fange nevrotransmitterne som frigjøres av det presynaptiske nevronet. De har en høy konsentrasjon av ligandgaterte ionekanaler . Disse piggene har en tynn hals som forbinder et løvformet fremspring med dendritten. Dette sikrer at endringer som skjer inne i ryggraden er mindre sannsynlige for å påvirke naboryggene. Den dendrittiske ryggraden kan, med sjeldne unntak (se LTP ), fungere som en uavhengig enhet. Dendritene strekker seg fra somaen, som huser kjernen , og mange av de "normale" eukaryote organellene. I motsetning til piggene, er overflaten av soma befolket av spenningsaktiverte ionekanaler. Disse kanalene hjelper til med å overføre signalene som genereres av dendritene. Axon hillock kommer ut fra somaen . Denne regionen er preget av å ha en veldig høy konsentrasjon av spenningsaktiverte natriumkanaler. Generelt anses det å være initieringssonen for pigger for handlingspotensialer, dvs. utløsersonen . Flere signaler generert ved ryggraden, og overført av somaene, konvergerer alle hit. Umiddelbart etter Axon Hillock er Axon. Dette er et tynt rørformet fremspring som beveger seg bort fra somaen. Axonet er isolert av et myelinskjede . Myelin består av enten Schwann -celler (i det perifere nervesystemet) eller oligodendrocytter (i sentralnervesystemet), som begge er typer glialceller . Selv om glialceller ikke er involvert i overføring av elektriske signaler, kommuniserer de og gir viktig biokjemisk støtte til nevroner. For å være spesifikk, vikler myelin seg flere ganger rundt det aksonale segmentet og danner et tykt fettlag som forhindrer ioner i å komme inn eller unnslippe axonet. Denne isolasjonen forhindrer betydelig signalforfall, i tillegg til å sikre raskere signalhastighet. Denne isolasjonen har imidlertid begrensningen at ingen kanaler kan være tilstede på overflaten av aksonet. Det er derfor flekker av membran med jevne mellomrom, som ikke har isolasjon. Disse nodene til Ranvier kan betraktes som "mini axon hillocks", ettersom formålet er å øke signalet for å forhindre betydelig signalforfall. I den lengste enden mister axonen sin isolasjon og begynner å forgrene seg til flere aksonterminaler . Disse presynaptiske terminalene, eller synaptiske boutoner, er et spesialisert område innenfor aksonen i den presynaptiske cellen som inneholder nevrotransmittere innesluttet i små membranbundne sfærer kalt synaptiske vesikler .
Initiering
Før vi vurderer forplantningen av handlingspotensialer langs aksoner og deres avslutning ved de synaptiske knottene, er det nyttig å vurdere metodene for hvordan potensialpotensialer kan initieres ved axonhøyden . Det grunnleggende kravet er at membranspenningen ved åsen heves over terskelen for avfyring. Det er flere måter denne depolarisasjonen kan skje på.

Dynamikk
Handlingspotensialer initieres oftest av eksitatoriske postsynaptiske potensialer fra et presynaptisk nevron. Vanligvis frigjøres nevrotransmittermolekyler av det presynaptiske nevronet . Disse nevrotransmitterne bindes deretter til reseptorer på den postsynaptiske cellen. Denne bindingen åpner forskjellige typer ionekanaler . Denne åpningen har ytterligere effekt av å endre den lokale permeabiliteten til cellemembranen og dermed membranpotensialet. Hvis bindingen øker spenningen (depolariserer membranen), er synapsen eksitatorisk. Hvis bindingen imidlertid reduserer spenningen (hyperpolariserer membranen), er den hemmende. Enten spenningen økes eller reduseres, forplanter endringen seg passivt til nærliggende områder av membranen (som beskrevet av kabelligningen og dens forbedringer). Vanligvis avtar spenningsstimulus eksponentielt med avstanden fra synapsen og med tiden fra bindingen av nevrotransmitteren. Noen brøkdeler av en eksitatorisk spenning kan nå aksonhøyden og kan (i sjeldne tilfeller) depolarisere membranen nok til å provosere til et nytt handlingspotensial. Mer typisk, må de eksitatoriske potensialer fra flere synapser arbeide sammen på nesten samme tid til å provosere en ny aksjonspotensial. Deres felles innsats kan imidlertid motvirkes av de motvirkende hemmende postsynaptiske potensialene .
Neurotransmisjon kan også skje gjennom elektriske synapser . På grunn av den direkte forbindelsen mellom eksitable celler i form av gapekryss , kan et handlingspotensial overføres direkte fra en celle til den neste i begge retninger. Den frie flyt av ioner mellom celler muliggjør rask ikke-kjemisk-mediert overføring. Retterende kanaler sikrer at handlingspotensialer bare beveger seg i én retning gjennom en elektrisk synapse. Elektriske synapser finnes i alle nervesystemer, inkludert den menneskelige hjerne, selv om de er en distinkt minoritet.
"Alt-eller-ingen" -prinsipp
Den amplituden av et aksjonspotensial er uavhengig av mengden strøm som produserte det. Med andre ord, større strømmer skaper ikke større handlingspotensialer. Derfor sies handlingspotensialer å være alt-eller-ingen- signaler, siden enten oppstår de fullt ut eller så oppstår de ikke i det hele tatt. Dette er i motsetning til reseptorpotensialer , hvis amplituder er avhengig av intensiteten til en stimulus. I begge tilfeller er frekvensen av handlingspotensialer korrelert med intensiteten til en stimulans.
Sensoriske nevroner
I sensoriske nevroner kobles et eksternt signal som trykk, temperatur, lys eller lyd med åpning og lukking av ionekanaler , noe som igjen endrer de ioniske permeabilitetene til membranen og dens spenning. Disse spenningsendringene kan igjen være eksitatoriske (depolariserende) eller hemmende (hyperpolariserende), og i noen sensoriske nevroner kan deres kombinerte effekter depolarisere axonhellingen nok til å provosere handlingspotensialer. Noen eksempler på mennesker inkluderer luktreseptoren nevron og Meissners corpuscle , som er kritiske for henholdsvis luktesansen og berøring . Imidlertid konverterer ikke alle sensoriske nevroner sine eksterne signaler til handlingspotensialer; noen har ikke engang et axon. I stedet kan de konvertere signalet til frigjøring av en nevrotransmitter , eller til kontinuerlige graderte potensialer , som begge kan stimulere påfølgende nevroner til å avfyre et handlingspotensial. For eksempel, i det menneskelige øret , konverterer hårceller den innkommende lyden til åpning og lukking av mekanisk gatede ionekanaler , noe som kan føre til at neurotransmittermolekyler frigjøres. På lignende måte, i den menneskelige netthinnen , produserer ikke de første fotoreseptorcellene og det neste cellelaget (omfattende bipolare celler og horisontale celler ) handlingspotensialer; bare noen amakrinceller og det tredje laget, ganglioncellene , produserer handlingspotensialer, som deretter beveger seg oppover synsnerven .
Pacemaker potensialer
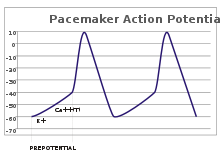
I sensoriske nevroner oppstår handlingspotensialer fra en ekstern stimulans. Noen opphissede celler krever imidlertid ingen slik stimulans til å skyte: De depolariserer spontant aksonskråningen og brenner handlingspotensialer med en vanlig hastighet, som en intern klokke. Spenningssporene til slike celler er kjent som pacemaker -potensialer . De pacemaker cellene i sinusknute i hjertet gir et godt eksempel. Selv om slike pacemaker -potensialer har en naturlig rytme , kan den justeres av eksterne stimuli; for eksempel kan pulsen endres av legemidler så vel som signaler fra de sympatiske og parasympatiske nerver. De eksterne stimuli forårsaker ikke cellens repeterende avfyring, men endrer bare tidspunktet. I noen tilfeller kan reguleringen av frekvensen være mer kompleks, noe som fører til mønstre av handlingspotensialer, for eksempel sprengning .
Faser
Handlingspotensialets forløp kan deles inn i fem deler: stigende fase, toppfase, fallende fase, undersøkelsesfase og ildfast periode. Under stigende fase depolariseres membranpotensialet (blir mer positivt). Punktet der depolarisering stopper kalles toppfasen. På dette stadiet når membranpotensialet et maksimum. Etter dette er det en fallende fase. I løpet av dette stadiet blir membranpotensialet mer negativt og går tilbake til hvilepotensial. Underskuddet , eller etterhyperpolarisering , fase er perioden hvor membranpotensialet midlertidig blir mer negativt ladet enn når det er i ro (hyperpolarisert). Til slutt kalles den tiden et påfølgende potensial for handling er umulig eller vanskelig å fyre for den ildfaste perioden , som kan overlappe med de andre fasene.
Handlingspotensialets forløp bestemmes av to koblede effekter. For det første åpnes og lukkes spenningssensitive ionekanaler som svar på endringer i membranspenningen V m . Dette endrer membranens permeabilitet for disse ionene. For det andre, i henhold til Goldman ligning , denne endringen i permeabilitet forandrer likevektspotensialet E m , og dermed membranen spenningen V m . Dermed påvirker membranpotensialet permeabiliteten, som deretter påvirker membranpotensialet ytterligere. Dette gir mulighet for positiv tilbakemelding , som er en sentral del av den stigende fasen av handlingspotensialet. En kompliserende faktor er at en enkelt ion kanal kan ha flere interne "porter" som respons på endringer i V m i motsatte måter, eller med forskjellige satser. For eksempel, selv om heving av V m åpner de fleste portene i den spenningssensitive natriumkanalen, lukker den også kanalens "inaktiveringsport", om enn saktere. Derfor, når V m blir hevet plutselig, åpnes natriumkanalene først, men lukkes deretter på grunn av den langsommere inaktiveringen.
Spenningene og strømningene til handlingspotensialet i alle dets faser ble modellert nøyaktig av Alan Lloyd Hodgkin og Andrew Huxley i 1952, som de ble tildelt Nobelprisen i fysiologi eller medisin i 1963. Imidlertid vurderer modellen deres bare to typer spenningssensitive ionekanaler, og gjør flere antagelser om dem, for eksempel at deres indre porter åpnes og lukkes uavhengig av hverandre. I virkeligheten er det mange typer ionekanaler, og de åpnes og lukkes ikke alltid uavhengig av hverandre.
Stimulering og stigende fase
Et typisk handlingspotensial begynner på axonhøyden med en tilstrekkelig sterk depolarisering, f.eks. En stimulus som øker V m . Dette depolarisasjon er ofte forårsaket av injeksjon av ekstra natrium- kationer inn i cellen; disse kationene kan komme fra en lang rekke kilder, for eksempel kjemiske synapser , sensoriske nevroner eller pacemakerpotensialer .
For et nevron i hvile er det en høy konsentrasjon av natrium- og kloridioner i den ekstracellulære væsken sammenlignet med den intracellulære væsken , mens det er en høy konsentrasjon av kaliumioner i den intracellulære væsken sammenlignet med den ekstracellulære væsken. Forskjellen i konsentrasjoner, som får ioner til å bevege seg fra en høy til en lav konsentrasjon , og elektrostatiske effekter (tiltrekning av motsatte ladninger) er ansvarlig for bevegelsen av ioner inn og ut av nevronet. Innsiden av et nevron har en negativ ladning i forhold til celleens ytre, fra bevegelsen av K + ut av cellen. Neuronmembranen er mer permeabel for K + enn for andre ioner, slik at dette ionet selektivt kan bevege seg ut av cellen, nedover konsentrasjonsgradienten. Denne konsentrasjonsgradienten sammen med kaliumlekkakanaler som er tilstede på nevronmembranen forårsaker en strøm av kaliumioner som gjør hvilepotensialet nær E K ≈ –75 mV. Siden Na + -ioner er i høyere konsentrasjoner utenfor cellen, driver konsentrasjonen og spenningsforskjellene dem inn i cellen når Na + -kanaler åpnes. Depolarisering åpner både natrium- og kaliumkanalene i membranen, slik at ionene kan strømme henholdsvis inn og ut av axonet. Hvis depolarisasjonen er liten (for eksempel å øke V m fra -70 mV til -60 mV), overstyrer den utadvendte kaliumstrømmen den innadgående natriumstrømmen og membranen repolariserer tilbake til sitt normale hvilepotensial rundt -70 mV. Men hvis depolarisasjonen er stor nok, øker den innadgående natriumstrømmen mer enn den utadgående kaliumstrømmen og en løpende tilstand ( positiv tilbakemelding ) resulterer: jo mer innadgående strøm det er, jo mer V m øker, noe som igjen øker innover strøm. En tilstrekkelig sterk depolarisering (økning i V m ) får de spenningssensitive natriumkanalene til å åpne seg; den økende permeabiliteten for natrium driver V m nærmere natrium -likevektsspenningen E Na ≈ +55 mV. Den økende spenningen fører igjen til at enda flere natriumkanaler åpnes, noe som skyver V m ytterligere mot E Na . Denne positive tilbakemeldingen fortsetter til natriumkanalene er helt åpne og V m er nær E Na . Den kraftige økningen i V m og natriumpermeabilitet tilsvarer stigende fase av handlingspotensialet.
Den kritiske terskelspenningen for denne løpende tilstanden er vanligvis rundt -45 mV, men det avhenger av den siste aktiviteten til axonet. En celle som nettopp har avfyrt et handlingspotensial, kan ikke skyte en annen umiddelbart, siden Na + -kanalene ikke har kommet seg etter den inaktiverte tilstanden. Perioden der det ikke kan avfyres noe nytt handlingspotensial kalles den absolutte ildfaste perioden . På lengre tid, etter at noen men ikke alle ionekanalene har kommet seg, kan axonet stimuleres til å produsere et annet aksjonspotensial, men med en høyere terskel, som krever en mye sterkere depolarisering, f.eks. Til -30 mV. Perioden hvor handlingspotensialer er uvanlig vanskelig å fremkalle kalles den relative ildfaste perioden .
Toppfase
Den positive tilbakemeldingen fra stigende fase bremser og stopper ettersom natriumionkanalene blir maksimalt åpne. På toppen av aksjonspotensialet, blir natrium-permeabiliteten maksimert, og membranen spenningen V m er nesten lik den til natriumlikevektsspenningen E Na . Imidlertid slår den samme økte spenningen som åpnet natriumkanalene i utgangspunktet også sakte dem ved å lukke porene; natriumkanalene blir inaktiverte . Dette senker membranens permeabilitet for natrium i forhold til kalium, og driver membranspenningen tilbake mot hvileverdien. Samtidig åpner den økte spenningen spenningssensitive kaliumkanaler; økningen i membranens permeabilitet kalium driver V m mot E K . Til sammen fører disse endringene i natrium- og kaliumpermeabilitet til at V m synker raskt, repolariserer membranen og produserer "fallfasen" av handlingspotensialet.
Etterhyperpolarisering
Den depolariserte spenningen åpner ytterligere spenningsavhengige kaliumkanaler, og noen av disse stenger ikke med en gang når membranen går tilbake til sin normale hvilespenning. I tillegg åpnes ytterligere kaliumkanaler som reaksjon på tilstrømningen av kalsiumioner under handlingspotensialet. Den intracellulære konsentrasjon av kaliumioner er forbigående usedvanlig lav, noe som gjør at membranspenningen V m enda nærmere kaliumlikevektsspenningen E K . Membranpotensialet går under hvilemembranpotensialet. Derfor er det en undershoot eller hyperpolarisering , betegnet en afterhyperpolarisering , som vedvarer til membrankaliumpermeabiliteten går tilbake til sin vanlige verdi, og gjenoppretter membranpotensialet til hviletilstanden.
Ildfast periode
Hvert handlingspotensial blir fulgt av en ildfast periode , som kan deles inn i en absolutt ildfast periode , hvor det er umulig å fremkalle et annet handlingspotensial, og deretter en relativ ildfast periode , hvor det kreves en sterkere enn vanlig stimulans. Disse to ildfaste periodene er forårsaket av endringer i tilstanden til natrium- og kaliumkanalmolekyler. Når de lukkes etter et handlingspotensial, går natriumkanaler inn i en "inaktivert" tilstand , der de ikke kan åpnes uavhengig av membranpotensialet - dette gir opphav til den absolutte ildfaste perioden. Selv etter at et tilstrekkelig antall natriumkanaler har gått over til hviletilstand, skjer det ofte at en brøkdel av kaliumkanaler forblir åpne, noe som gjør det vanskelig for membranpotensialet å depolarisere, og derved gi opphav til den relative ildfaste perioden. Fordi tettheten og undertyper av kaliumkanaler kan variere sterkt mellom forskjellige typer nevroner, er varigheten av den relative ildfaste perioden svært variabel.
Den absolutte ildfaste perioden er i stor grad ansvarlig for enveis spredning av handlingspotensialer langs aksoner. Til enhver tid er plasteret av axon bak den aktivt piggende delen ildfast, men lappen foran, som ikke har blitt aktivert nylig, kan stimuleres av depolarisasjonen fra handlingspotensialet.
Formering
Handlingspotensialet som genereres ved axon hillock forplanter seg som en bølge langs axonet. Strømmene som strømmer innover på et punkt på aksonet under et aksjonspotensial spredte seg langs aksonet, og depolariserer de tilstøtende delene av membranen. Hvis den er tilstrekkelig sterk, fremkaller denne depolarisasjonen et lignende handlingspotensial ved de nærliggende membranplastene. Denne grunnleggende mekanismen ble demonstrert av Alan Lloyd Hodgkin i 1937. Etter å ha knust eller avkjølt nervesegmenter og dermed blokkert handlingspotensialene, viste han at et handlingspotensial som ankom på den ene siden av blokken kunne provosere et annet handlingspotensial på den andre, forutsatt at blokkert segment var tilstrekkelig kort.
Når et handlingspotensial har oppstått ved en lapp av membran, trenger membranplasteret tid til å komme seg før det kan fyre igjen. På molekylært nivå tilsvarer denne absolutte ildfaste perioden tiden det tar for de spenningsaktiverte natriumkanalene å komme seg etter inaktivering, dvs. å gå tilbake til lukket tilstand. Det er mange typer spenningsaktiverte kaliumkanaler i nevroner. Noen av dem inaktiverer raskt (A-type strømmer) og noen av dem inaktiverer sakte eller ikke inaktiverer i det hele tatt; denne variabiliteten garanterer at det alltid vil være en tilgjengelig strømkilde for repolarisering, selv om noen av kaliumkanalene er inaktivert på grunn av foregående depolarisering. På den annen side inaktiveres alle nevronale spenningsaktiverte natriumkanaler i løpet av flere millisekunder under sterk depolarisering, og gjør det derfor umulig å følge depolarisering før en betydelig brøkdel av natriumkanaler har kommet tilbake til lukket tilstand. Selv om det begrenser skytefrekvensen, sikrer den absolutte ildfaste perioden at handlingspotensialet beveger seg i bare én retning langs et axon. Strømmene som strømmer inn på grunn av et aksjonspotensial som spredte seg i begge retninger langs aksonet. Imidlertid er det bare den ubrente delen av aksonet som kan reagere med et handlingspotensial; delen som nettopp har avfyrt reagerer ikke før handlingspotensialet er trygt utenfor rekkevidde og ikke kan restimulere den delen. I den vanlige ortodromiske ledningen forplanter aksjonspotensialet seg fra axonhøyden mot de synaptiske knottene (den aksonale terminalen); forplantning i motsatt retning - kjent som antidromisk ledning - er svært sjelden. Imidlertid, hvis et laboratoriumakson blir stimulert i midten, er begge halvdelene av aksonen "friske", dvs. ubrente; da vil to handlingspotensialer bli generert, den ene beveger seg mot axonhøyden og den andre reiser mot de synaptiske knottene.
Myelin og saltende ledning

For å muliggjøre rask og effektiv transduksjon av elektriske signaler i nervesystemet, er visse nevronale aksoner dekket med myelinskjeder . Myelin er en multilamellær membran som omslutter aksonet i segmenter atskilt med intervaller kjent som noder av Ranvier . Den produseres av spesialiserte celler: Schwann -celler utelukkende i det perifere nervesystemet , og oligodendrocytter utelukkende i sentralnervesystemet . Myelinkappe reduserer membrankapasitansen og øker membranmotstanden i inter-nodeintervallene, og tillater dermed en rask, saltatorisk bevegelse av handlingspotensialer fra node til node. Myelinering finnes hovedsakelig hos virveldyr , men et analogt system har blitt oppdaget hos noen få virvelløse dyr, for eksempel noen reker . Ikke alle nevroner hos virveldyr er myeliniserte; for eksempel er axoner av nevronene som omfatter det autonome nervesystemet generelt ikke myeliniserte.
Myelin forhindrer at ioner kommer inn eller forlater axonet langs myeliniserte segmenter. Som hovedregel øker myelinisering ledningshastigheten til handlingspotensialer og gjør dem mer energieffektive. Uansett om det er saltende eller ikke, varierer gjennomsnittlig ledningshastighet for et handlingspotensial fra 1 meter per sekund (m/s) til over 100 m/s, og øker generelt med aksonal diameter.
Handlingspotensialer kan ikke forplante seg gjennom membranen i myeliniserte segmenter av axonet. Imidlertid bæres strømmen av cytoplasma, som er tilstrekkelig til å depolarisere den første eller andre påfølgende noden til Ranvier . I stedet provoserer ionestrømmen fra et aksjonspotensial ved en node i Ranvier et annet handlingspotensial ved neste node; denne tilsynelatende "hoppingen" av handlingspotensialet fra node til node er kjent som saltatorisk ledning . Selv om mekanismen for saltende ledning ble foreslått i 1925 av Ralph Lillie, kom de første eksperimentelle bevisene for saltende ledning fra Ichiji Tasaki og Taiji Takeuchi og fra Andrew Huxley og Robert Stämpfli. I kontrast, i ikke -myeliniserte aksoner, fremkaller handlingspotensialet en annen i membranen like ved, og beveger seg kontinuerlig nedover aksonet som en bølge.

Myelin har to viktige fordeler: rask ledningshastighet og energieffektivitet. For aksoner større enn en minimumsdiameter (omtrent 1 mikrometer ), øker myelinisering ledningshastigheten til et handlingspotensial, vanligvis ti ganger. Motsatt, for en gitt ledningshastighet, er myeliniserte fibre mindre enn deres umyeliniserte motstykker. For eksempel beveger aksjonspotensialer seg med omtrent samme hastighet (25 m/s) i et myelinisert froskakson og et umyelinisert blekksprutgigantakson , men froskeaksonen har en omtrent 30 ganger mindre diameter og 1000 ganger mindre tverrsnittsareal . Siden ionestrømmene er begrenset til Ranviers noder, "lekker" langt færre ioner over membranen, noe som sparer metabolsk energi. Denne besparelsen er en betydelig selektiv fordel , siden det menneskelige nervesystemet bruker omtrent 20% av kroppens metabolske energi.
Lengden på axons myeliniserte segmenter er viktig for suksessen til saltende ledning. De bør være så lange som mulig for å maksimere ledningshastigheten, men ikke så lang at ankomstsignalet er for svakt til å provosere et handlingspotensial ved neste node i Ranvier. I naturen er myeliniserte segmenter generelt lange nok til at det passivt forplantede signalet kan bevege seg i minst to noder, samtidig som det beholder nok amplitude til å utløse et handlingspotensial ved den andre eller tredje noden. Dermed er sikkerhetsfaktoren for saltende ledning høy, slik at overføring kan omgå noder i tilfelle skade. Handlingspotensialer kan imidlertid ende for tidlig på visse steder der sikkerhetsfaktoren er lav, selv i umyeliniserte nevroner; et vanlig eksempel er grenpunktet til et axon, der det deler seg i to aksoner.
Noen sykdommer nedbryter myelin og svekker saltdannende ledning, noe som reduserer ledningshastigheten til virkningspotensialer. Den mest kjente av disse er multippel sklerose , der nedbrytning av myelin forringer koordinert bevegelse.
Kabelteori

Strømmestrømmen i et akson kan beskrives kvantitativt ved hjelp av kabelteori og dens utførelser, for eksempel rommodellen. Kabelteori ble utviklet i 1855 av Lord Kelvin for å modellere den transatlantiske telegrafkabelen og ble vist å være relevant for nevroner av Hodgkin og Rushton i 1946. I enkel kabelteori behandles nevronet som en elektrisk passiv, perfekt sylindrisk overføringskabel, som kan beskrives med en delvis differensialligning
hvor V ( x , t ) er spenningen over membranen på et tidspunkt t og en posisjon x langs lengden på nevronet, og hvor λ og τ er de karakteristiske lengde- og tidsskalaene som disse spenningene forfaller som respons på en stimulus . Med henvisning til kretsdiagrammet til høyre kan disse skalaene bestemmes ut fra motstandene og kapasitansene per lengdenhet.
Disse tids- og lengdeskalaene kan brukes til å forstå ledningshastighetens avhengighet av nevronets diameter i umyeliniserte fibre. For eksempel øker tidsskalaen τ med både membranmotstanden r m og kapasitansen c m . Når kapasitansen øker, må mer ladning overføres for å produsere en gitt transmembranspenning (ved ligningen Q = CV ); etter hvert som motstanden øker, overføres mindre ladning per tidsenhet, noe som gjør ekvilibreringen tregere. På samme måte, hvis den indre motstanden per lengdenhet r i er lavere i en akson enn på en annen (f.eks. Fordi radiusen til den førstnevnte er større), blir den romlige forfallslengden λ lengre og ledningshastigheten til et handlingspotensial bør øke. Hvis transmembranmotstanden r m økes, senker det den gjennomsnittlige "lekkasjestrømmen" over membranen, og får λ til å bli lengre, noe som øker ledningshastigheten.
Avslutning
Kjemiske synapser
Generelt forårsaker handlingspotensialer som når de synaptiske knottene at en nevrotransmitter slippes ut i den synaptiske kløften. Nevrotransmittere er små molekyler som kan åpne ionekanaler i den postsynaptiske cellen; de fleste aksoner har den samme nevrotransmitteren i alle endene. Ankomsten av handlingspotensialet åpner spenningssensitive kalsiumkanaler i den presynaptiske membranen; tilstrømningen av kalsium får vesikler fylt med nevrotransmitter til å migrere til celleoverflaten og frigjøre innholdet i den synaptiske spalten . Denne komplekse prosessen hemmes av nevrotoksinene tetanospasmin og botulinumtoksin , som er ansvarlige for henholdsvis tetanus og botulisme .

Elektriske synapser
Noen synapser dispenserer fra "mellommannen" til nevrotransmitteren, og kobler de presynaptiske og postsynaptiske cellene sammen. Når et handlingspotensial når en slik synapse, kan ionestrømmene som strømmer inn i den presynaptiske cellen krysse barrieren til de to cellemembranene og komme inn i den postsynaptiske cellen gjennom porer kjent som konnexoner . Dermed kan ionestrømmene i det presynaptiske handlingspotensialet direkte stimulere den postsynaptiske cellen. Elektriske synapser gir raskere overføring fordi de ikke krever langsom diffusjon av nevrotransmittere over den synaptiske kløften. Derfor brukes elektriske synapser når rask respons og koordinering av timing er avgjørende, som i fluktreflekser , netthinnen til virveldyr og hjertet .
Nevromuskulære veikryss
Et spesielt tilfelle av en kjemisk synapse er det nevromuskulære krysset , der aksonet til et motorisk nevron ender på en muskelfiber . I slike tilfeller er den frigjorte nevrotransmitteren acetylkolin , som binder seg til acetylkolinreseptoren, et integrert membranprotein i membranen ( sarcolemma ) i muskelfiberen. Acetylkolin forblir imidlertid ikke bundet; den dissosierer heller og hydrolyseres av enzymet, acetylkolinesterase , som ligger i synapsen. Dette enzymet reduserer raskt stimulansen til muskelen, noe som gjør at graden og timingen av muskelsammentrekning kan reguleres delikat. Noen giftstoffer inaktiverer acetylkolinesterase for å forhindre denne kontrollen, for eksempel nervemidlene sarin og tabun , og insektmidlene diazinon og malathion .
Andre celletyper
Hjertehandlingspotensialer

Hjertevirkningspotensialet skiller seg fra det nevronale handlingspotensialet ved å ha et utvidet platå, der membranen holdes ved høy spenning i noen hundre millisekunder før den blir repolarisert av kaliumstrømmen som vanlig. Dette platået skyldes virkningen av langsommere kalsiumkanaler som åpner og holder membranspenningen nær deres likevektspotensial, selv etter at natriumkanalene har inaktivert.
Hjertehandlingspotensialet spiller en viktig rolle i å koordinere hjertets sammentrekning. Hjertecellene i sinoatrialknuten gir pacemakerpotensialet som synkroniserer hjertet. Handlingspotensialene til disse cellene forplanter seg til og gjennom den atrioventrikulære noden (AV -noden), som normalt er den eneste ledningsveien mellom atria og ventriklene . Handlingspotensialer fra AV -noden beveger seg gjennom bunten av His og derfra til Purkinje -fibrene . Motsatt kan anomalier i hjerteaksjonspotensialet - enten det skyldes en medfødt mutasjon eller skade - føre til menneskelige patologier, spesielt arytmier . Flere legemidler mot arytmi virker på potensialet for hjertevirkning, for eksempel kinidin , lidokain , betablokkere og verapamil .
Muskelaktive potensialer
Handlingspotensialet i en normal skjelettmuskelcelle ligner handlingspotensialet i nevroner. Handlingspotensialer skyldes depolarisering av cellemembranen ( sarcolemma ), som åpner spenningssensitive natriumkanaler; disse blir inaktiverte og membranen repolariseres gjennom den utgående strømmen av kaliumioner. Hvilepotensialet før handlingspotensialet er vanligvis −90mV, noe mer negativt enn typiske nevroner. Muskelaksjonspotensialet varer omtrent 2–4 ms, den absolutte ildfaste perioden er omtrent 1–3 ms, og ledningshastigheten langs muskelen er omtrent 5 m/s. Handlingspotensialet frigjør kalsiumioner som frigjør tropomyosinet og lar muskelen trekke seg sammen. Muskelhandlingspotensialer provoseres av ankomsten av et pre-synaptisk nevronalt handlingspotensial ved det nevromuskulære krysset , som er et vanlig mål for nevrotoksiner .
Plantehandlingspotensialer
Plante- og soppceller er også elektrisk eksitable. Den grunnleggende forskjellen fra dyrehandlingspotensialer er at depolarisasjonen i planteceller ikke oppnås ved opptak av positive natriumioner, men ved frigjøring av negative kloridioner . I 1906 publiserte JC Bose de første målingene av handlingspotensialer i planter, som tidligere hadde blitt oppdaget av Burdon-Sanderson og Darwin. En økning i cytoplasmatiske kalsiumioner kan være årsaken til frigjøring av anioner til cellen. Dette gjør kalsium til en forløper for ionebevegelser, for eksempel tilstrømning av negative kloridioner og utstrømning av positive kaliumioner, sett i byggblader.
Den første tilstrømningen av kalsiumioner utgjør også en liten cellulær depolarisering, noe som får de spenningsstyrte ionekanalene til å åpne seg og tillater full depolarisering å forplante seg av kloridioner.
Noen planter (f.eks. Dionaea muscipula ) bruker natriumgatede kanaler for å betjene bevegelser og egentlig "telle". Dionaea muscipula , også kjent som Venus flytrap, finnes i subtropiske våtmarker i Nord- og Sør -Carolina. Når det er dårlige jordnæringsstoffer, er flytrap avhengig av en diett av insekter og dyr. Til tross for forskning på planten, mangler det en forståelse bak det molekylære grunnlaget for Venus flytraps og kjøttetende planter generelt.
Imidlertid har det blitt gjort mye forskning på handlingspotensialer og hvordan de påvirker bevegelse og urverk i Venus flytrap. Til å begynne med er hvilemembranpotensialet til Venus flytrap (-120mV) lavere enn dyreceller (vanligvis -90mV til -40mV). Det lavere hvilepotensialet gjør det lettere å aktivere et handlingspotensial. Således, når et insekt lander på fellen til planten, utløser det en hårlignende mekanoreceptor. Denne reseptoren aktiverer deretter et handlingspotensial som varer rundt 1,5 ms. Til syvende og sist forårsaker dette en økning av positive kalsiumioner inn i cellen, noe som depolariserer den litt.
Flyfellen lukker imidlertid ikke etter en utløser. I stedet krever det aktivering av 2 eller flere hår. Hvis bare ett hår blir utløst, kaster det aktiveringen som en falsk positiv. Videre må det andre håret aktiveres innen et bestemt tidsintervall (0,75 s - 40 s) for at det skal registreres med den første aktiveringen. Dermed starter en opphopning av kalsium og faller sakte fra den første utløseren. Når det andre handlingspotensialet avfyres innen tidsintervallet, når det kalsiumterskelen for å depolarisere cellen, og lukker fellen på byttet innen en brøkdel av et sekund.
Sammen med den påfølgende frigjøringen av positive kaliumioner innebærer handlingspotensialet i planter et osmotisk tap av salt (KCl). Mens dyrets virkningspotensial er osmotisk nøytralt fordi like store mengder inntrenging av natrium og kalium forlater hverandre, avbryter hverandre osmotisk. Samspillet mellom elektriske og osmotiske forhold i planteceller ser ut til å ha oppstått fra en osmotisk funksjon av elektrisk eksitabilitet hos vanlige encellede forfedre til planter og dyr under endrede saltholdighetsforhold. Videre blir den nåværende funksjonen for rask signaloverføring sett på som en nyere prestasjon av metazoanceller i et mer stabilt osmotisk miljø. Det er sannsynlig at den kjente signalfunksjonen til handlingspotensialer i noen karplanter (f.eks. Mimosa pudica ) oppsto uavhengig av funksjonen i metazoaniske eksitable celler.
I motsetning til stigende fase og topp synes fallende fase og etter-hyperpolarisering først og fremst å avhenge av kationer som ikke er kalsium. For å starte repolarisering krever cellen bevegelse av kalium ut av cellen gjennom passiv transport på membranen. Dette skiller seg fra nevroner fordi bevegelsen av kalium ikke dominerer nedgangen i membranpotensial; Faktisk, for å fullstendig repolarisere, krever en plantecelle energi i form av ATP for å hjelpe til med frigjøring av hydrogen fra cellen-ved å bruke en transportør som vanligvis kalles H+-ATPase.
Taksonomisk fordeling og evolusjonære fordeler
Handlingspotensialer finnes i flercellede organismer , inkludert planter , virvelløse dyr som insekter og virveldyr som reptiler og pattedyr . Svamper ser ut til å være hovedfyllet til flercellede eukaryoter som ikke overfører handlingspotensialer, selv om noen studier har antydet at disse organismer også har en form for elektrisk signalering. Hvilepotensialet, så vel som størrelsen og varigheten av handlingspotensialet, har ikke variert mye med evolusjonen, selv om ledningshastigheten varierer dramatisk med aksonal diameter og myelinisering.
| Dyr | Celletype | Hvilepotensial (mV) | AP -økning (mV) | AP -varighet (ms) | Ledningshastighet (m/s) |
|---|---|---|---|---|---|
| Blekksprut ( Loligo ) | Kjempe axon | −60 | 120 | 0,75 | 35 |
| Meitemark ( Lumbricus ) | Median gigantisk fiber | −70 | 100 | 1.0 | 30 |
| Kakerlakk ( Periplaneta ) | Kjempe fiber | −70 | 80–104 | 0,4 | 10 |
| Frosk ( Rana ) | Ischiasnerven axon | −60 til −80 | 110–130 | 1.0 | 7–30 |
| Cat ( Felis ) | Spinal motorisk nevron | −55 til −80 | 80–110 | 1–1.5 | 30–120 |
Gitt bevaring gjennom evolusjonen, ser det ut til at handlingspotensialet gir evolusjonære fordeler. En funksjon av handlingspotensialer er rask, langdistansesignalering i organismen; ledningshastigheten kan overstige 110 m/s, som er en tredjedel av lydens hastighet . Til sammenligning beveger et hormonmolekyl seg i blodet omtrent 8 m/s i store arterier. En del av denne funksjonen er den tette koordineringen av mekaniske hendelser, for eksempel sammentrekning av hjertet. En annen funksjon er beregningen knyttet til generasjonen. Som et alt-eller-ingen-signal som ikke forfaller med overføringsavstand, har handlingspotensialet lignende fordeler som digital elektronikk . Integreringen av forskjellige dendritiske signaler ved axonhøyden og dens terskel for å danne et komplekst handlingspotensial er en annen form for beregning, en som har blitt utnyttet biologisk for å danne sentrale mønstergeneratorer og etterlignet i kunstige nevrale nettverk .
Den vanlige prokaryote/eukaryote forfaren, som levde for kanskje fire milliarder år siden, antas å ha hatt spenningsgater. Denne funksjonaliteten var sannsynligvis på et senere tidspunkt tverrrettet for å gi en kommunikasjonsmekanisme. Selv moderne encellede bakterier kan utnytte handlingspotensialer for å kommunisere med andre bakterier i samme biofilm.
Eksperimentelle metoder

Studien av handlingspotensialer har krevd utvikling av nye eksperimentelle metoder. Det første arbeidet, før 1955, ble først og fremst utført av Alan Lloyd Hodgkin og Andrew Fielding Huxley , som sammen med John Carew Eccles ble tildelt Nobelprisen i fysiologi eller medisin i 1963 for deres bidrag til beskrivelsen av det ioniske grunnlaget for nerve ledning. Den fokuserte på tre mål: å isolere signaler fra enkeltneuroner eller aksoner, utvikle rask, sensitiv elektronikk og krympe elektroder nok til at spenningen inne i en enkelt celle kunne registreres.
Det første problemet ble løst ved å studere de gigantiske aksonene som ble funnet i nevronene til blekkspruten ( Loligo forbesii og Doryteuthis pealeii , på den tiden klassifisert som Loligo pealeii ). Disse aksonene er så store i diameter (omtrent 1 mm eller 100 ganger større enn en typisk nevron) at de kan sees med det blotte øye, noe som gjør dem enkle å trekke ut og manipulere. Imidlertid er de ikke representative for alle eksiterende celler, og mange andre systemer med handlingspotensialer har blitt studert.
Det andre problemet ble adressert med den avgjørende utviklingen av spenningsklemmen , som tillot eksperimentelle å studere ionestrømmene som ligger bak et handlingspotensial isolert, og eliminerte en sentral kilde til elektronisk støy , strømmen I C assosiert med kapasitansen C til membranen . Fordi strømmen er lik C- ganger hastigheten av forandring av den transmembrane spenning V m , ble løsningen for å lage en krets som holdt V m fast (null endringshastighet), uavhengig av de strømmer som flyter over membranen. Dermed er strømmen som kreves for å holde V m på en fast verdi en direkte refleksjon av strømmen som strømmer gjennom membranen. Andre elektroniske fremskritt inkluderte bruk av Faraday -merder og elektronikk med høy inngangsimpedans , slik at selve målingen ikke påvirket spenningen som ble målt.
Det tredje problemet, det å skaffe elektroder som er små nok til å registrere spenninger i en enkelt akson uten å forstyrre den, ble løst i 1949 med oppfinnelsen av glassmikropipettelektroden, som raskt ble adoptert av andre forskere. Forbedringer av denne metoden er i stand til å produsere elektrodespisser som er så fine som 100 Å (10 nm ), noe som også gir høy inngangsimpedans. Aksjonspotensialer kan også registreres med små metallelektroder plassert like ved siden av et neuron med neurochips inneholder EOSFETs , eller optisk med fargestoffer som er følsomme for Ca 2+ eller til spenning.

Mens mikropipettelektroder i glass måler summen av strømmer som passerer gjennom mange ionekanaler, ble det mulig å studere de elektriske egenskapene til en enkelt ionekanal på 1970 -tallet med utviklingen av lappeklemmen av Erwin Neher og Bert Sakmann . For denne oppdagelsen ble de tildelt Nobelprisen i fysiologi eller medisin i 1991. Patch-clamping bekreftet at ioniske kanaler har diskrete konduktansetilstander, for eksempel åpne, lukkede og inaktiverte.
Optiske avbildningsteknologier har blitt utviklet de siste årene for å måle handlingspotensialer, enten via samtidige multiside-opptak eller med ultra-romlig oppløsning. Ved bruk av spenningssensitive fargestoffer er handlingspotensialer registrert optisk fra en liten patch av kardiomyocyttmembran .
Nevrotoksiner

Flere nevrotoksiner , både naturlige og syntetiske, er designet for å blokkere handlingspotensialet. Tetrodotoksin fra pufferfish og saksitoksin fra Gonyaulax ( dinoflagellat- slekten som er ansvarlig for " røde tidevann ") blokkerer virkningspotensialer ved å hemme den spenningssensitive natriumkanalen; På samme måte hemmer dendrotoksin fra den svarte mambaslangen den spenningssensitive kaliumkanalen. Slike hemmere av ionekanaler tjener et viktig forskningsformål, ved at forskere kan "slå av" bestemte kanaler etter ønske, og dermed isolere de andre kanalers bidrag; de kan også være nyttige ved rensing av ionekanaler ved affinitetskromatografi eller ved analyse av konsentrasjonen. Imidlertid gjør slike hemmere også effektive nevrotoksiner, og har blitt vurdert for bruk som kjemiske våpen . Neurotoksiner rettet mot ionekanalene til insekter har vært effektive insektmidler ; et eksempel er det syntetiske permetrinet , som forlenger aktiveringen av natriumkanalene som er involvert i handlingspotensialer. Ionkanalene til insekter er tilstrekkelig forskjellige fra menneskelige motstykker til at det er få bivirkninger hos mennesker.
Historie

Elektrisitetens rolle i nervesystemet til dyr ble først observert i dissekerte frosker av Luigi Galvani , som studerte den fra 1791 til 1797. Galvanis resultater stimulerte Alessandro Volta til å utvikle den voltaiske haugen- det tidligste kjente elektriske batteriet- som han studerte. dyr elektrisitet (for eksempel elektrisk ål ) og de fysiologiske responser til anvendt direkte strømspenninger .
Forskere fra 1800 -tallet studerte forplantningen av elektriske signaler i hele nerver (dvs. bunter med nevroner ) og demonstrerte at nervevev består av celler , i stedet for et sammenkoblet nettverk av rør (et retikulum ). Carlo Matteucci fulgte opp Galvanis studier og demonstrerte at cellemembraner hadde en spenning over dem og kunne produsere likestrøm . Matteuccis arbeid inspirerte den tyske fysiologen Emil du Bois-Reymond , som oppdaget handlingspotensialet i 1843. Handlingspotensialers ledningshastighet ble først målt i 1850 av du Bois-Reymonds venn, Hermann von Helmholtz . For å fastslå at nervevev består av diskrete celler, brukte den spanske legen Santiago Ramón y Cajal og hans studenter en flekk utviklet av Camillo Golgi for å avsløre de utallige former av nevroner, som de gjengjorde omhyggelig. For sine funn ble Golgi og Ramón y Cajal tildelt Nobelprisen i fysiologi 1906 . Arbeidet deres løste en mangeårig kontrovers i nevroanatomien på 1800-tallet; Golgi hadde selv argumentert for nettverksmodellen for nervesystemet.

1900 -tallet var en betydelig epoke for elektrofysiologi. I 1902 og igjen i 1912 fremmet Julius Bernstein hypotesen om at handlingspotensialet skyldes en endring i permeabiliteten til den aksonale membranen til ioner. Bernsteins hypotese ble bekreftet av Ken Cole og Howard Curtis, som viste at membrankonduktansen øker under et handlingspotensial. I 1907 foreslo Louis Lapicque at handlingspotensialet ble generert etter hvert som en terskel ble krysset, det som senere skulle bli vist som et produkt av de dynamiske systemene for ioniske konduktanser. I 1949 foredlet Alan Hodgkin og Bernard Katz Bernsteins hypotese ved å vurdere at den aksonale membranen kan ha forskjellige permeabiliteter for forskjellige ioner; spesielt demonstrerte de den avgjørende rollen for natriumpermeabilitet for handlingspotensialet. De gjorde den første faktiske registrering av de elektriske endringene på tvers av nevronmembranen som formidler handlingspotensialet. Denne forskningslinjen kulminerte i de fem papirene fra 1952 av Hodgkin, Katz og Andrew Huxley , der de brukte spenningsklemmeteknikken for å bestemme avhengigheten av den axonale membrans permeabilitet for natrium- og kaliumioner av spenning og tid, hvorfra de var i stand til å rekonstruere handlingspotensialet kvantitativt. Hodgkin og Huxley korrelerte egenskapene til deres matematiske modell med diskrete ionekanaler som kunne eksistere i flere forskjellige tilstander, inkludert "åpen", "lukket" og "inaktivert". Hypotesene deres ble bekreftet på midten av 1970- og 1980-tallet av Erwin Neher og Bert Sakmann , som utviklet teknikken for patch-clamping for å undersøke konduktansetilstandene til individuelle ionekanaler. I det 21. århundre begynner forskere å forstå det strukturelle grunnlaget for disse konduktansetilstandene og for selektiviteten til kanaler for deres ionetyper, gjennom atomoppløselige krystallstrukturer , fluorescensavstandsmålinger og kryo-elektronmikroskopistudier .
Julius Bernstein var også den første som introduserte Nernst -ligningen for å hvile potensial over membranen; dette ble generalisert av David E. Goldman til den eponymiske Goldman-ligningen i 1943. Natrium-kaliumpumpen ble identifisert i 1957 og dens egenskaper ble gradvis belyst, og kulminerte med bestemmelsen av atomoppløsningsstrukturen ved røntgenkrystallografi . Krystallstrukturene til beslektede ioniske pumper er også løst, noe som gir et bredere syn på hvordan disse molekylære maskinene fungerer.
Kvantitative modeller

Matematiske og beregningsmodeller er avgjørende for å forstå handlingspotensialet, og tilbyr spådommer som kan testes mot eksperimentelle data, og gir en streng test av en teori. Den viktigste og mest nøyaktige av de tidlige nevrale modellene er Hodgkin - Huxley -modellen , som beskriver handlingspotensialet ved et koblet sett med fire vanlige differensialligninger (ODEer). Selv om Hodgkin-Huxley-modellen kan være en forenkling med få begrensninger sammenlignet med den realistiske nervemembranen slik den eksisterer i naturen, har dens kompleksitet inspirert flere enda mer forenklede modeller, for eksempel Morris-Lecar-modellen og FitzHugh-Nagumo-modellen , som begge bare har to koblede ODEer. Egenskapene til modellene Hodgkin-Huxley og FitzHugh-Nagumo og deres slektninger, for eksempel Bonhoeffer-Van der Pol-modellen, har blitt godt studert innen matematikk, beregning og elektronikk. Imidlertid klarer de enkle modellene av generatorpotensial og handlingspotensial ikke å gjengi nøyaktig terskelnivået for nevrale pigger og piggform , spesielt for mekanoreceptorene som Pacinian corpuscle . Mer moderne forskning har fokusert på større og mer integrerte systemer; ved å slå sammen potensielle modeller med modeller av andre deler av nervesystemet (for eksempel dendritter og synapser), kan forskere studere nevralberegning og enkle reflekser , for eksempel fluktreflekser og andre kontrollert av sentrale mønstergeneratorer .
Se også
Merknader
- ^ Generelt, selv om denne enkle beskrivelsen av handlingspotensialinitiering er nøyaktig, forklarer den ikke fenomener som eksitasjonsblokk (evnen til å forhindre nevroner i å fremkalle handlingspotensialer ved å stimulere dem med store nåværende trinn) og evnen til å fremkalle handlingspotensialer ved å hyperpolariserer membranen kort. Ved å analysere dynamikken i et system av natrium- og kaliumkanaler i en membranplaster ved hjelp av beregningsmodeller , forklares imidlertid disse fenomenene lett.
- ^ Legg merke til at disse Purkinje -fibrene er muskelfibre og ikke er relatert til Purkinje -cellene , som er nevroner som finnes i lillehjernen .
Referanser
Fotnoter
Tidsskriftartikler
Bøker
- Anderson JA, Rosenfeld E, red. (1988). Neurocomputing: Forskningsgrunnlag . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-01097-9. LCCN 87003022 . OCLC 15860311 .
- Bernstein J (1912). Elektrobiologie, die Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage dargestellt [ Elektrisk biologi, studiet av de elektriske prosessene i organismen representert på moderne basis ]. Braunschweig: Vieweg und Sohn. LCCN 12027986 . OCLC 11358569 .
- Bower JM, Beeman D (1995). The Book of GENESIS: Utforske realistiske nevrale modeller med GEneral NEural SImulation System . Santa Clara, California: TELOS. ISBN 978-0-387-94019-9. LCCN 94017624 . OCLC 30518469 .
- Brazier MA (1961). En historie om hjernens elektriske aktivitet . London: Pitman. LCCN 62001407 . OCLC 556863 .
- Bullock TH , Horridge GA (1965). Struktur og funksjon i nervesystemet hos virvelløse dyr . En serie bøker i biologi. San Francisco: WH Freeman. LCCN 65007965 . OCLC 558128 .
- Bullock TH , Orkand R, Grinnell A (1977). Introduksjon til nervesystemet . En serie bøker i biologi. San Francisco: WH Freeman. ISBN 978-0-7167-0030-2. LCCN 76003735 . OCLC 2048177 .
- Felt J, red. (1959). Handbook of Physiology: a Critical, Comprehensive Presentation of Physiological Knowledge and Concepts: Del 1: Neurofysiologi . 1 . Washington, DC: American Physiological Society. LCCN 60004587 . OCLC 830755894 .
- Ganong, WF (1991). Gjennomgang av medisinsk fysiologi . Ganong's Review of Medical Physiology (15. utg.). Norwalk, Conn .: Appleton og Lange. ISBN 978-0-8385-8418-7. ISSN 0892-1253 . LCCN 87642343 . OCLC 23761261 .
- Guckenheimer J, Holmes P, red. (1986). Ikke -lineære oscillasjoner, dynamiske systemer og bifurkasjoner av vektorfelt . Anvendt matematisk vitenskap. 42 (2. utg.). New York: Springer Verlag. ISBN 978-0-387-90819-9. OCLC 751129941 .
- Hoppensteadt FC (1986). En introduksjon til matematikk av nevroner . Cambridge -studier i matematisk biologi. 6 . Cambridge: Cambridge University Press. ISBN 978-0-521-31574-6. LCCN 85011013 . OCLC 12052275 .
- Junge D (1981). Nerve- og muskeleksitasjon (2. utg.). Sunderland, Mass .: Sinauer Associates. ISBN 978-0-87893-410-2. LCCN 80018158 . OCLC 6486925 .
- Kettenmann H, Grantyn R, red. (1992). Praktiske elektrofysiologiske metoder: En veiledning for in vitro -studier i virveldyrsneurobiologi . New York: Wiley. ISBN 978-0-471-56200-9. LCCN 92000179 . OCLC 25204689 .
- Keynes RD , Aidley DJ (1991). Nerve and Muscle (2. utg.). Cambridge: Cambridge University Press. ISBN 978-0-521-41042-7. LCCN 90015167 . OCLC 25204483 .
- Koch C , Segev I, red. (1989). Metoder i nevronal modellering: Fra synapser til nettverk . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-11133-1. LCCN 88008279 . OCLC 18384545 .
- Lavallée M, Schanne OF, Hébert NC, red. (1969). Glasselektroder . New York: Wiley. ISBN 978-0-471-51885-3. LCCN 68009252 . OCLC 686 .
- McCulloch WS (1988). Legemliggjørelser av sinnet . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-63114-3. LCCN 88002987 . OCLC 237280 .
- McHenry LC, Garrison FH (1969). Garrisons historie om nevrologi . Springfield, Ill .: Charles C. Thomas. OCLC 429733931 .
- Silverthorn DU (2010). Human Physiology: An Integrated Approach (5. utg.). San Francisco: Pearson. ISBN 978-0-321-55980-7. LCCN 2008050369 . OCLC 268788623 .
- Spanswick RM, Lucas WJ, Dainty J, red. (1980). Plantemembrantransport: Gjeldende konseptuelle problemer . Utvikling innen plantebiologi. 4 . Amsterdam: Elsevier Biomedical Press. ISBN 978-0-444-80192-0. LCCN 79025719 . OCLC 5799924 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, Williams SM (2001). "Frigjøring av sendere fra synaptiske vesikler" . Nevrovitenskap (2. utg.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-742-4. LCCN 00059496 . OCLC 806472664 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, White LE (2008). Nevrovitenskap (4. utg.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-697-7. LCCN 2007024950 . OCLC 144771764 .
- Reeke GN, Poznanski RR, Sporns O, Rosenberg JR, Lindsay KA, red. (2005). Modellering i nevrovitenskapene: fra biologiske systemer til nevromimetisk robotikk . Boca Raton, Fla .: Taylor & Francis. ISBN 978-0-415-32868-5. LCCN 2005298022 . OCLC 489024131 .
- Schmidt-Nielsen K (1997). Animal Physiology: Adaptation and Environment (5. utg.). Cambridge: Cambridge University Press. ISBN 978-0-521-57098-5. LCCN 96039295 . OCLC 35744403 .
- Schwann HP, red. (1969). Biologisk ingeniørfag . Inter-University Electronics Series. 9 . New York: McGraw-Hill. ISBN 978-0-07-055734-5. LCCN 68027513 . OCLC 51993 .
- Stevens CF (1966). Nevrofysiologi: En primer . New York: John Wiley og sønner. ISBN 9780471824367. LCCN 66015872 . OCLC 1175605 .
- Waxman SG, red. (2007). Molekylær nevrologi . Burlington, Mass .: Elsevier Academic Press. ISBN 978-0-12-369509-3. LCCN 2008357317 . OCLC 154760295 .
- Worden FG, Swazey JP, Adelman G, red. (1975). Neurosciences, Paths of Discovery . Cambridge, Massachusetts: MIT Press. ISBN 978-0-262-23072-8. LCCN 75016379 . OCLC 1500233 .
nettsider
Videre lesning
- Aidley DJ, Stanfield PR (1996). Ionkanaler: Molecules in Action . Cambridge: Cambridge University Press. ISBN 978-0-521-49882-1.
- Bear MF, Connors BW, Paradiso MA (2001). Nevrovitenskap: Utforske hjernen . Baltimore: Lippincott. ISBN 0-7817-3944-6.
- Clay JR (mai 2005). "Axonal eksitabilitet revidert" . Fremskritt innen biofysikk og molekylærbiologi . 88 (1): 59–90. doi : 10.1016/j.pbiomolbio.2003.12.004 . PMID 15561301 .
- Deutsch S, Micheli-Tzanakou E (1987). Nevroelektriske systemer . New York: New York University Press. ISBN 0-8147-1782-9.
- Hille B (2001). Ion Channels of Excitable Membranes (3. utg.). Sunderland, MA: Sinauer Associates. ISBN 978-0-87893-321-1.
- Johnston D, Wu SM (1995). Grunnlaget for cellulær nevrofysiologi . Cambridge, Massachusetts: Bradford Book, The MIT Press. ISBN 0-262-10053-3.
- Kandel ER , Schwartz JH, Jessell TM (2000). Prinsipper for nevralvitenskap (4. utg.). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Miller C (1987). "Hvordan ionkanalproteiner fungerer". I Kaczmarek LK, Levitan IB (red.). Neuromodulering: Den biokjemiske kontrollen av neuronal eksitabilitet . New York: Oxford University Press. s. 39–63. ISBN 978-0-19-504097-5.
- Nelson DL, Cox MM (2008). Lehninger Principles of Biochemistry (5. utg.). New York: WH Freeman. ISBN 978-0-7167-7108-1.
Eksterne linker
- Ionisk flyt i aksjonspotensialer hos Blackwell Publishing
- Handlingspotensial forplantning i myeliniserte og umelininerte aksoner ved Blackwell Publishing
- Generering av AP i hjerteceller og generering av AP i nevronceller
- Hvilemembranpotensial fra Life: The Science of Biology , av WK Purves, D Sadava, GH Orians og HC Heller, 8. utgave, New York: WH Freeman, ISBN 978-0-7167-7671-0 .
- Jonisk bevegelse og Goldman -spenningen for vilkårlige ioniske konsentrasjoner ved University of Arizona
- En tegneserie som illustrerer handlingspotensialet
- Handlingspotensial forplantning
- Produksjon av handlingspotensialet: simuleringer av spenning og strømspenning
- Programvare med åpen kildekode for å simulere potensialer for nevron og hjerte på SourceForge.net
- Introduksjon til handlingspotensialet , Neuroscience Online (elektronisk nevrovitenskapelig lærebok av UT Houston Medical School)
- Khan Academy: Elektrotonisk og handlingspotensial






