Afrikansk trypanosomiasis - African trypanosomiasis
| Afrikansk trypanosomiasis | |
|---|---|
| Andre navn | Sovesyke, afrikansk sovesyke |
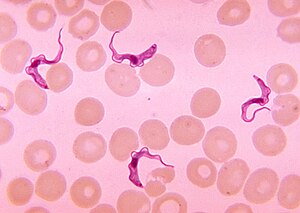 | |
| Trypanosoma dannes i blodutstryk | |
| Spesialitet | Infeksjonssykdom |
| Symptomer |
Fase 1 : Feber, hodepine, kløe, leddsmerter Fase 2 : Søvnproblemer , forvirring , dårlig koordinasjon |
| Vanlig start | 1-3 uker etter eksponering |
| Typer | Trypanosoma brucei gambiense (TbG), Trypanosoma brucei rhodesiense (TbR) |
| Årsaker | Trypanosoma brucei spredt av tsetsefluer |
| Diagnostisk metode | Blodutstryk , lumbal punktering |
| Medisinering | Fexinidazol , pentamidin , suramin , eflornithine , nifurtimox |
| Prognose | Dødelig uten behandling |
| Frekvens | 977 (2018) |
| Dødsfall | 3500 (2015) |
Afrikansk trypanosomiasis , også kjent som afrikansk sovesyke eller bare sovesyke , er en insektbåren parasittisk infeksjon av mennesker og andre dyr. Det er forårsaket av arten Trypanosoma brucei . Mennesker er infisert av to typer, Trypanosoma brucei gambiense (TbG) og Trypanosoma brucei rhodesiense (TbR). TbG forårsaker over 98% av rapporterte tilfeller. Begge blir vanligvis overført ved bitt av en infisert tsetseflue og er mest vanlig i landlige områder.
I utgangspunktet er den første fasen av sykdommen preget av feber, hodepine, kløe og leddsmerter, som begynner en til tre uker etter bitt. Uker til måneder senere begynner den andre fasen med forvirring, dårlig koordinasjon, nummenhet og søvnproblemer. Diagnose er ved å finne parasitten i et blodutstryk eller i væsken i en lymfeknute. En lumbal punktering er ofte nødvendig for å fortelle forskjellen mellom første og andre stadie sykdom.
Forebygging av alvorlig sykdom innebærer screening av risikopopulasjonen med TbG -blodprøver. Behandlingen er lettere når sykdommen oppdages tidlig og før nevrologiske symptomer oppstår. Behandlingen av det første stadiet har vært med medisinene pentamidin eller suramin . Behandling av den andre fasen har involvert eflornithine eller en kombinasjon av nifurtimox og eflornithine for TbG. Fexinidazol er en nyere behandling som kan tas gjennom munnen, for begge stadier av TbG. Mens melarsoprol fungerer for begge typer, brukes det vanligvis bare for TbR, på grunn av alvorlige bivirkninger. Uten behandling fører søvnsyke vanligvis til døden.
Sykdommen forekommer regelmessig i noen regioner i Afrika sør for Sahara, og befolkningen er i fare for å være rundt 70 millioner i 36 land. Anslagsvis 11 000 mennesker er for tiden smittet med 2800 nye infeksjoner i 2015. I 2018 var det 977 nye tilfeller. I 2015 forårsaket det rundt 3500 dødsfall, ned fra 34 000 i 1990. Mer enn 80% av disse tilfellene er i Den demokratiske republikken Kongo . Tre store utbrudd har skjedd i nyere historie: ett fra 1896 til 1906 først og fremst i Uganda og Kongo -bassenget og to i 1920 og 1970 i flere afrikanske land. Det er klassifisert som en forsømt tropisk sykdom . Andre dyr, som kyr, kan bære sykdommen og bli smittet. I så fall er det kjent som Nagana eller animalsk trypanosomiasis .
Tegn og symptomer
Afrikansk trypanosomiasis symptomer forekommer i to stadier: det hemolymfatiske stadiet og det nevrologiske stadiet (sistnevnte er preget av parasittisk invasjon av sentralnervesystemet). Nevrologiske symptomer oppstår imidlertid i tillegg til de første trekkene, og de to stadiene kan være vanskelige å skille ut fra kliniske trekk alene.
Sykdommen har blitt rapportert å ha atypiske symptomer hos infiserte individer som stammer fra ikke-endemiske områder (f.eks. Reisende). Årsakene til dette er uklare og kan være genetiske. Det lave antallet slike tilfeller kan også ha skjevheter. Hos slike personer sies infeksjonen hovedsakelig å være feber med gastrointestinale symptomer (f.eks. Diaré og gulsott), med lympadenopati som bare utvikler seg sjelden.
Trypanosomal chancre
Systemisk sykdom foregår noen ganger av en trypanosomal chancre som utvikler seg på stedet for det smittsomme fluebitt innen 2 dager etter infeksjon. Chancre er oftest observert i T. b. rhodesiense infeksjon, og bare sjelden i T. b. gambiense (men i T. b. gambiense- infeksjon er sjanser mer vanlige hos personer fra ikke-endemiske områder).
Hemolymfatisk fase
Inkubasjonstiden er 1-3 uker for T. b. rhodesiense, og lengre (men mindre presist karakterisert) i T. b. gambiense infeksjon. Den første/første fasen, kjent som den hemolymfatiske fasen, er preget av uspesifikke, generaliserte symptomer som: feber (periodisk) , hodepine (alvorlig), leddsmerter , kløe , svakhet, ubehag, tretthet, vekttap, lymfadenopati og hepatosplenomegali.
Diagnosen kan bli forsinket på grunn av uklarheten i de første symptomene. Sykdommen kan også forveksles med malaria (som faktisk kan oppstå som en co-infeksjon).
Intermitterende feber
Feber er periodisk, med angrep som varer fra en dag til en uke, atskilt med intervaller på noen få dager til en måned eller lenger. Episoder med feber blir sjeldnere i løpet av sykdommen.
Lymfadenopati
Invasjon av sirkulasjons- og lymfesystemet av parasitten er forbundet med alvorlig hevelse i lymfeknuter , ofte til enorme størrelser. Posterior cervikale lymfeknuter blir oftest påvirket, men axillær, inguinal og epitroklær lymfeknute kan også forekomme. Winterbottoms tegn , fortellede hovne lymfeknuter langs nakken, kan vises. Winterbottoms tegn er vanlig hos T. b. gambiense infeksjon.
Andre funksjoner
De berørte kan i tillegg presentere hudutslett, hemolytisk anemi, hepatomegali og unormal leverfunksjon, splenomegali, endokrine forstyrrelser, hjerteinvolvering (f.eks. Perikarditt og kongestiv hjertesvikt) og oftalmisk involvering.
Mange blødningsflekker i beinets hud hos en person smittet med T. b. rhodesiense
Nevrologisk fase
Den andre fasen av sykdommen, den nevrologiske fasen (også kalt meningoencefalisk stadium ), begynner når parasitten invaderer sentralnervesystemet ved å passere gjennom blod -hjernebarrieren . Progresjon til den nevrologiske fasen skjer etter anslagsvis 21–60 dager i tilfelle T. b. rhodesiens e infeksjon, og 300–500 dager ved T. b. gambiense infeksjon.
I virkeligheten overlapper de to fasene og er vanskelige å skille ut fra kliniske trekk alene; å bestemme det faktiske stadiet av sykdommen oppnås ved å undersøke cerebrospinalvæsken for tilstedeværelse av parasitten.
Søvnforstyrrelser
Søvn-våkne forstyrrelser er et ledende trekk ved nevrologisk stadium og ga sykdommen sitt vanlige navn afrikansk sovesyke . Infiserte personer opplever en uorganisert og fragmentert søvn-våkne syklus. De berørte opplever søvninversjon som resulterer i søvn og søvnighet på dagtid og perioder med våkenhet og søvnløshet om natten. I tillegg opplever de berørte også episoder med plutselig søvnighet.
Nevrologiske/nevrokognitive symptomer
Nevrologiske symptomer inkluderer: tremor , generell muskelsvakhet, hemiparese , lammelse av et lem, unormal muskeltonus, gangforstyrrelse, ataksi, taleforstyrrelser, parestesi, hyperestesi, anestesi, synsforstyrrelse, unormale reflekser, anfall og koma. Parkinsonlignende bevegelser kan oppstå på grunn av uspesifikke bevegelsesforstyrrelser og taleforstyrrelser.
Psykiatriske/atferdsmessige symptomer
Enkeltpersoner kan oppvise psykiatriske symptomer som noen ganger kan dominere den kliniske diagnosen og kan omfatte aggressivitet, apati , irritabilitet, psykotiske reaksjoner og hallusinasjoner , angst , emosjonell labilitet , forvirring , mani , oppmerksomhetsunderskudd og delirium .
Avansert/sen sykdom og utfall
Uten behandling er sykdommen alltid dødelig, med progressiv mental forverring som fører til koma, systemisk organsvikt og død. En ubehandlet infeksjon med T. b. rhodesiense vil forårsake død innen måneder mens en ubehandlet infeksjon med T. b. gambiense vil forårsake død etter flere år. Skade forårsaket i den nevrologiske fasen er irreversibel.
Årsaken
Trypanosoma brucei gambiense står for de fleste afrikanske tilfeller av trypanosomiasis, med mennesker som det viktigste reservoaret som trengs for overføringen, mens Trypanosoma brucei rhodesiense hovedsakelig er zoonotisk, med sporadisk infeksjon hos mennesker. Afrikansk trypanosomiasis er avhengig av samspillet mellom parasitten (trypanosome) og tsetsefluene (vektor), så vel som verten (menneske for Trypanosoma brucei gambiense og dyr for Trypanosoma brucei rhodesiense ). Risikoen for å pådra seg afrikansk trypanosomiasis er avhengig av å komme i kontakt med en infisert tsetseflue.
Trypanosoma brucei
Det er to underarter av parasitten som er ansvarlige for å starte sykdommen hos mennesker. Trypanosoma brucei gambiense forårsaker sykdommene i Vest- og Sentral -Afrika , mens Trypanosoma brucei rhodesiense har et begrenset geografisk område og er ansvarlig for å forårsake sykdommen i Øst- og Sør -Afrika. I tillegg er en tredje underart av parasitten kjent som Trypanosoma brucei brucei ansvarlig for å påvirke dyr, men ikke mennesker.
Mennesker er hovedreservoaret for T. b. gambiense, men denne arten kan også finnes hos griser og andre dyr. Villdyr og storfe er hovedreservoaret til T. b. rhodesiense . Disse parasittene infiserer først og fremst individer i Afrika sør for Sahara fordi det er der vektoren (tsetse fly) befinner seg. De to menneskelige sykdomsformene varierer også sterkt i intensitet. T. b. gambiense forårsaker en kronisk tilstand som kan forbli i en passiv fase i måneder eller år før symptomene dukker opp og infeksjonen kan vare omtrent tre år før døden inntreffer.
T. b. rhodesiense er sykdommens akutte form, og døden kan oppstå i løpet av måneder siden symptomene dukker opp i løpet av uker, og den er mer virulent og raskere å utvikle enn T. b. gambiense . Videre er trypanosomer omgitt av et strøk som består av forskjellige overflateglykoproteiner (VSG). Disse proteinene virker for å beskytte parasitten mot alle lytiske faktorer som er tilstede i menneskelig plasma. Vertens immunsystem gjenkjenner glykoproteinene som er tilstede på parasittens pels og fører til produksjon av forskjellige antistoffer (IgM og IgG).
Disse antistoffene vil da virke for å ødelegge parasittene som sirkulerer rundt blodet. Imidlertid, fra de flere parasittene som finnes i plasmaet, vil et lite antall av dem oppleve endringer i overflatestrøkene som resulterer i dannelse av nye VSG -er. Dermed vil antistoffene som produseres av immunsystemet ikke lenger gjenkjenne parasitten som fører til spredning før nye antistoffer blir opprettet for å bekjempe de nye VSG -ene. Etter hvert vil immunsystemet ikke lenger være i stand til å bekjempe parasitten på grunn av de konstante endringene i VSG og infeksjon vil oppstå.
Vector
| Type | Trypanosoma | Fordeling | V ektor |
|---|---|---|---|
| Kronisk | T. brucei gambiense | Vest -Afrika |
G. palpalis
G. tachinoides G. morsitans |
| Akutt | T. brucei rhodesiense | Øst -Afrika |
G. morsitans
G. swynnertoni G. pallidipes G. fuscipes |
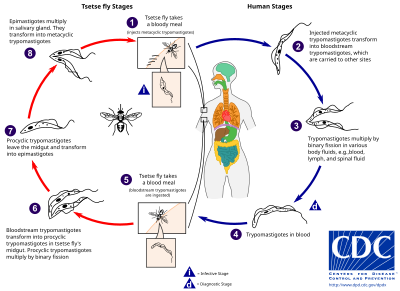
Den Tsetsefluer (slekten Glossina ) er en stor, brun, biting flue som tjener som både en vert og vektor for trypanosom parasitter. Mens den tar blod fra en pattedyrvert, injiserer en infisert tsetseflue metacykliske trypomastigoter i hudvevet. Fra bittet kommer parasitter først inn i lymfesystemet og passerer deretter inn i blodet. Inne i pattedyrsverten transformeres de til trypomastigoter i blodet, og blir ført til andre steder i kroppen, når andre kroppsvæsker (f.eks. Lymfe, spinalvæske) og fortsetter å replikere ved binær fisjon .
Hele livssyklusen til afrikanske trypanosomer er representert av ekstracellulære stadier. En tsetseflue blir infisert med trystomastigoter i blodet når man tar et blodmåltid på en infisert pattedyrvert. I fluens midttarm forvandler parasittene seg til procykliske trypomastigoter, multipliserer med binær fisjon, forlater midttarmen og omdannes til epimastigoter. Epimastigotene når fluens spyttkjertler og fortsetter multiplikasjon med binær fisjon.
Hele livssyklusen til flua tar omtrent tre uker. I tillegg til bitt av tsetsefluen , kan sykdommen overføres av:
- Mor-til-barn-infeksjon: Trypanosomet kan noen ganger krysse morkaken og infisere fosteret.
- Laboratorier: tilfeldige infeksjoner, for eksempel gjennom håndtering av blod fra en infisert person og organtransplantasjon, selv om dette er uvanlig.
- Blodoverføring
- Seksuell kontakt (dette kan være mulig)
Hestefluer ( Tabanidae ) og stallfluer ( møkkfluer ) muligens spiller en rolle ved overføring av nagana (dyrets form av sovesyke) og den humane sykdommen form.
Patofysiologi
Tryptophol er en kjemisk forbindelse produsert av den trypanosomale parasitten ved sovesyke som induserer søvn hos mennesker.
Diagnose

Gullstandarden for diagnose er identifisering av trypanosomer i en prøve ved mikroskopisk undersøkelse. Prøver som kan brukes til diagnose inkluderer chancre -væske , lymfeknute -aspirater, blod, benmarg og, under det nevrologiske stadiet, cerebrospinalvæske . Påvisning av trypanosomspesifikke antistoffer kan brukes til diagnose, men sensitiviteten og spesifisiteten til disse metodene er for variabel til å brukes alene for klinisk diagnose. Videre skjer serokonversjon etter begynnelsen av kliniske symptomer under en T. b. rhodesiense infeksjon, så er av begrenset diagnostisk bruk.
Trypanosomer kan påvises fra prøver ved hjelp av to forskjellige preparater. Et vått preparat kan brukes til å lete etter de bevegelige trypanosomene. Alternativt kan en fast (tørket) flekk farges ved hjelp av Giemsas eller Fields teknikk og undersøkes under et mikroskop. Ofte er parasitten relativt lav i prøven, så teknikker for å konsentrere parasittene kan brukes før mikroskopisk undersøkelse. For blodprøver inkluderer disse sentrifugering etterfulgt av undersøkelse av buffy coat ; mini anion-bytte/sentrifugering; og den kvantitative buffy coat (QBC) teknikken. For andre prøver, for eksempel spinalvæske, inkluderer konsentrasjonsteknikker sentrifugering etterfulgt av undersøkelse av sedimentet.
Tre serologiske tester er også tilgjengelige for påvisning av parasitten: micro-CATT (kortagglutinasjonstest for trypanosomiasis), wb-CATT og wb-LATEX. Den første bruker tørket blod, mens de to andre bruker fullblodsprøver. En studie fra 2002 fant wb-CATT for å være den mest effektive for diagnosen, mens wb-LATEX er en bedre eksamen for situasjoner der større følsomhet er nødvendig.
Forebygging
Foreløpig er det få medisinsk relaterte forebyggingsalternativer for afrikansk trypanosomiasis (dvs. det finnes ingen vaksine for immunitet). Selv om risikoen for infeksjon fra et tsetsefluebitt er liten (anslått til mindre enn 0,1%), er bruk av insektavstøtende midler, iført langermede klær, unngå tsetse-tette områder, implementering av buskklaringsmetoder og avlivning av vilt vilt det beste alternativer for å unngå infeksjon tilgjengelig for lokalbefolkningen i berørte områder.
I juli 2000 ble det vedtatt en resolusjon om å danne Pan African Tsetse and Trypanosomiasis Eradication Campaign (PATTEC). Kampanjen jobber med å utrydde tsetsevektorpopulasjonsnivåene og deretter protozo-sykdommen, ved bruk av insektmiddelimprægnerte mål, fluefeller, insektmiddelbehandlet storfe, ultralavdose luft-/bakkesprøyting (SAT) av tsetse-hvilesteder og det sterile insektteknikk (SIT). Bruken av SIT i Zanzibar viste seg å være effektiv for å eliminere hele bestanden av tsetsefluer, men var dyr og er relativt upraktisk å bruke i mange av de endemiske landene som er rammet av afrikansk trypanosomiasis.
Et pilotprogram i Senegal har redusert tsetsefluebestanden med hele 99% ved å introdusere hannfluer som har blitt sterilisert ved eksponering for gammastråler .
Regelmessig aktiv overvåking, som involverer påvisning og rask behandling av nye infeksjoner, og tsetse fluekontroll er ryggraden i strategien som brukes for å kontrollere sovesykdom. Systematisk screening av risikosamfunn er den beste tilnærmingen, ettersom case-by-case screening ikke er praktisk i endemiske regioner. Systematisk screening kan være i form av mobile klinikker eller faste screeningsentre hvor team daglig reiser til områder med høy infeksjon. Slik screening er viktig fordi tidlige symptomer ikke er tydelige eller alvorlige nok til å garantere mennesker med gambiense sykdom å oppsøke lege, spesielt i svært avsidesliggende områder. Diagnosen av sykdommen er også vanskelig, og helsearbeidere kan ikke knytte slike generelle symptomer til trypanosomiasis. Systematisk screening gjør at tidlig stadium kan oppdages og behandles før sykdommen utvikler seg, og fjerner det potensielle menneskelige reservoaret. Et enkelt tilfelle av seksuell overføring av vestafrikansk sovesyke er rapportert.
Behandling
Første etappe
Behandlingen av førstegangs sykdom er fexinidazol i munnen eller pentamidin ved injeksjon for T. b. gambiense . Suramin ved injeksjon brukes til T. b. rhodesiense .
Andre etappe
Fexinidazol kan brukes i den andre fasen av TbG, hvis sykdommen ikke er alvorlig. Ellers ser det ut til at et regime som involverer kombinasjonen av nifurtimox og eflornithine , nifurtimox-eflornithine kombinasjonsbehandling (NECT) eller eflornithine alene er mer effektivt og resulterer i færre bivirkninger. Disse behandlingene kan erstatte melarsoprol når tilgjengelig. NECT har fordelen av å kreve mindre injeksjoner av eflornithine.
Intravenøs melarsoprol var tidligere standardbehandling for sykdom i andre trinn (nevrologisk fase) og er effektiv for begge typer. Melarsoprol er den eneste behandlingen for andre trinn T. b. rhodesiense ; Imidlertid forårsaker det død hos 5% av menneskene som tar det. Motstand mot melarsoprol kan forekomme.
Prognose
Hvis ubehandlet, T. b. gambiense resulterer nesten alltid i død, med bare noen få individer vist i en langsiktig 15 års oppfølging å ha overlevd etter å ha nektet behandling. T. b. rhodesiense , som er en mer akutt og alvorlig form for sykdommen, er konsekvent dødelig hvis den ikke behandles. Sykdomsutviklingen varierer sterkt avhengig av sykdomsform. For personer som er smittet av T. b. gambiense , som står for 98% av alle de rapporterte tilfellene, kan en person bli smittet i flere måneder eller år uten tegn eller symptomer til det avanserte sykdomsstadiet, hvor det er for sent å bli behandlet vellykket. For personer berørt av T. b. rhodesiense , som står for 2% av alle rapporterte tilfeller, vises symptomer innen uker eller måneder etter infeksjonen. Sykdomsutviklingen er rask og invaderer sentralnervesystemet, og forårsaker død innen kort tid.
Epidemiologi

I 2010 forårsaket det rundt 9 000 dødsfall, ned fra 34 000 i 1990. Fra og med 2000 er de funksjonshemmede justerte leveårene (9 til 10 år) tapt på grunn av sovesyke 2,0 millioner. Fra 2010–2014 var det anslagsvis 55 millioner mennesker i fare for gambiense afrikansk trypanosomiasis og over 6 millioner mennesker i fare for rhodesiense afrikansk trypanosomiasis. I 2014 rapporterte Verdens helseorganisasjon 3797 tilfeller av menneskelig afrikansk trypanosomiasis da det antatte antallet tilfeller skulle være 5000. Antall rapporterte tilfeller i 2014 er en reduksjon på 86% til det totale antallet saker som ble rapportert i 2000.
Sykdommen er registrert som forekommende i 37 land, alle i Afrika sør for Sahara. Det forekommer regelmessig i sørøst Uganda og vestlige Kenya, og drepte mer enn 48 000 afrikanere i 2008. Den demokratiske republikken Kongo er det mest berørte landet i verden, og står for 75% av tilfellene Trypanosoma brucei gambiense . Befolkningen i fare er omtrent 69 millioner med en tredjedel av dette tallet på en "veldig høy" til "moderat" risiko og de resterende to tredjedeler med en "lav" til "veldig lav" risiko. Antall mennesker som blir rammet av sykdommen har gått ned. Med denne hastigheten er eliminering av sove sykdom en mulighet. Verdens helseorganisasjon planlegger å utrydde sovesyke innen 2030.
| Trypanosoma brucei gambiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Angola | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 |
| Benin | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Burkina Faso | 27 | 27 | 20 | 17 | 18 | 1. 3 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Kamerun | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 1. 3 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 |
| Den sentralafrikanske republikk | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 |
| Tsjad | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 |
| Kongo | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 |
| Elfenbenskysten | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 1. 3 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 |
| Den demokratiske republikken Kongo | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 |
| Ekvatorial-Guinea | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 1. 3 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 |
| Gabon | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 |
| Ghana | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Guinea | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 |
| Mali | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nigeria | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Sør-Sudan | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 |
| Å gå | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Uganda | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 |
| Total | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 |
| Trypanosoma brucei rhodesiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
| Kenya | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Malawi | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 |
| Mosambik | 3 | 7 | 24 | 10 | 16 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | 1 | Ingen data | 1 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data |
| Uganda | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 1. 3 | 4 | 5 |
| Den forente republikk Tanzania | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 |
| Zambia | 7 | Ingen data | 4 | 1 | 1 | 1 | 3 | Ingen data | Ingen data | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 1. 3 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 |
| Zimbabwe | Ingen data | Ingen data | Ingen data | Ingen data | 1 | Ingen data | Ingen data | 9 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | 3 | Ingen data | Ingen data | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 |
| Total | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 |
Historie

Tilstanden har vært tilstede i Afrika i tusenvis av år. På grunn av mangel på reise mellom urfolk hadde sovesyke hos mennesker vært begrenset til isolerte lommer. Dette endret seg etter at arabiske slavehandlere kom inn i Sentral -Afrika fra øst, etter Kongo -elven , og tok med seg parasitter. Gambisk sovesyke reiste oppover Kongo -elven, og deretter videre østover.
En arabisk forfatter på 1300-tallet forlot følgende beskrivelse i tilfellet med en sultan i Mali-riket: "Hans ende skulle bli innhentet av sovesyken ( illat an-nawm ) som er en sykdom som ofte rammer innbyggerne i disse land spesielt deres høvdinger. Søvnen overtar en av dem på en slik måte at det neppe er mulig å vekke ham. "
Den britiske marinekirurgen John Atkins beskrev sykdommen da han kom tilbake fra Vest -Afrika i 1734:
Sleepy Distemper (vanlig blant negrene) gir ingen annen tidligere melding, enn mangel på appetitt 2 eller 3 dager før; deres søvn er god, og Sense and Feeling veldig lite; for å trekke, druppe eller piske vil knapt røre Sense and Power nok til å bevege seg; og det øyeblikket du slutter å slå de smarte er glemt, og nedover faller de igjen i en tilstand av ufølsomhet, og driver konstant fra munnen som i dyp salivasjon; pust sakte, men ikke ulikt eller fnys. Unge mennesker er mer utsatt for det enn de gamle; og dommen som vanligvis uttales er Døden, Prognostikken svikter sjelden. Hvis en og annen av dem blir frisk, mister han absolutt den lille grunnen han hadde, og snur Ideot ...
Den franske marinekirurgen Marie-Théophile Griffon du Bellay behandlet og beskrev tilfeller mens han var stasjonert ombord på sykehusskipet Caravane i Gabon på slutten av 1860-tallet.
I 1901 brøt en ødeleggende epidemi ut i Uganda og drepte mer enn 250 000 mennesker, inkludert omtrent to tredjedeler av befolkningen i de berørte innsjøområdene. I følge The Cambridge History of Africa , "har det blitt anslått at opptil halvparten av menneskene døde av sovesyke og kopper i landene på begge bredder av den nedre elven Kongo ."
Årsaksmidlet og vektoren ble identifisert i 1903 av David Bruce , og underarten av protozoa ble differensiert i 1910. Bruce hadde tidligere vist at T. brucei var årsaken til en lignende sykdom hos hester og storfe som ble overført av tsetsefluen ( Glossina morsitans ).
Den første effektiv behandling, atoxyl , en arsen -basert medikament utviklet av Paul Ehrlich og Kiyoshi Shiga , ble innført i 1910, men blindhet var en alvorlig bivirkning.
Suramin ble først syntetisert av Oskar Dressel og Richard Kothe i 1916 for Bayer . Det ble introdusert i 1920 for å behandle den første fasen av sykdommen. I 1922 ble Suramin generelt kombinert med tryparsamid (et annet pentavalent organoarsenisk legemiddel), det første stoffet som kom inn i nervesystemet og var nyttig i behandlingen av den andre fasen av gambiense -formen. Tryparsamide ble kunngjort i Journal of Experimental Medicine i 1919 og testet i Belgisk Kongo av Louise Pearce fra Rockefeller Institute i 1920. Den ble brukt under den store epidemien i Vest- og Sentral -Afrika på millioner av mennesker og var bærebjelken i terapien til 1960 -tallet. Den amerikanske medisinske misjonæren Arthur Lewis Piper var aktiv med å bruke tryparsamid til å behandle sovesyke i Belgia i 1925.
Pentamidin , et svært effektivt legemiddel for den første fasen av sykdommen, har blitt brukt siden 1937. I løpet av 1950 -årene ble det mye brukt som et profylaktisk middel i Vest -Afrika, noe som førte til en kraftig nedgang i infeksjonsrater. På den tiden antas utryddelse av sykdommen å være for hånden.
Den organoarseniske melarsoprol (Arsobal) som ble utviklet på 1940-tallet, er effektiv for personer med andre-trinns sovesykdom. Imidlertid har 3–10% av de som injiseres reaktiv encefalopati (kramper, progressiv koma eller psykotiske reaksjoner), og 10–70% av slike tilfeller resulterer i dødsfall; det kan forårsake hjerneskade hos de som overlever encefalopatien. På grunn av effektiviteten brukes melarsoprol fremdeles i dag. Motstanden mot melarsoprol øker, og kombinasjonsbehandling med nifurtimox er for tiden under forskning.
Eflornithine (difluoromethylornithine eller DFMO), den mest moderne behandlingen, ble utviklet på 1970 -tallet av Albert Sjoerdsma og gjennomgikk kliniske studier på 1980 -tallet. Legemidlet ble godkjent av United States Food and Drug Administration i 1990. Aventis , selskapet som var ansvarlig for produksjonen, stoppet produksjonen i 1999. I 2001 signerte Aventis, i samarbeid med Leger Uten Grenser og Verdens helseorganisasjon , en lang- tidsavtale for å produsere og donere stoffet.
I tillegg til sovende sykdom har tidligere navn inkludert negro sløvhet, maladie du sommeil (Fr), Schlafkrankheit (Ger), afrikansk sløvhet og kongo trypanosomiasis.
- Den britisk ledede Sleeping Sickness Commission som samler tsetsefluer, Uganda og Nyasaland , 1908-1913
Forskning
Genomet til parasitten er sekvensert, og flere proteiner er identifisert som potensielle mål for behandling av medisiner. Analyse av genomet avslørte også årsaken til at det har vært så vanskelig å generere en vaksine for denne sykdommen. T. brucei har over 800 gener som gjør proteiner til parasitten "blander og matcher" for å unngå immunsystemdeteksjon.
Å bruke en genmodifisert form av en bakterie som forekommer naturlig i tarmene til vektorer, blir studert som en metode for å kontrollere sykdommen.
Nylige funn indikerer at parasitten ikke klarer å overleve i blodet uten flagellum . Denne innsikten gir forskerne en ny vinkel å angripe parasitten med.
Trypanosomiasis -vaksiner gjennomgår forskning.
I tillegg har Drugs for Neglected Disease Initiative bidratt til forskning i afrikansk sovesykdom ved å utvikle en forbindelse som kalles fexinidazol . Dette prosjektet ble opprinnelig startet i april 2007 og registrerte 749 mennesker i DRC og Den sentralafrikanske republikk . Resultatene viste effekt og sikkerhet i begge stadier av sykdommen, både hos voksne og barn ≥ 6 år og som veide ≥ 20 kg. Det europeiske legemiddelkontoret har godkjent den for første og andre stadium sykdommen utenfor Europa i november 2018. Behandlingen ble godkjent i Kongo i desember 2018.
Finansiering
For nåværende finansieringsstatistikk er menneskelig afrikansk trypanosomiasis gruppert med kinetoplastidinfeksjoner. Kinetoplastider refererer til en gruppe flagellate protozoer. Kinetoplastid -infeksjoner inkluderer afrikansk sovesyke, Chagas 'sykdom og Leishmaniasis. Til sammen utgjorde disse tre sykdommene 4,4 millioner funksjonshemmede justerte leveår (DALYs) og ytterligere 70.075 registrerte dødsfall årlig. For kinetoplastidinfeksjoner var den totale globale forsknings- og utviklingsfinansieringen på omtrent $ 136,3 millioner i 2012. Hver av de tre sykdommene, afrikansk sovesyke, Chagas 'sykdom og Leishmaniasis mottok hver en tredjedel av finansieringen, som var omtrent $ 36,8 millioner dollar , Henholdsvis 38,7 millioner dollar og 31,7 millioner dollar.
For sovende sykdom ble finansiering delt inn i grunnforskning, oppdagelse av legemidler, vaksiner og diagnostikk. Det største beløpet ble rettet mot grunnforskning av sykdommen; omtrent $ 21,6 millioner amerikanske dollar ble rettet mot denne innsatsen. Når det gjelder terapeutisk utvikling, ble det investert omtrent 10,9 millioner dollar.
Den største finansiereren for forskning og utvikling av kinetoplastidinfeksjon er offentlige kilder. Omtrent 62% av finansieringen kommer fra høyinntektsland, mens 9% kommer fra lav- og mellominntektsland. Høyinntektslandenes offentlige midler er den største bidragsyteren til den forsømte sykdomsforskningsinnsatsen. Imidlertid har finansiering fra høyinntektsland de siste årene vært jevnt redusert; i 2007 ga høyinntektsland 67,5% av den totale finansieringen, mens offentlige inntekter i 2012 bare ga 60% av den totale finansieringen for kinetoplastidinfeksjoner. Denne nedadgående trenden etterlater et gap for andre finansiere, for eksempel filantropiske stiftelser og private farmasøytiske selskaper å fylle.
Mye av fremgangen som har blitt gjort innen afrikansk sovesyke og forsømt forskning som helhet, er et resultat av de andre ikke-offentlige finansiererne. En av disse store finansieringskildene har kommet fra stiftelser, som i økende grad har blitt mer engasjert i å ignorere sykdomsmedisinoppdagelse i det 21. århundre. I 2012 ga filantropiske kilder 15,9% av den totale finansieringen. Bill and Melinda Gates Foundation har vært ledende innen finansiering av forsømt utvikling av medisiner mot sykdom. De har gitt $ 444,1 millioner amerikanske dollar til forsømt forskning om forskning i 2012. Til dags dato har de donert over $ 1,02 milliarder dollar til forsømte forsøk på å oppdage sykdom.
Spesielt for kinetoplastidinfeksjoner har de donert gjennomsnittlig $ 28,15 millioner amerikanske dollar årlig mellom årene 2007 til 2011. De har merket menneskelig afrikansk trypanosomiasis som et mål med høy mulighet, noe som betyr at det er en sykdom som gir størst mulighet for kontroll, eliminering og utryddelse, gjennom utvikling av nye medisiner, vaksiner, folkehelseprogrammer og diagnostikk. De er den nest høyeste finansieringskilden for forsømte sykdommer, rett bak US National Institutes of Health. I en tid der offentlige midler går ned og statlige tilskudd til vitenskapelig forskning er vanskeligere å skaffe, har den filantropiske verden gått inn for å presse forskningen fremover.
En annen viktig komponent i økt interesse og finansiering har kommet fra industrien. I 2012 bidro de med 13,1% totalt til kinetoplastids forsknings- og utviklingsarbeid, og har i tillegg spilt en viktig rolle ved å bidra til offentlig-private partnerskap (OPP) samt produktutviklingspartnerskap (PDP). Et offentlig-privat partnerskap er en ordning mellom en eller flere offentlige enheter og en eller flere private enheter som eksisterer for å oppnå et spesifikt helseutfall eller for å produsere et helseprodukt. Partnerskapet kan eksistere på mange måter; de kan dele og utveksle midler, eiendom, utstyr, menneskelige ressurser og intellektuell eiendom. Disse offentlig-private partnerskapene og produktutviklingspartnerskapene er etablert for å løse utfordringer i farmasøytisk industri, spesielt knyttet til forsømt sykdomsforskning. Disse partnerskapene kan bidra til å øke omfanget av innsatsen mot terapeutisk utvikling ved å bruke forskjellig kunnskap, ferdigheter og ekspertise fra forskjellige kilder. Disse typer partnerskap har vist seg å være mer effektive enn industri eller offentlige grupper som arbeider uavhengig.
Andre dyr og reservoar
Trypanosoma av både rhodesiense og gambiense typer kan påvirke andre dyr som storfe og ville dyr. Afrikansk trypanosomiasis har generelt blitt ansett som en antroponotisk sykdom, og derfor var kontrollprogrammet hovedsakelig fokusert på å stoppe overføringen ved å behandle menneskelige tilfeller og eliminere vektoren. Imidlertid ble det rapportert at dyrreservoarer muligens spilte en viktig rolle i den endemiske naturen til afrikansk trypanosomiasis, og for at den gjenoppstod i de historiske fokusene i Vest- og Sentral -Afrika.
Referanser
Eksterne linker
| Scholia har en emneprofil for afrikansk trypanosomiasis . |
- "En doktors drøm" . stories.dndi.org . Hentet 14. mai 2020 .
- "Sovesyke" . Leger uten grenser . Arkivert fra originalen 23. oktober 2013.
- Lenker til bilder av Sleeping Sickness (Hardin MD/ University of Iowa )
- Hale Carpenter G (1920). En naturforsker ved Victoriasjøen, med en beretning om sovende sykdom og Tse-tse Flu . Unwin. OCLC 2649363 .
| Klassifisering | |
|---|---|
| Eksterne ressurser |