Balmer -serien - Balmer series

De Balmer serien , eller Balmer linjer i atomfysikk , er en av et sett av seks navngitte serie beskriver spektrallinjeformer utslipp av den hydrogenatom . Balmer -serien beregnes ved hjelp av Balmer -formelen, en empirisk ligning oppdaget av Johann Balmer i 1885.
Det synlige spektrum av lys fra hydrogen viser fire bølgelengder , 410 nm , 434 nm, 486 nm, og 656 nm, som tilsvarer utslipp av fotoner av elektroner i eksiterte tilstander overgangen til kvante-nivå beskrevet av hovedkvantetallet n er lik 2. Det er flere fremtredende ultrafiolette balmerlinjer med bølgelengder kortere enn 400 nm. Antallet av disse linjene er et uendelig kontinuum når det nærmer seg en grense på 364,5 nm i ultrafiolett.
Etter Balmers oppdagelse ble fem andre hydrogenspektralserier oppdaget, tilsvarende elektroner som gikk over til verdier på n andre enn to.
Oversikt
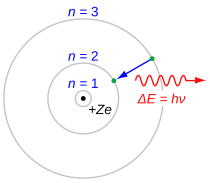
Balmer -serien kjennetegnes ved at elektronen overgår fra n ≥ 3 til n = 2, hvor n refererer til det radielle kvantetallet eller hovedkvantumnummeret til elektronen. Overgangene navngis sekvensielt med gresk bokstav: n = 3 til n = 2 kalles H-α, 4 til 2 er H-β, 5 til 2 er H-γ, og 6 til 2 er H-δ. Siden de første spektrallinjene knyttet til denne serien er lokalisert i den synlige delen av det elektromagnetiske spekteret , blir disse linjene historisk referert til som "H-alfa", "H-beta", "H-gamma", og så videre, hvor H er grunnstoffet hydrogen.
Overgang av n 3 → 2 4 → 2 5 → 2 6 → 2 7 → 2 8 → 2 9 → 2 ∞ → 2 Navn H-α / Ba-α H-p / Ba-p H-γ / Ba-γ H-δ / Ba-δ H-ε / Ba-ε H-ζ / Ba-ζ H-η / Ba-η Balmer pause Bølgelengde (nm, luft) 656.279 486.135 434.0472 410.1734 397.0075 388.9064 383.5397 364,6 Energiforskjell (eV) 1,89 2.55 2,86 3.03 3.13 3.19 3.23 3,40 Farge rød Aqua Blå Fiolett ( Ultrafiolett ) (Ultrafiolett) (Ultrafiolett) (Ultrafiolett)
Selv om fysikere var klar over atomutslipp før 1885, manglet de et verktøy for å forutsi nøyaktig hvor spektrallinjene skulle vises. Balmer -ligningen forutsier de fire synlige spektrallinjene for hydrogen med høy nøyaktighet. Balmers ligning inspirerte Rydberg -ligningen som en generalisering av den, og dette førte igjen til at fysikere fant Lyman- , Paschen- og Brackett -serien , som spådde andre spektrale linjer av hydrogen som ble funnet utenfor det synlige spekteret .
Den røde H-alfa- spektrallinjen i Balmer-serien med atomisk hydrogen, som er overgangen fra skallet n = 3 til skallet n = 2, er en av universets iøynefallende farger . Den bidrar med en lys rød linje til spektrene for utslipp eller ioniseringsnebula, som Oriontåken , som ofte er H II -regioner som finnes i stjernedannende områder. I sanne farger har disse stjernetåken en rødlig-rosa farge fra kombinasjonen av synlige Balmer-linjer som hydrogen avgir.
Senere ble det oppdaget at da Balmer -serielinjene i hydrogenspekteret ble undersøkt med svært høy oppløsning, var de dubletter med tett mellomrom. Denne splittelsen kalles fin struktur . Det ble også funnet at eksiterte elektroner fra skjell med n større enn 6 kunne hoppe til n = 2 -skallet og avgi nyanser av ultrafiolett når du gjør det.

Balmers formel
Balmer la merke til at en enkelt bølgelengde hadde et forhold til hver linje i hydrogenspekteret som var i det synlige lysområdet . Den bølgelengden var364,506 82 nm . Når et heltall høyere enn 2 ble kvadrert og deretter delt med seg selv i kvadrat minus 4, så multipliserte det tallet med364.506 82 nm (se ligning nedenfor) ga bølgelengden til en annen linje i hydrogenspekteret. Ved denne formelen kunne han vise at noen målinger av linjer foretatt i sin tid ved spektroskopi var litt unøyaktige og formelen forutslo linjer som senere ble funnet, men som ennå ikke var observert. Antallet hans viste seg også å være grensen for serien. Balmer -ligningen kan brukes til å finne bølgelengden til absorpsjons-/utslippslinjene og ble opprinnelig presentert som følger (bortsett fra en notasjonsendring for å gi Balmers konstant som B ):
Hvor
- λ er bølgelengden.
- B er en konstant med verdien av3,645 0682 × 10 −7 m eller364,506 82 nm .
- m er lik 2
- n er et helt tall slik at n > m .
I 1888 generaliserte fysikeren Johannes Rydberg Balmer -ligningen for alle hydrogenoverganger. Ligningen som vanligvis brukes til å beregne Balmer -serien er et spesifikt eksempel på Rydberg -formelen og følger som en enkel gjensidig matematisk omorganisering av formelen ovenfor (konvensjonelt bruker en notasjon av m for n som den enkle integralkonstanten som trengs):
hvor λ er bølgelengden til det absorberte/utsendte lyset og R H er Rydberg -konstanten for hydrogen. Rydberg -konstanten ses å være lik4/B i Balmers formel, og denne verdien, for en uendelig tung kjerne, er 4/3,645 0682 × 10 −7 m = 10 973 731 0,57 m -1 .
Rolle innen astronomi
Balmer -serien er spesielt nyttig i astronomi fordi Balmer -linjene vises i mange stjerneobjekter på grunn av overflod av hydrogen i universet , og derfor er de ofte sett og relativt sterke sammenlignet med linjer fra andre elementer.
Den spektrale klassifiseringen av stjerner, som først og fremst er en bestemmelse av overflatetemperatur, er basert på den relative styrken til spektrallinjer, og spesielt Balmer -serien er svært viktig. Andre kjennetegn ved en stjerne som kan bestemmes ved en nær analyse av dens spektrum inkluderer overflatetyngdekraft (relatert til fysisk størrelse) og sammensetning.
Fordi Balmer -linjene ofte sees i spektrene til forskjellige objekter, brukes de ofte til å bestemme radielle hastigheter på grunn av doppler -forskyvning av Balmer -linjene. Dette har viktige bruksområder over hele astronomien, fra å oppdage binære stjerner , eksoplaneter , kompakte objekter som nøytronstjerner og sorte hull (ved bevegelse av hydrogen i akkresjonsskiver rundt dem), identifisere grupper av objekter med lignende bevegelser og antagelig opprinnelse ( bevegelige grupper , stjerneklynger , galaksehoper og rusk fra kollisjoner), bestemmelse av avstander (faktisk rødforskyvninger ) til galakser eller kvasarer , og identifisering av ukjente objekter ved analyse av spekteret deres.
Balmer linjer kan vises som absorpsjon eller utslipp linjer i et spektrum, avhengig av arten av objektet observert. I stjerner er Balmer -linjene vanligvis sett i absorpsjon, og de er "sterkeste" i stjerner med en overflatetemperatur på omtrent 10 000 kelvin ( spektraltype A). I spektrene til de fleste spiral- og uregelmessige galakser, aktive galaktiske kjerner , H II -regioner og planetariske tåker er Balmer -linjene utslippslinjer.
I stjernespektre blandes ofte H-epsilon-linjen (overgang 7 → 2, 397.007 nm) med en annen absorpsjonslinje forårsaket av ionisert kalsium kjent som "H" (den opprinnelige betegnelsen gitt av Joseph von Fraunhofer ). H-epsilon skilles med 0,16 nm fra Ca II H ved 396,847 nm, og kan ikke løses i lavoppløselige spektre. H-zeta-linjen (overgang 8 → 2) blandes på samme måte inn med en nøytral heliumlinje sett i varme stjerner.
Se også
- Astronomisk spektroskopi
- Bohr modell
- Hydrogenspektralserier
- Lyman -serien
- Rydberg formel
- Stjerneklassifisering
- Teoretisk og eksperimentell begrunnelse for Schrödinger -ligningen


