Ortosilikat - Orthosilicate
I kjemi, ortosilikat er anion SiO 4−
4 eller noen av dets salter og estere . Det er et av silikatanionene . Det kalles av og til silisiumtetroksidanionen eller -gruppen .
Ortosilikatsalter, som natriumortosilikat , er stabile og forekommer vidt i naturen som silikatmineraler , og er det avgrensende trekk ved nesosilikatene . Olivin , et magnesium- eller jern (II) ortosilikat, er det mest vanlige mineralet i øvre kappe .
Ortosilikatanionet er en sterk base , den konjugerte basen til den ekstremt svake ortosilinsyre H
4 SiO
4 (p K a2 = 13,2 ved 25 ° C). Denne likevekten er vanskelig å studere siden syren har en tendens til å spaltes i et hydratisert silisiumdioksidkondensat .
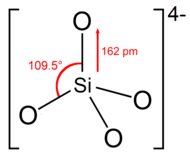
Struktur
Ortosilikationen eller -gruppen har tetrahedral form, med ett silisiumatom omgitt av fire oksygenatomer.
I anionet bærer hvert oksygen en negativ ladning. Si – O-bindingen er 162 pm lang.
I organiske forbindelser som tetrametylortosilikat er hvert oksygen formelt nøytralt og er koblet til resten av molekylet ved en enkelt kovalent binding .
Bruker
Europium- dopet bariumortosilikat (Ba 2 SiO 4 ) er en vanlig fosfor som brukes i lysdioder med grønt lys . Fosfor for blå lysdioder kan lages med strontiumdotert bariumortosilikat. Bariumortosilikat er en hovedårsak til katodeforgiftning i vakuumrør .
Organisk kjemi
Selv om det er veldig viktig i uorganisk kjemi og geokjemi, sees ortosilikationen sjelden i organisk kjemi. To silikatforbindelser brukes imidlertid i organisk syntese : tetraetylortosilikat eller TEOS brukes til å koble polymerer, og er spesielt viktig ved fremstilling av aerogeler. Tetrametylortosilikat eller TMOS brukes som et alternativ til TEOS, og har også en rekke andre bruksområder som et reagens. TEOS foretrekkes fremfor TMOS da TMOS spaltes for å produsere høye konsentrasjoner av giftig metanol . Innånding av TMOS kan føre til giftig opphopning av silisiumdioksyd i lungene.