Benzen - Benzene
|
|||
 Romfyllende modell
|
|||
| Navn | |||
|---|---|---|---|
|
Foretrukket IUPAC -navn
Benzen |
|||
| Andre navn
Benzol (historisk/tysk)
Cyclohexa-1,3,5-triene; 1,3,5-Cyclohexatriene [6] Annulene (anbefales ikke) |
|||
| Identifikatorer | |||
|
3D -modell ( JSmol )
|
|||
| ChEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100.000.685 |
||
| EC -nummer | |||
| KEGG | |||
|
PubChem CID
|
|||
| RTECS -nummer | |||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C 6 H 6 | |||
| Molar masse | 78,114 g · mol −1 | ||
| Utseende | Fargeløs væske | ||
| Lukt | søt aromatisk | ||
| Tetthet | 0,8765 (20) g / cm 3 | ||
| Smeltepunkt | 5,53 ° C (41,95 ° F; 278,68 K) | ||
| Kokepunkt | 80,1 ° C (176,2 ° F; 353,2 K) | ||
| 1,53 g/L (0 ° C) 1,81 g/L (9 ° C) 1,79 g/L (15 ° C) 1,84 g/L (30 ° C) 2,26 g/L (61 ° C) 3,94 g/L ( 100 ° C) 21,7 g/kg (200 ° C, 6,5 MPa) 17,8 g/kg (200 ° C, 40 MPa) |
|||
| Løselighet | Løselig i alkohol , CHCl 3 , CCl 4 , dietyleter , aceton , eddiksyre | ||
| Løselighet i etandiol | 5,83 g/100 g (20 ° C) 6,61 g/100 g (40 ° C) 7,61 g/100 g (60 ° C) |
||
| Løselighet i etanol | 20 ° C, oppløsning i vann: 1,2 ml/l (20% v/v) |
||
| Løselighet i aceton | 20 ° C, oppløsning i vann: 7,69 ml/l (38,46% vol/vol) 49,4 ml/l (62,5% vol/vol) |
||
| Løselighet i dietylenglykol | 52 g/100 g (20 ° C) | ||
| logg P | 2.13 | ||
| Damptrykk | 12,7 kPa (25 ° C) 24,4 kPa (40 ° C) 181 kPa (100 ° C) |
||
| Konjugat syre | Benzenium | ||
| UV-vis (λ maks ) | 255 nm | ||
| −54,8 · 10 −6 cm 3 /mol | |||
|
Brytningsindeks ( n D )
|
1,5011 (20 ° C) 1,4948 (30 ° C) |
||
| Viskositet | 0,7528 cP (10 ° C) 0,6076 cP (25 ° C) 0,4965 cP (40 ° C) 0,3075 cP (80 ° C) |
||
| Struktur | |||
| Trigonal plan | |||
| 0 D | |||
| Termokjemi | |||
|
Varmekapasitet ( C )
|
134,8 J/mol · K | ||
|
Std molar
entropi ( S |
173,26 J/mol · K | ||
|
Std
formasjonsentalpi (Δ f H ⦵ 298 ) |
48,7 kJ/mol | ||
|
Std
forbrenningsentalpi (Δ c H ⦵ 298 ) |
3267,6 kJ/mol | ||
| Farer | |||
| viktigste farer | potensielt yrkeskreftfremkallende, brannfarlig | ||
| Sikkerhetsdatablad |
Se: dataside HMDB |
||
| GHS -piktogrammer |
    
|
||
| GHS Signalord | Fare | ||
| H225 , H304 , H315 , H319 , H340 , H350 , H372 , H410 | |||
| P201 , P210 , P301+310 , P305+351+338 , P308+313 , P331 | |||
| NFPA 704 (branndiamant) | |||
| Flammepunkt | −11,63 ° C (11,07 ° F; 261,52 K) | ||
| 497,78 ° C (928,00 ° F; 770,93 K) | |||
| Eksplosive grenser | 1,2–7,8% | ||
| Dødelig dose eller konsentrasjon (LD, LC): | |||
|
LD 50 ( median dose )
|
930 mg/kg (rotte, oral) | ||
|
LC Lo ( lavest publisert )
|
44.000 ppm (kanin, 30 min) 44.923 ppm (hund) 52.308 ppm (cat) 20.000 ppm (human, 5 min) |
||
| NIOSH (amerikanske helseeksponeringsgrenser): | |||
|
PEL (tillatt)
|
TWA 1 ppm, ST 5 ppm | ||
|
REL (anbefalt)
|
Ca TWA 0,1 ppm ST 1 ppm | ||
|
IDLH (Umiddelbar fare)
|
500 spm | ||
| Relaterte forbindelser | |||
|
Relaterte forbindelser
|
Toluen Borazine |
||
| Supplerende dataside | |||
|
Brytningsindeks ( n ), Dielektrisk konstant (ε r ), etc. |
|||
|
Termodynamiske
data |
Faseadferd fast – væske – gass |
||
| UV , IR , NMR , MS | |||
|
Med mindre annet er angitt, gis data for materialer i standardtilstand (ved 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Infobox -referanser | |||
Benzen er et organisk kjemisk forbindelse med molekylformel C 6 H 6 . Benzen- molekylet er sammensatt av seks karbonatomer deltar i en plan ring med ett hydrogenatom bundet til hver. Fordi den bare inneholder karbon- og hydrogenatomer, blir benzen klassifisert som et hydrokarbon .
Benzen er en naturlig bestanddel av råolje og er en av de grunnleggende petrokjemikaliene . På grunn av de sykliske kontinuerlige pi -bindingene mellom karbonatomene, blir benzen klassifisert som et aromatisk hydrokarbon . Det er noen ganger forkortet Ph H. Benzen er en fargeløs og svært brannfarlig væske med en søt lukt, og er delvis ansvarlig for aromaen rundt bensinstasjoner (bensin). Det brukes først og fremst som en forløper for produksjon av kjemikalier med en mer kompleks struktur, for eksempel etylbenzen og kumen , hvorav milliarder kilo produseres årlig. Selv om det er en viktig industriell kjemikalie , finner benzen begrenset bruk i forbruksvarer på grunn av dets toksisitet.
Historie
Oppdagelse
Ordet "benzen" stammer fra "gummibenzoin" ( benzoinharpiks ), en aromatisk harpiks kjent for europeiske farmasøyter og parfymer siden 1500 -tallet som et produkt fra sørvest -Asia. Et surt materiale ble avledet fra benzoin ved sublimering , og ble kalt "blomster av benzoin", eller benzoesyre. Hydrokarbonet avledet fra benzoesyre fikk dermed navnet benzin, benzol eller benzen. Michael Faraday isolerte og identifiserte først benzen i 1825 fra den oljeaktige resten som stammer fra produksjonen av lysende gass, og ga den navnet bikarburett av hydrogen . I 1833 produserte Eilhard Mitscherlich den ved å destillere benzoesyre (fra gummibensoin ) og kalk . Han ga stoffet navnet benzin . I 1836 kalte den franske kjemikeren Auguste Laurent stoffet "phène"; dette ordet har blitt roten til det engelske ordet " fenol ", som er hydroksylert benzen, og " fenyl ", radikalet dannet ved abstraksjon av et hydrogenatom ( friradikal H •) fra benzen.
I 1845 isolerte Charles Mansfield , som jobbet under August Wilhelm von Hofmann , benzen fra kulltjære . Fire år senere begynte Mansfield den første industrielle produksjonen av benzen, basert på kulltjærmetoden. Etter hvert utviklet følelsen seg blant kjemikere om at en rekke stoffer var kjemisk beslektet med benzen, og som består av en mangfoldig kjemisk familie. I 1855 brukte Hofmann ordet " aromatisk " for å betegne dette familieforholdet, etter en karakteristisk egenskap for mange av medlemmene. I 1997 ble det påvist benzen på dypt rom .
Ringformel
Den empiriske formel for benzen ble det lenge har vært kjent, men det er meget flerumettet struktur, med bare ett hydrogenatom for hvert karbonatom, er vanskelig å bestemme. Archibald Scott Couper i 1858 og Johann Josef Loschmidt i 1861 foreslo mulige strukturer som inneholdt flere dobbeltbindinger eller flere ringer, men for lite bevis var da tilgjengelig for å hjelpe kjemikere til å bestemme seg for en bestemt struktur.
I 1865 publiserte den tyske kjemikeren Friedrich August Kekulé et papir på fransk (for han underviste da i frankofon Belgia) som antydet at strukturen inneholdt en ring med seks karbonatomer med vekslende enkelt- og dobbeltbindinger. Neste år publiserte han en mye lengre artikkel på tysk om samme emne. Kekulé brukte bevis som hadde samlet seg opp i de mellomliggende årene - nemlig at det alltid så ut til å være bare en isomer av et monoderivativ av benzen, og at det alltid så ut til å være nøyaktig tre isomerer av hvert disubstituert derivat - nå forstått å svare til ortoen , meta og para mønstre for arene substitusjon - å argumentere til støtte for hans foreslåtte struktur. Kekulés symmetriske ring kan forklare disse merkelige faktaene, så vel som benzenens karbon-hydrogen-forhold på 1: 1.
Den nye forståelsen av benzen, og dermed alle aromatiske forbindelser, viste seg å være så viktig for både ren og anvendt kjemi at det tyske kjemiske samfunn i 1890 organiserte en omfattende forståelse til Kekulés ære og feiret tjuefemårsdagen for hans første benzenpapir. . Her snakket Kekulé om opprettelsen av teorien. Han sa at han hadde oppdaget ringformen til benzenmolekylet etter å ha en drøm eller dagdrøm om en slange som grep sin egen hale (dette er et vanlig symbol i mange gamle kulturer kjent som Ouroboros eller Endless knute ). Denne visjonen, sa han, kom til ham etter år med å ha studert karbon-karbon-bindings natur. Dette var 7 år etter at han hadde løst problemet med hvordan karbonatomer kunne binde seg til opptil fire andre atomer samtidig. Merkelig nok hadde en lignende, humoristisk skildring av benzen dukket opp i 1886 i en brosjyre med tittelen Berichte der Durstigen Chemischen Gesellschaft (Journal of the Thirsty Chemical Society), en parodi på Berichte der Deutschen Chemischen Gesellschaft , bare parodien hadde aper som grep hverandre i en sirkel, snarere enn slanger som i Kekulés anekdote. Noen historikere har antydet at parodien var en lampong av slangeanekdoten, muligens allerede godt kjent gjennom muntlig overføring, selv om den ennå ikke hadde vist seg på trykk. Kekulés tale fra 1890 der denne anekdoten dukket opp er oversatt til engelsk. Hvis anekdoten er minnet om en virkelig hendelse, antyder omstendighetene nevnt i historien at det må ha skjedd tidlig i 1862.
Benzenens sykliske natur ble endelig bekreftet av krystallografen Kathleen Lonsdale i 1929.
Nomenklatur
Den tyske kjemikeren Wilhelm Körner foreslo prefiksene orto-, meta-, para- for å skille di-substituerte benzenderivater i 1867; Imidlertid brukte han ikke prefiksene for å skille de relative posisjonene til substituentene på en benzenring. Det var den tyske kjemikeren Karl Gräbe som i 1869 først brukte prefiksene orto-, meta-, para- for å betegne spesifikke relative steder for substituentene på en di-substituert aromatisk ring (dvs. naftalen). I 1870 brukte den tyske kjemikeren Viktor Meyer først Gräbes nomenklatur på benzen.
Tidlige søknader
På 1800- og begynnelsen av 1900-tallet ble benzen brukt som en barberkrem på grunn av den behagelige lukten. Før 1920 -tallet ble benzen ofte brukt som et industrielt løsningsmiddel, spesielt for avfetting av metall. Etter hvert som toksisiteten ble åpenbar, ble benzen erstattet av andre løsningsmidler, spesielt toluen (metylbenzen), som har lignende fysiske egenskaper, men ikke er så kreftfremkallende.
I 1903 populariserte Ludwig Roselius bruken av benzen til koffeinfri kaffe . Denne oppdagelsen førte til produksjonen av Sanka . Denne prosessen ble senere avbrutt. Benzen ble historisk brukt som en viktig komponent i mange forbrukerprodukter som Liquid Wrench , flere malingsstrippere , gummisementer , flekkfjernere og andre produkter. Produksjonen av noen av disse benzenholdige formuleringene opphørte i omtrent 1950, selv om Liquid Wrench fortsatte å inneholde betydelige mengder benzen til slutten av 1970-tallet.
Hendelse
Sporbare mengder benzen finnes i petroleum og kull. Det er et biprodukt av ufullstendig forbrenning av mange materialer. For kommersiell bruk, frem til andre verdenskrig , ble mest benzen hentet som et biprodukt fra koksproduksjon (eller "koksovn lett olje") for stålindustrien . På 1950 -tallet økte imidlertid etterspørselen etter benzen, spesielt fra den voksende polymerindustrien , produksjon av benzen fra petroleum. I dag kommer det meste benzen fra petrokjemisk industri , og bare en liten brøkdel blir produsert av kull. Benzenmolekyler er påvist på Mars .
Struktur
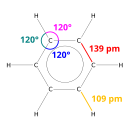
Røntgendiffraksjon viser at alle seks karbon-karbonbindinger i benzen er av samme lengde, ved 140 pikometre (pm). Lengden på C -C -bindingen er større enn en dobbeltbinding (135 pm), men kortere enn en enkeltbinding (147 pm). Denne mellomliggende avstand er forårsaket av elektron delokalisering : elektronene til C = C binding er fordelt likt mellom hver av de seks karbonatomer. Benzen har 6 hydrogenatomer, færre enn den tilsvarende overordnede alkanen , heksan , som har 14. Benzen og cykloheksan har en lignende struktur, bare ringen av delokaliserte elektroner og tapet av ett hydrogen per karbon skiller den fra cykloheksan. Molekylet er plant. Den molekylære orbitalbeskrivelsen innebærer dannelse av tre delokaliserte π -orbitaler som strekker seg over alle seks karbonatomer, mens beskrivelsen av valensbindingen innebærer en superposisjon av resonansstrukturer . Det er sannsynlig at denne stabiliteten bidrar til de særegne molekylære og kjemiske egenskapene kjent som aromaticitet . For å nøyaktig gjenspeile bindingens natur, er benzen ofte avbildet med en sirkel inne i et sekskantet arrangement av karbonatomer.
Derivater av benzen forekommer tilstrekkelig ofte som en komponent i organiske molekyler som Unicode Consortium har tildelt et symbol i blokken Diverse tekniske med koden U+232C (⌬) for å representere den med tre dobbeltbindinger, og U+23E3 (⏣) for en delokalisert versjon.
Benzen -derivater
Mange viktige kjemiske forbindelser stammer fra benzen ved å erstatte ett eller flere av hydrogenatomene med en annen funksjonell gruppe . Eksempler på enkle benzenderivater er fenol , toluen , og anilin , forkortet PhOH, PhMe, og PhNH 2 , henholdsvis. Kobling benzenringer gir bifenyl , C 6 H 5 -C 6 H 5 . Ytterligere tap av hydrogen gir "smeltede" aromatiske hydrokarboner, slik som naftalen , antracen , fenantren og pyren . Grensen for fusjonsprosessen er den hydrogenfrie allotropen av karbon, grafitt .
I heterocycles blir karbonatomer i benzenringen erstattet med andre elementer. De viktigste variasjonene inneholder nitrogen . Erstatte en CH med N gir forbindelsen pyridin , C 5 H 5 N. Selv om benzen og pyridin er strukturelt beslektet, benzen kan ikke omdannes til pyridin. Erstatning av en andre CH -binding med N gir, avhengig av plasseringen av den andre N, pyridazin , pyrimidin eller pyrazin .
Produksjon
Fire kjemiske prosesser bidrar til industriell produksjon benzen: katalytisk reformering , toluen hydrodealkylering, toluen disproposjonering, og dampkrakking . I følge ATSDR Toxicological Profile for benzen utgjorde katalytiske reformater mellom 1978 og 1981 omtrent 44–50% av den totale amerikanske benzenproduksjonen.
Katalytisk reformering
Ved katalytisk reforming, en blanding av hydrokarboner med kokepunkt mellom 60 og 200 ° C, blandes med hydrogengass og deretter utsatt for en bifunksjonell platina-klorid eller rhenium -klorid -katalysator ved 500 til 525 ° C og trykk i området 8-50 atm. Under disse forholdene danner alifatiske hydrokarboner ringer og mister hydrogen for å bli aromatiske hydrokarboner. De aromatiske produktene av reaksjonen separeres deretter fra reaksjonsblandingen (eller reformatet) ved ekstraksjon med et hvilket som helst av et antall løsningsmidler , inkludert dietylenglykol eller sulfolan , og benzen skilles deretter fra de andre aromater ved destillasjon. Ekstraksjonstrinnet av aromater fra reformatet er designet for å produsere aromater med lavest ikke-aromatiske komponenter. Gjenvinning av aromater, vanligvis referert til som BTX (benzen, toluen og xylenisomerer), innebærer slike ekstraksjon og destillasjonstrinn.
På samme måte som denne katalytiske reformeringen kommersialiserte UOP og BP en metode fra LPG (hovedsakelig propan og butan) til aromater.
Toluen hydrodealkylering
Toluen hydrodealkylering omdanner toluen til benzen. I denne hydrogen-intensiv prosess, er toluen blandet med hydrogen, og deretter ført over en krom , molybden eller platina oksyd katalysator ved 500-650 ° C og 20-60 atm trykk. Noen ganger brukes høyere temperaturer i stedet for en katalysator (ved lignende reaksjonstilstand). Under disse forholdene gjennomgår toluen dealkylering til benzen og metan :
- C 6 H 5 CH 3 + H 2 → C 6 H 6 + CH 4
Denne irreversible reaksjonen ledsages av en likevektsreaksjon som produserer bifenyl (aka difenyl) ved høyere temperatur:
- 2 C
6H
6⇌ H
2+ C
6H
5–C
6H
5
Hvis råvarestrømmen inneholder mye ikke-aromatiske komponenter (parafiner eller naftener), brytes de sannsynligvis ned til lavere hydrokarboner som metan, noe som øker forbruket av hydrogen.
Et typisk reaksjonsutbytte overstiger 95%. Noen ganger brukes xylener og tyngre aromater i stedet for toluen, med lignende effektivitet.
Dette kalles ofte "on-purpose" metodikk for å produsere benzen, sammenlignet med konvensjonelle BTX (benzen-toluen-xylen) ekstraksjonsprosesser.
Toluen disproportionation
Toluen disproportionation ( TDP ) er konvertering av toluen til benzen og xylen .
Gitt at etterspørselen etter para -xylen ( p -xylen ) vesentlig overstiger behovet for andre xylenisomerer , kan en forbedring av TDP -prosessen kalt Selective TDP (STDP) brukes. I denne prosessen er xylenstrømmen som forlater TDP -enheten omtrent 90% p -xylen. I noen systemer endres til og med benzen-til-xylener-forholdet for å favorisere xylener.
Dampsprekk
Dampsprekk er prosessen for å produsere etylen og andre alkener fra alifatiske hydrokarboner . Avhengig av råstoffet som brukes til å produsere olefinene, kan dampsprekker produsere et benzenrikt flytende biprodukt som kalles pyrolysebensin . Pyrolysebensin kan blandes med andre hydrokarboner som bensintilsetningsstoff, eller ledes gjennom en ekstraksjonsprosess for å gjenvinne BTX -aromater (benzen, toluen og xylener).
Andre metoder
Selv om det ikke har noen kommersiell betydning, finnes det mange andre ruter til benzen. Fenol og halobenzener kan reduseres med metaller. Benzoesyre og dets salter gjennomgår dekarboksylering til benzen. Reaksjonen av diazoniumforbindelsen avledet fra anilin med hypofosforsyre gir benzen. Trimerisering av acetylen gir benzen.
Bruker
Benzen brukes hovedsakelig som et mellomprodukt for å lage andre kjemikalier, fremfor alt etylbenzen , kumen , cykloheksan , nitrobenzen og alkylbenzen. I 1988 ble det rapportert at to tredjedeler av alle kjemikalier på American Chemical Society 's lister inneholdt minst en benzenring. Mer enn halvparten av hele benzenproduksjonen blir behandlet til etylbenzen, en forløper til styren , som brukes til å lage polymerer og plast som polystyren og EPS. Omtrent 20% av benzenproduksjonen brukes til å produsere kumen, som er nødvendig for å produsere fenol og aceton for harpikser og lim. Sykloheksan forbruker rundt 10% av verdens benzenproduksjon; den brukes først og fremst til fremstilling av nylonfibre, som blir bearbeidet til tekstiler og konstruksjonsplast. Mindre mengder benzen brukes til å lage noen typer gummi , smøremidler , fargestoffer , vaskemidler , narkotika , sprengstoff og plantevernmidler . I 2013 var det største forbrukerlandet av benzen Kina, etterfulgt av USA. Benzenproduksjonen vokser for tiden i Midtøsten og i Afrika, mens produksjonskapasiteten i Vest -Europa og Nord -Amerika stagnerer.
Toluen brukes nå ofte som erstatning for benzen, for eksempel som drivstofftilsetningsstoff. Løsningsmiddelegenskapene til de to er like, men toluen er mindre giftig og har et bredere væskeområde. Toluen blir også bearbeidet til benzen.
Komponent av bensin
Som bensin (bensin) tilsetningsstoff, øker benzen oktantallet og reduserer banker . Som en konsekvens inneholdt bensin ofte flere prosent benzen før 1950 -tallet, da tetraetyl bly erstattet det som det mest brukte antiknock -tilsetningsstoffet. Med den globale avviklingen av blyholdig bensin, har benzen gjort et comeback som bensintilsetningsstoff i noen nasjoner. I USA har bekymring over de negative helseeffektene og muligheten for at benzen kommer ned i grunnvannet ført til streng regulering av bensininnholdet, med begrensninger vanligvis rundt 1%. Europeiske bensinspesifikasjoner inneholder nå den samme 1% grensen for benzeninnhold. The Environmental Protection Agency innført nye regler i 2011 som senket benzeninnholdet i bensin til 0,62%. På mange europeiske språk er ordet for petroleum eller bensin en eksakt tilhørende "benzen".
Reaksjoner
De vanligste reaksjonene av benzen innebærer substitusjon av et proton med andre grupper. Elektrofil aromatisk substitusjon er en generell metode for derivatisering av benzen. Benzen er tilstrekkelig nukleofil at det gjennomgår substitusjon av acylium ioner og alkyl karbokationer for å gi substituerte derivater.
Det mest praktiserte eksempelet på denne reaksjonen er etylering av benzen.
Omtrent 24 700 000 tonn ble produsert i 1999. Svært lærerikt, men av langt mindre industriell betydning er Friedel-Crafts alkylering av benzen (og mange andre aromatiske ringer) ved bruk av et alkylhalogenid i nærvær av en sterk Lewis-syrekatalysator. På samme måte er Friedel-Crafts acylering et beslektet eksempel på elektrofil aromatisk substitusjon . Reaksjonen innebærer acylering av benzen (eller mange andre aromatiske ringer) med et acylklorid ved bruk av en sterk Lewis -syrekatalysator som aluminiumklorid eller jern (III) klorid .
Sulfonering, klorering, nitrering
Ved bruk av elektrofil aromatisk substitusjon blir mange funksjonelle grupper introdusert på benzenrammen. Sulfonering av benzen innebærer bruk av oleum , en blanding av svovelsyre med svoveltrioksid . Sulfonerte benzenderivater er nyttige vaskemidler . Ved nitrering reagerer benzen med nitroniumioner (NO 2 + ), som er en sterk elektrofil produsert ved å kombinere svovelsyre og salpetersyrer. Nitrobenzen er forløperen til anilin . Klorering oppnås med klor for å gi klorbenzen i nærvær av en Lewis-syrekatalysator slik som aluminiumtri-klorid.
Hydrogenering
Via hydrogenering omdannes benzen og derivater til cykloheksan og derivater. Denne reaksjon oppnås ved bruk av høyt trykk av hydrogen i nærvær av heterogene katalysatorer , slik som finfordelt nikkel . Mens alkener kan hydrogeneres nær romtemperaturer, er benzen og beslektede forbindelser mer motvillige underlag, som krever temperaturer> 100 ° C. Denne reaksjonen praktiseres i stor skala industrielt. I fravær av katalysatoren er benzen ugjennomtrengelig for hydrogen. Hydrogenering kan ikke stoppes for å gi cykloheksen eller cykloheksadiener ettersom disse er overlegne underlag. Bjørkereduksjon , en ikke -katalytisk prosess, hydrogenerer imidlertid selektivt benzen til dienen.
Metallkomplekser
Benzen er en utmerket ligand i organometallisk kjemi av lavverdige metaller. Viktige eksempler er sandwich og halv-sandwich-komplekser, henholdsvis Cr (C 6 H 6 ) 2 og [RuCl 2 (C 6 H 6 )] 2 .
Helseeffekter
Benzen er klassifisert som kreftfremkallende , noe som øker risikoen for kreft og andre sykdommer, og er også en beryktet årsak til benmargssvikt . Betydelige mengder epidemiologiske, kliniske og laboratoriedata knytter benzen til aplastisk anemi, akutt leukemi, benmargsavvik og kardiovaskulær sykdom. De spesifikke hematologiske malignitetene som benzen er forbundet med inkluderer: akutt myeloid leukemi (AML), aplastisk anemi, myelodysplastisk syndrom (MDS), akutt lymfoblastisk leukemi (ALL) og kronisk myeloid leukemi (CML).
The American Petroleum Institute (API) uttalte i 1948 at "det er generelt ansett som den eneste helt trygt konsentrasjon for benzen er null". Det er ingen sikker eksponeringsnivå; selv små mengder kan forårsake skade. Det amerikanske Department of Health and Human Services (DHHS) klassifiserer benzen som et menneske kreftfremkallende . Langsiktig eksponering for store mengder benzen i luften forårsaker leukemi , en potensielt dødelig kreft i de bloddannende organene. Spesielt er det ikke bestridt at akutt myeloid leukemi eller akutt ikke -lymfocytisk leukemi (AML og ANLL) skyldes benzen. IARC vurderte benzen som "kjent for å være kreftfremkallende for mennesker" (gruppe 1).
Siden benzen er allestedsnærværende i bensin og hydrokarbonbrensel som er i bruk overalt, er menneskelig eksponering for benzen et globalt helseproblem. Benzen retter seg mot lever, nyre, lunge, hjerte og hjerne og kan forårsake DNA -strengbrudd og kromosomskader . Benzen forårsaker kreft hos dyr, inkludert mennesker. Benzen har vist seg å forårsake kreft hos begge kjønn av flere arter av forsøksdyr eksponert via forskjellige ruter.
Eksponering for benzen
Ifølge Agency for Toxic Substances and Disease Registry (ATSDR) (2007) er benzen både et menneskeskapt og naturlig forekommende kjemikalie fra prosesser som inkluderer: vulkanutbrudd, ville branner, syntese av kjemikalier som fenol , produksjon av syntetiske fibre , og produksjon av gummi , smøremidler , plantevernmidler , medisiner og fargestoffer . De viktigste kildene til benzeneksponering er tobakkrøyk , bensinstasjoner, eksos fra motorvogner og industriutslipp; inntak og dermal absorpsjon av benzen kan imidlertid også skje ved kontakt med forurenset vann. Benzen metaboliseres hepatisk og skilles ut i urinen . Måling av luft og vann-nivåer av benzen oppnås gjennom oppsamlings via aktivt kull rør, som så blir analysert med en gasskromatograf . Måling av benzen hos mennesker kan utføres via urin- , blod- og pustetester ; Imidlertid har alle disse sine begrensninger fordi benzen raskt metaboliseres i menneskekroppen.
Eksponering for benzen kan gradvis føre til aplastisk anemi , leukemi og myelomatose .
OSHA regulerer nivået av benzen på arbeidsplassen. Maksimal tillatt mengde benzen i arbeidsromluften i løpet av en 8-timers arbeidsdag, 40-timers arbeidsuke er 1 spm. Som benzen kan forårsake kreft , NIOSH anbefaler at alle arbeiderne bruke spesielle pusteutstyr når de sannsynligvis vil bli utsatt for benzen ved nivåer som overskrider de anbefalte (8-time) eksponering grensen på 0,1 ppm.
Eksponeringsgrenser for benzen
The Environmental Protection Agency har satt en maksimal forurensningsnivå (MCL) for benzen i drikkevannet på 0,005 mg / l (5 ppb), som kunngjort via det amerikanske National Primary Drikkevannsforskriften. Denne forskriften er basert på å forhindre benzen leukemogenese. Det maksimale målet for forurensningsnivå (MCLG), et ikke -håndhevbart helsemål som ville gi en tilstrekkelig sikkerhetsmargin for å forhindre bivirkninger, er null benzenkonsentrasjon i drikkevann. EPA krever at søl eller utilsiktet utslipp til miljøet på 4,5 kg eller mer benzen rapporteres.
US Occupational Safety and Health Administration (OSHA) har fastsatt en tillatt eksponeringsgrense på 1 del benzen per million deler luft (1 ppm) på arbeidsplassen i løpet av en 8-timers arbeidsdag, 40-timers arbeidsuke. Kortsiktig eksponeringsgrense for luftbåren benzen er 5 ppm i 15 minutter. Disse juridiske grensene var basert på studier som viser overbevisende bevis på helserisiko for arbeidere utsatt for benzen. Risikoen ved eksponering for 1 ppm for en levetid har blitt estimert til 5 overdrevne leukemidødsfall per 1000 utsatte ansatte. (Dette estimatet antar ingen terskel for benzenens kreftfremkallende effekter.) OSHA har også etablert et tiltaksnivå på 0,5 ppm for å oppmuntre til enda lavere eksponering på arbeidsplassen.
Det amerikanske nasjonale instituttet for arbeidssikkerhet og helse (NIOSH) reviderte konsentrasjonen av umiddelbart farlig for liv og helse (IDLH) for benzen til 500 ppm. Den nåværende NIOSH -definisjonen for en IDLH -tilstand, som gitt i NIOSH Respirator Selection Logic, er en som utgjør en trussel om eksponering for luftbårne forurensninger når eksponeringen sannsynligvis vil forårsake død eller umiddelbare eller forsinkede permanente negative helseeffekter eller forhindre flukt fra slike et miljø [NIOSH 2004]. Formålet med å etablere en IDLH -verdi er (1) å sikre at arbeideren kan rømme fra et gitt forurenset miljø ved feil i åndedrettsvern og (2) anses som et maksimumsnivå over hvilket bare et svært pålitelig pusteapparat å gi maksimal beskyttelse av arbeidstakere er tillatt [NIOSH 2004]. I september 1995 utstedte NIOSH en ny policy for utvikling av anbefalte eksponeringsgrenser (REL) for stoffer, inkludert kreftfremkallende stoffer. Ettersom benzen kan forårsake kreft, anbefaler NIOSH at alle arbeidstakere bruker spesielt pusteutstyr når de sannsynligvis vil bli utsatt for benzen ved nivåer som overstiger REL (10 timer) på 0,1 ppm. NIOSHs kortsiktige eksponeringsgrense (STEL-15 min) er 1 ppm.
American Conference of Governmental Industrial Hygienists (ACGIH) vedtok Threshold Limit Values (TLVs) for benzen på 0,5 ppm TWA og 2,5 ppm STEL.
Toksikologi
Biomarkører for eksponering
Flere tester kan bestemme eksponering for benzen. Benzen selv kan måles i pust, blod eller urin, men slike tester er vanligvis begrenset til de første 24 timene etter eksponering på grunn av relativt hurtig fjerning av kjemikaliet ved utånding eller biotransformasjon. De fleste i utviklede land har målbare baselinjenivåer av benzen og andre aromatiske petroleumshydrokarboner i blodet. I kroppen omdannes benzen enzymatisk til en rekke oksidasjonsprodukter, inkludert mukonsyre , fenylmercaptursyre , fenol , katekol , hydrokinon og 1,2,4-trihydroksybenzen . De fleste av disse metabolittene har en viss verdi som biomarkører for menneskelig eksponering, siden de akkumuleres i urinen i forhold til eksponeringens omfang og varighet, og de kan fortsatt være tilstede i noen dager etter at eksponeringen er opphørt. De nåværende ACGIH-eksponeringsgrensene for yrkesmessig eksponering er 500 μg/g kreatinin for mukonsyre og 25 μg/g kreatinin for fenylmercapturinsyre i en urinprøve ved slutten av skift.
Biotransformasjoner
Selv om det ikke er et vanlig underlag for metabolisme, kan benzen oksideres av både bakterier og eukaryoter . Hos bakterier kan dioksygenaseenzym tilsette oksygen til ringen, og det ustabile produktet reduseres umiddelbart (ved NADH ) til en syklisk diol med to dobbeltbindinger, og bryter aromatikken. Deretter reduseres diolen nylig av NADH til katekol . Katekolen metaboliseres deretter til acetyl CoA og succinyl CoA , brukt av organismer hovedsakelig i sitronsyresyklusen for energiproduksjon.
Veien for metabolisme av benzen er kompleks og begynner i leveren. Flere enzymer er involvert. Disse inkluderer cytokrom P450 2E1 (CYP2E1), kininoksidoreduktase (NQ01 eller DT-diaphorase eller NAD (P) H dehydrogenase (kinon 1) ), GSH og myeloperoksidase (MPO). CYP2E1 er involvert i flere trinn: konvertering av benzen til oksepin (benzenoksid), fenol til hydrokinon og hydrokinon til både benzenetriol og katekol . Hydrokinon, benzenetriol og katekol omdannes til polyfenoler. I benmargen omdanner MPO disse polyfenolene til benzoquinones. Disse mellomproduktene og metabolittene induserer gentoksisitet ved flere mekanismer, inkludert inhibering av topoisomerase II (som opprettholder kromosomstrukturen), forstyrrelse av mikrotubuli (som opprettholder cellulær struktur og organisering), generering av frie oksygenradikaler (ustabile arter) som kan føre til punktmutasjoner, økende oksidativt stress, induserende DNA -strengbrudd og endring av DNA -metylering (som kan påvirke genuttrykk). NQ01 og GSH skifter metabolisme bort fra toksisitet. NQ01 metaboliserer benzokinon mot polyfenoler (motvirker effekten av MPO). GSH er involvert i dannelsen av fenylmerkaptursyre.
Genetiske polymorfismer i disse enzymene kan forårsake tap av funksjon eller gevinst av funksjon. For eksempel øker mutasjoner i CYP2E1 aktivitet og resulterer i økt generering av giftige metabolitter. NQ01 mutasjoner resulterer i tap av funksjon og kan resultere i redusert avgiftning. Myeloperoksidasemutasjoner resulterer i tap av funksjon og kan resultere i redusert generering av giftige metabolitter. GSH -mutasjoner eller slettinger resulterer i tap av funksjon og resulterer i redusert avgiftning. Disse genene kan være mål for genetisk screening for følsomhet for benstetoksisitet.
Molekylær toksikologi
Paradigmet for toksikologisk vurdering av benzen beveger seg mot domenet til molekylær toksikologi ettersom det muliggjør forståelse av grunnleggende biologiske mekanismer på en bedre måte. Glutation ser ut til å spille en viktig rolle ved å beskytte mot benzeninduserte DNA-brudd, og det blir identifisert som en ny biomarkør for eksponering og effekt. Benzen forårsaker kromosomavvik i det perifere blodets leukocytter og benmarg som forklarer den høyere forekomsten av leukemi og myelomatose forårsaket av kronisk eksponering. Disse avvikene kan overvåkes ved bruk av fluorescerende in situ hybridisering (FISH) med DNA -sonder for å vurdere effekten av benzen sammen med de hematologiske testene som markører for hematotoksisitet. Benzenmetabolisme involverer enzymer kodet av polymorfe gener. Studier har vist at genotype på disse stedene kan påvirke følsomheten for de toksiske effektene av eksponering for benzen. Personer som bærer variant av NAD (P) H: kinonoksidoreduktase 1 (NQO1), mikrosomal epoksidhydrolase (EPHX) og sletting av glutation S-transferase T1 (GSTT1) viste en større frekvens av DNA enkeltstrengede brudd.
Biologisk oksidasjon og kreftfremkallende aktivitet
En måte å forstå de kreftfremkallende effektene av benzen på er å undersøke produktene av biologisk oksidasjon. Ren benzen, for eksempel, oksiderer i kroppen for å produsere et epoksyd, benzenoksid , som ikke skilles ut lett og kan samhandle med DNA for å produsere skadelige mutasjoner.
Eksponeringsveier
Innånding
Uteluft kan inneholde lave nivåer av benzen fra bensinstasjoner, trerøyk, tobakkrøyk, overføring av bensin, eksos fra motorvogner og industriutslipp. Omtrent 50% av hele landsomfattende (USA) eksponering for benzen skyldes røyking av tobakk eller eksponering for tobakkrøyk. Etter å ha røkt 32 sigaretter per dag, ville røykeren ta i seg omtrent 1,8 milligram (mg) benzen. Dette beløpet er omtrent 10 ganger det gjennomsnittlige daglige inntaket av benzen for ikke -røykere.
Inhalert benzen blir hovedsakelig utvist uendret gjennom utånding. I en menneskelig studie ble 16,4 til 41,6% av beholdt benzen eliminert gjennom lungene innen fem til syv timer etter to til tre timers eksponering for 47 til 110 ppm, og bare 0,07 til 0,2% av gjenværende benzen ble utskilt uendret i urin. Etter eksponering for 63 til 405 mg/m3 benzen i 1 til 5 timer, ble 51 til 87% utskilt i urinen som fenol over en periode på 23 til 50 timer. I en annen studie på mennesker ble 30% av absorbert dermalt påført benzen, som hovedsakelig metaboliseres i leveren, utskilt som fenol i urinen.
Eksponering fra brus
Under spesifikke forhold og i nærvær av andre kjemikalier kan benzosyre (et konserveringsmiddel) og askorbinsyre (vitamin C) samhandle for å produsere benzen. I mars 2006 gjennomførte det offisielle Food Standards Agency i Storbritannia en undersøkelse blant 150 merker med brus. Den fant ut at fire inneholdt benzenivåer over Verdens helseorganisasjons grenser. De berørte partiene ble fjernet fra salg. Lignende problemer ble rapportert av FDA i USA.
Forurensning av vannforsyning
I 2005 ble vannforsyningen til byen Harbin i Kina med en befolkning på nesten ni millioner mennesker stanset på grunn av en stor benzeneksponering. Benzen lekker ut i Songhua -elven , som leverer drikkevann til byen, etter en eksplosjon ved en China National Petroleum Corporation (CNPC) fabrikk i byen Jilin 13. november 2005.
Når plastvannledninger utsettes for høy varme, kan vannet være forurenset med benzen.
Mord
De Nazistene anvendte benzen administrert via injeksjon i en av sine mange metoder for avliving .
Se også
- Seksleddede aromatiske ringer med ett karbon erstattet av en annen gruppe: borabensen , benzen , silabensen , germabensen , stannabensen , pyridin , fosfor , arsabensen , pyryliumsalt
- BTEX
- Industrial Union Department v. American Petroleum Institute
Forklarende notater
Referanser
Eksterne linker
| Scholia har en kjemisk profil for benzen . |
- Benzen ved The Periodic Table of Videos (University of Nottingham)
- Internasjonalt kjemisk sikkerhetskort 0015
- USEPA Sammendrag av benstoksisitet
- NIOSH Pocket Guide to Chemical Hazards
- Benzen fra PubChem
- Institutt for helse og menneskelige tjenester: TR-289: Toxicology and Carcinogenesis Studies of Benzen
- Videopodcast av Sir John Cadogan som holdt et foredrag om benzen siden Faraday, i 1991
- Stoffprofil
- Benzen i ChemIDplus -databasen
- NLM farlige stoffer Databank - benzen