Bufferløsning - Buffer solution
En bufferløsning (mer presist, pH -buffer eller hydrogenionbuffer ) er en vandig løsning som består av en blanding av en svak syre og dens konjugerte base , eller omvendt. Dens pH endres veldig lite når det tilsettes en liten mengde sterk syre eller base . Bufferløsninger brukes som et middel for å holde pH på en nesten konstant verdi i en rekke kjemiske applikasjoner. I naturen er det mange systemer som bruker buffering for pH -regulering. For eksempel brukes bikarbonatbuffersystemet til å regulere blodets pH , og bikarbonat fungerer også som en buffer i havet .
Prinsipper for buffering

Bufferløsninger motstår pH -endring på grunn av en likevekt mellom den svake syren HA og dens konjugerte base A - :
- HA ⇌ H + + A -
Når en sterk syre tilsettes en likevektsblanding av den svake syren og dens konjugerte base , tilsettes hydrogenioner (H + ), og likevekten forskyves til venstre, i samsvar med Le Châteliers prinsipp . På grunn av dette øker hydrogenionkonsentrasjonen med mindre enn forventet mengde for tilsatt sterk syre. På samme måte, hvis sterk alkali tilsettes blandingen, reduseres hydrogenionkonsentrasjonen med mindre enn forventet mengde for mengden alkali som tilsettes. Effekten er illustrert ved den simulerte titrering av en svak syre med p K en = 4,7. Den relative konsentrasjonen av ikke -dissosiert syre er vist i blått, og den konjugerte basen er rød. PH endres relativt sakte i bufferområdet, pH = p K a ± 1, sentrert ved pH = 4,7, hvor [HA] = [A - ]. Hydrogenionkonsentrasjonen reduseres med mindre enn forventet mengde fordi det meste av det tilsatte hydroksydionen forbrukes i reaksjonen
- OH - + HA → H 2 O + A -
og bare litt forbrukes i nøytraliseringsreaksjonen (som er reaksjonen som resulterer i en økning i pH)
- OH - + H + → H 2 O.
Når syren er mer enn 95% deprotonert , stiger pH raskt fordi det meste av den tilsatte alkalien forbrukes i nøytraliseringsreaksjonen.
Bufferkapasitet
Bufferkapasitet er et kvantitativt mål på motstanden mot endring av pH i en løsning som inneholder et buffermiddel med hensyn til en endring av syre- eller alkalikonsentrasjon. Det kan defineres som følger:
hvor er en uendelig mengde tilsatt base, eller
hvor er en uendelig liten mengde tilsatt syre. pH er definert som −log 10 [H + ], og d (pH) er en uendelig liten endring i pH.
Med begge definisjoner kan bufferkapasiteten for en svak syre HA med dissosiasjonskonstant K a uttrykkes som
hvor [H + ] er konsentrasjonen av hydrogenioner, og er den totale konsentrasjonen av tilsatt syre. K w er likevektskonstanten for selvionisering av vann , lik 1,0 × 10 −14 . Vær oppmerksom på at i løsning H + eksisterer som hydroniumionet H 3 O + , og ytterligere vann av hydroniumionen har ubetydelig effekt på dissosiasjonens likevekt, bortsett fra ved meget høy syrekonsentrasjon.
Denne ligningen viser at det er tre regioner med forhøyet bufferkapasitet (se figur).
- I den sentrale delen av kurven (farget grønt på plottet) er det andre uttrykket dominerende, og Bufferkapasiteten stiger til et lokalt maksimum ved pH = pK a . Høyden på denne toppen avhenger av verdien av pK a . Bufferkapasiteten er ubetydelig når konsentrasjonen [HA] av buffermidlet er svært liten og øker med økende konsentrasjon av buffermidlet. Noen forfattere viser bare denne regionen i grafer over bufferkapasitet.Bufferkapasiteten faller til 33% av maksimalverdien ved pH = p K a ± 1, til 10% ved pH = p K a ± 1,5 og til 1% ved pH = p K a ± 2. Av denne grunn er det mest nyttige området er omtrent p K a ± 1. Når du velger en buffer for bruk ved en bestemt pH, bør den ha ap K en verdi så nær som mulig den pH -verdien.
- Med sterkt sure løsninger, pH mindre enn ca 2 (rødt på plottet), dominerer det første uttrykket i ligningen, og bufferkapasiteten stiger eksponentielt med synkende pH: Dette skyldes at andre og tredje uttrykk blir ubetydelige ved svært lav pH. Dette uttrykket er uavhengig av tilstedeværelse eller fravær av et buffermiddel.
- Med sterkt alkaliske løsninger, pH mer enn omtrent 12 (farget blått på plottet), dominerer det tredje uttrykket i ligningen, og bufferkapasiteten stiger eksponentielt med økende pH: Dette skyldes det faktum at det første og andre uttrykket blir ubetydelig ved svært høy pH. Dette uttrykket er også uavhengig av tilstedeværelse eller fravær av et buffermiddel.
Søknader av buffere
PH -verdien til en løsning som inneholder et buffermiddel kan bare variere innenfor et smalt område, uavhengig av hva annet som kan være tilstede i løsningen. I biologiske systemer er dette en vesentlig betingelse for at enzymer skal fungere korrekt. For eksempel er en blanding av karbonsyre i humant blod (H
2CO
3) og bikarbonat (HCO-
3) er tilstede i plasmafraktjonen ; dette utgjør den viktigste mekanismen for å opprettholde blodets pH mellom 7,35 og 7,45. Utenfor dette smale området (7,40 ± 0,05 pH -enhet) utvikler acidose og alkalose metabolske tilstander raskt, og til slutt fører det til døden hvis den riktige bufferkapasiteten ikke raskt gjenopprettes.
Hvis pH -verdien til en løsning stiger eller faller for mye, reduseres effektiviteten til et enzym i en prosess, kjent som denaturering , som vanligvis er irreversibel. Flertallet av biologiske prøver som brukes i forskning, oppbevares i en bufferløsning, ofte fosfatbufret saltvann (PBS) ved pH 7,4.
I industrien brukes buffermidler i gjæringsprosesser og for å sette de riktige betingelsene for fargestoffer som brukes i fargestoffer. De brukes også i kjemisk analyse og kalibrering av pH -målere .
Enkle buffermidler
Buffering agent p K a Nyttig pH -område Sitronsyre 3.13, 4.76, 6.40 2.1–7.4 Eddiksyre 4.8 3,8–5,8 KH 2 PO 4 7.2 6.2–8.2 CHES 9.3 8.3–10.3 Borat 9.24 8,25–10,25
For buffere i sure regioner kan pH justeres til en ønsket verdi ved å tilsette en sterk syre som saltsyre til det bestemte buffermidlet. For alkaliske buffere kan en sterk base som natriumhydroksid tilsettes. Alternativt kan en bufferblanding lages av en blanding av en syre og dens konjugerte base. For eksempel kan en acetatbuffer lages av en blanding av eddiksyre og natriumacetat . På samme måte kan en alkalisk buffer lages av en blanding av basen og dens konjugerte syre.
"Universelle" bufferblandinger
Ved å kombinere stoffer med p K a -verdier avviker fra hverandre med bare to eller mindre, og justering av pH-verdien, kan det oppnås et bredt spekter av buffere. Sitronsyre er en nyttig komponent i en bufferblanding fordi den har tre p K a -verdier, atskilt med mindre enn to. Bufferområdet kan utvides ved å legge til andre buffermidler. Følgende blandinger ( McIlvaines bufferløsninger ) har et bufferområde på pH 3 til 8.
0,2 M Na 2 HPO 4 (ml) 0,1 M sitronsyre (ml) pH 20.55 79,45 3.0 38,55 61.45 4.0 51,50 48,50 5.0 63.15 36,85 6.0 82,35 17.65 7,0 97,25 2,75 8.0
En blanding som inneholder sitronsyre , monokaliumfosfat , borsyre og dietylbarbitursyre kan lages for å dekke pH -området 2,6 til 12.
Andre universelle buffere er Carmody -bufferen og Britton - Robinson -bufferen , utviklet i 1931.
Vanlige bufferforbindelser som brukes i biologi
For effektiv rekkevidde, se bufferkapasitet ovenfor.
| Felles navn (kjemisk navn) | Struktur |
p K a , 25 ° C |
Temp. effekt, dpH/d T(K −1 ) |
Mol. vekt |
|---|---|---|---|---|
|
TAPS , ([tris (hydroksymetyl) metylamino] propansulfonsyre) |
 |
8,43 | −0,018 | 243,3 |
|
Bicin , (2- (bis (2-hydroksyetyl) amino) eddiksyre) |
 |
8,35 | −0,018 | 163.2 |
|
Tris , (tris (hydroksymetyl) aminometan, eller 2-amino-2- (hydroksymetyl) propan-1,3-diol) |
 |
8,07 | −0,028 | 121,14 |
|
Tricine , (N- [tris (hydroxymethyl) methyl] glycin) |
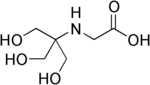 |
8,05 | −0,021 | 179.2 |
|
TAPSO , (3- [N-tris (hydroksymetyl) metylamino] -2-hydroksypropansulfonsyre) |
 |
7,635 | 259,3 | |
|
HEPES , (4- (2-hydroksyetyl) -1-piperazineetansulfonsyre) |
 |
7,48 | −0,014 | 238,3 |
|
TES , (2-[[1,3-dihydroksy-2- (hydroksymetyl) propan-2-yl] amino] etansulfonsyre) |
 |
7,40 | −0,020 | 229,20 |
|
MOPS , (3- (N-morfolino) propansulfonsyre) |
 |
7.20 | −0,015 | 209,3 |
|
RØR , (piperazin-N, N′-bis (2-etansulfonsyre)) |
 |
6,76 | -0,008 | 302.4 |
|
Kakodylat , (dimetylarsensyre) |
 |
6,27 | 138,0 | |
|
MES , (2- (N-morfolino) etansulfonsyre) |
 |
6.15 | −0,011 | 195,2 |
Beregning av buffer -pH
Monoprotiske syrer
Skriv først ned likevektsuttrykket
- HA ⇌ A - + H +
Dette viser at når syren dissosierer, produseres like store mengder hydrogenion og anion. Likevektskonsentrasjonene til disse tre komponentene kan beregnes i en ICE -tabell (ICE står for "initial, change, equilibrium").
ICE -bord for en monoprotinsyre [HA] [A - ] [H + ] Jeg C 0 0 y C - x x x E C 0 - x x x + y
Den første raden, merket I , lister startbetingelsene: konsentrasjonen av syre er C 0 , i første omgang dissosierte, slik at konsentrasjonene av A - og H + ville være null; y er den første konsentrasjonen av tilsatt sterk syre, for eksempel saltsyre. Hvis sterk alkali, for eksempel natriumhydroksid, tilsettes, vil y ha et negativt tegn fordi alkali fjerner hydrogenioner fra løsningen. Den andre raden, merket C for "endring", angir endringene som skjer når syren dissosierer. Syrekonsentrasjonen synker med en mengde - x , og konsentrasjonene av A - og H + øker begge med en mengde + x . Dette følger av likevektsuttrykket. Den tredje raden, merket E for "likevekt", legger sammen de to første radene og viser konsentrasjonene ved likevekt.
For å finne x , bruk formelen for likevektskonstanten når det gjelder konsentrasjoner:
Erstatt konsentrasjonene med verdiene som finnes i den siste raden i ICE -tabellen:
Forenkle til
Med spesifikke verdier for C 0 , K a og y kan denne ligningen løses for x . Forutsatt at pH = −log 10 [H + ], kan pH beregnes som pH = −log 10 ( x + y ).
Polyprotiske syrer

Polyprotiske syrer er syrer som kan miste mer enn ett proton. Konstanten for dissosiasjon av det første protonet kan betegnes som K a1 , og konstantene for dissosiasjon av påfølgende protoner som K a2 , etc. Sitronsyre er et eksempel på en polyprotinsyre H 3 A, ettersom den kan miste tre protoner.
Trinnvis dissosiasjonskonstanter Likevekt Sitronsyre H 3 A ⇌ H 2 A - + H + p K a1 = 3,13 H 2 A - ⇌ HA 2− + H + p K a2 = 4,76 HA 2− ⇌ A 3− + H + p K a3 = 6,40
Når forskjellen mellom suksessive p K a -verdier er mindre enn omtrent 3, er det overlapping mellom pH -verdien for eksistensen til arten i likevekt. Jo mindre forskjell, jo mer overlapping. Når det gjelder sitronsyre, er overlappingen omfattende og løsninger av sitronsyre bufres over hele området 2,5 til 7,5.
Beregning av pH med en polyprotinsyre krever en spesiasjonsberegning . Når det gjelder sitronsyre, innebærer dette løsningen av de to ligningene for massebalanse:
C A er den analytiske konsentrasjonen av syren, C H er den analytiske konsentrasjonen av tilsatte hydrogenioner, β q er de kumulative assosiasjonskonstantene . K w er konstant for selv-ionisering av vann . Det er to ikke-lineære samtidige ligninger i to ukjente størrelser [A 3− ] og [H + ]. Mange dataprogrammer er tilgjengelige for å gjøre denne beregningen. Spesifikasjonsdiagrammet for sitronsyre ble produsert med programmet HySS.
NB Nummereringen av kumulative, generelle konstanter er motsatt av nummereringen av de trinnvise dissosiasjonskonstantene.
- Forholdet mellom kumulative assosiasjonskonstant (β) verdier
og trinnvise dissosiasjonskonstant (K) verdier for en tribasinsyre.
Likevekt Forhold A 3− + H + ⇌ AH 2+ Logg β 1 = pk a3 A 3− + 2H + ⇌ AH 2 + Logg β 2 = pk a2 + pk a3 A 3− + 3H + ⇌ AH 3 Logg β 3 = pk a1 + pk a2 + pk a3
Kumulative assosiasjonskonstanter brukes i dataprogrammer for generelle formål, for eksempel den som ble brukt for å skaffe spesiasjonsdiagrammet ovenfor.
Se også
- Henderson - Hasselbalch ligning
- Buffering agent
- Goods buffere
- Common-ion effekt
- Metallionbuffer
- Mineral redoksbuffer
Referanser
Eksterne linker
"Biologiske buffere" . REACH -enheter.





![{\ displaystyle \ beta = 2.303 \ left ([{\ ce {H+}}]+{\ frac {T _ {{\ ce {HA}}} K_ {a} [{\ ce {H+}}]}} {( K_ {a}+[{\ ce {H+}}])^{2}}}+{\ frac {K _ {\ text {w}}} {[{\ ce {H+}}]}}} \ høyre) ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf8b7c2c34d12f8145df3299a061593aaa76643a)


![{\ displaystyle \ beta \ approx 2.303 {\ frac {T _ {{\ ce {HA}}} K_ {a} [{\ ce {H+}}]} {(K_ {a}+[{\ ce {H+} }])^{2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec0e3ba9d065bfb822350b58e375d1f4630c6235)


![{\ displaystyle K _ {\ text {a}} = {\ frac {[{\ ce {H+}}] [{\ ce {A-}}]} {[{\ ce {HA}}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89cb17f8ab679cc14a5d23888ed230c1a71b7384)


![{\ displaystyle {\ begin {align} C _ {{\ ce {A}}} & = [{\ ce {A^3-}}]+\ beta _ {1} [{\ ce {A^3-} }] [{\ ce {H+}}]+\ beta _ {2} [{\ ce {A^3-}}] [{\ ce {H+}}]^{2}+\ beta _ {3} [{\ ce {A^3-}}] [{\ ce {H+}}]^{3}, \\ C _ {{\ ce {H}}} & = [{\ ce {H+}}]+ \ beta _ {1} [{\ ce {A^3-}}] [{\ ce {H+}}]+2 \ beta _ {2} [{\ ce {A^3-}}] [{\ ce {H+}}]^{2} +3 \ beta _ {3} [{\ ce {A^3-}}] [{\ ce {H+}}]^{3} -K _ {\ text {w }} [{\ ce {H+}}]^{-1}. \ ende {justert}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/611bf20542dfc1dbd8256ee6465883f1534f527a)