Cellevekst - Cell growth
| Del av en serie om |
| Biologi |
|---|
|
|
Cellevekst refererer til en økning i den totale massen til en celle , inkludert både cytoplasmatisk , kjernefysisk og organell volum. Cellevekst oppstår når den totale frekvensen av cellulær biosyntese (produksjon av biomolekyler eller anabolisme) er større enn den totale nedbrytningshastigheten (ødeleggelse av biomolekyler via proteasomet , lysosomet eller autofagien eller katabolismen).
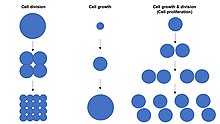
Cellevekst skal ikke forveksles med celledeling eller cellesyklus , som er forskjellige prosesser som kan oppstå ved siden av cellevekst under celleproliferasjonsprosessen , hvor en celle, kjent som "morscellen", vokser og deler seg for å produsere to " datterceller ". Viktigere er at cellevekst og celledeling også kan skje uavhengig av hverandre. I løpet av tidlig embryonisk utvikling ( spalting av den zygote for å danne en morula og blastoderm ), celledelinger forekommer gjentatte ganger uten cellevekst. Omvendt kan noen celler vokse uten celledeling eller uten noen progresjon av cellesyklusen , for eksempel vekst av nevroner under aksonal banefinding i nervesystemets utvikling.
I flercellede organismer skjer vevsvekst sjelden utelukkende gjennom cellevekst uten celledeling , men skjer oftest gjennom celleproliferasjon . Dette er fordi en enkelt celle med bare én kopi av genomet i cellekjernen kan utføre biosyntese og dermed gjennomgå cellevekst med bare halvparten av to cellers hastighet. Derfor vokser to celler (akkumulerer masse) med det dobbelte av en enkelt celle, og fire celler vokser med 4 ganger hastigheten til en enkelt celle. Dette prinsippet fører til en eksponentiell økning av vevsveksthastighet (masseakkumulering) under celleproliferasjon, på grunn av den eksponentielle økningen i celletall.
Cellestørrelse avhenger av både cellevekst og celledeling , med en uforholdsmessig økning i celleveksthastigheten som fører til produksjon av større celler og en uforholdsmessig økning i celledelingshastigheten som fører til produksjon av mange mindre celler. Celleproliferasjon involverer vanligvis balansert cellevekst og celledelingshastigheter som opprettholder en omtrent konstant cellestørrelse i den eksponensielt prolifererende populasjonen av celler.
Noen spesielle celler kan vokse til veldig store størrelser via en uvanlig " endoreplication " cellesyklus der genomet replikeres under S-fase, men det er ingen påfølgende mitose ( M-fase ) eller celledeling ( cytokinesis ). Disse store endorepliserende cellene har mange kopier av genomet , så de er svært polyploide .
Oocytter kan være uvanlig store celler i arter der embryonisk utvikling foregår vekk fra mors kropp i et egg som legges eksternt. Den store størrelsen på noen egg kan oppnås enten ved å pumpe inn cytosoliske komponenter fra tilstøtende celler gjennom cytoplasmiske broer kalt ringkanaler ( Drosophila ) eller ved internalisering av næringsstofflagringskorn (eggeplommegranulat) ved endocytose ( frosker ).
Mekanismer for cellevekstkontroll
Celler kan vokse ved å øke den totale frekvensen av cellulær biosyntese slik at produksjon av biomolekyler overstiger den totale graden av cellulær nedbrytning av biomolekyler via proteasomet , lysosomet eller autofagien .
Biosyntese av biomolekyler initieres ved ekspresjon av gener som koder for RNA og/eller proteiner , inkludert enzymer som katalyserer syntese av lipider og karbohydrater .
Individuelle gener uttrykkes generelt via transkripsjon til messenger-RNA (mRNA) og translasjon til proteiner , og uttrykket av hvert gen skjer på forskjellige forskjellige nivåer på en celletypespesifikk måte (som svar på genregulerende nettverk ).
For å drive cellevekst kan den globale genuttrykkshastigheten økes ved å øke den totale transkripsjonshastigheten med RNA -polymerase II (for aktive gener) eller den totale frekvensen av mRNA -oversettelse til protein ved å øke overflod av ribosomer og tRNA , hvis biogenese avhenger av RNA -polymerase I og RNA -polymerase III . Den Myc -transkripsjonsfaktor er et eksempel på et regulatorisk protein som kan indusere den totale aktiviteten til RNA-polymerase I , RNA polymerase II og RNA-polymerase III for å drive global transkripsjon og oversettelse og derved cellevekst.
I tillegg ble aktiviteten til de enkelte ribosomer kan økes for å øke den totale effektivitet av mRNA oversettelse via regulering av translasjonen initiering faktorer, herunder den 'translasjons-forlengelses initieringsfaktor 4E' ( eIF4E ) kompleks, som binder seg til og kapsler den 5' ende av mRNA . Proteinet TOR , en del av TORC1 -komplekset, er en viktig oppstrøms regulator for translasjonsinitiering så vel som ribosombiogenese . TOR er en serin / treonin -kinase som kan direkte å fosforylere og inaktivering av en generell inhibitor av eIF4E , kalt 4E-bindende protein (4E-BP) , for å fremme translasjonseffektiviteten. TOR fosforylerer og aktiverer også det ribosomale proteinet S6-kinase ( S6K ), som fremmer ribosombiogenese .
For å hemme cellevekst kan den globale genuttrykkshastigheten reduseres, eller den globale biomolekylære nedbrytningshastigheten kan økes ved å øke frekvensen av autofagi . TOR hemmer normalt funksjonen til autofagi -induserende kinase Atg1/ULK1 . Dermed reduserer TOR -aktivitet både den globale oversettelseshastigheten og øker omfanget av autofagi for å redusere cellevekst.
Cellevekstregulering hos dyr
Mange av de signalmolekyler som kontrollen av cellevekst er kalt vekstfaktorer , hvorav mange induserer signaltransduksjon via PI3K / AKT / mTOR reaksjonsvei , som omfatter en oppad lipidkinaseaktivitet PI3K og den nedstrøms serin / treonin protein kinase Akt , som er i stand til å aktivere en annen proteinkinase TOR , som fremmer translasjon og hemmer autofagi for å drive cellevekst.
Næringsstofftilgjengelighet påvirker produksjonen av vekstfaktorer i Insulin / IGF-1- familien, som sirkulerer som hormoner hos dyr for å aktivere PI3K/AKT/mTOR-banen i celler for å fremme TOR- aktivitet, slik at når dyr blir matet, vokser de raskt og når de er ikke i stand til å motta nok næringsstoffer, de vil redusere veksthastigheten.
I tillegg fremmer tilgjengeligheten av aminosyrer til individuelle celler også direkte TOR- aktivitet, selv om denne reguleringsmåten er viktigere i encellede organismer enn i flercellede organismer som dyr som alltid opprettholder en overflod av aminosyrer i sirkulasjon.
En omstridt teori foreslår at mange forskjellige pattedyrceller gjennomgår størrelsesavhengige overganger i løpet av cellesyklusen. Disse overgangene styres av den syklinavhengige kinasen Cdk1. Selv om proteinene som kontrollerer Cdk1 er godt forstått, forblir forbindelsen til mekanismer som overvåker cellestørrelse unnvikende.
En postulert modell for pattedyrstørrelseskontroll plasserer masse som drivkraften i cellesyklusen. En celle er ikke i stand til å vokse til en unormalt stor størrelse fordi ved en bestemt cellestørrelse eller cellemasse starter S -fasen. S -fasen starter hendelsesforløpet som fører til mitose og cytokinesis. En celle klarer ikke å bli for liten fordi de senere cellesyklushendelsene, som S, G2 og M, blir forsinket til massen øker tilstrekkelig til å begynne S -fasen.
Cellepopulasjoner
Cellepopulasjoner gjennomgår en bestemt type eksponentiell vekst som kalles dobling eller celleproliferasjon . Dermed bør hver generasjon av celler være dobbelt så mange som den forrige generasjonen. Imidlertid gir antall generasjoner bare et maksimumstall da ikke alle celler overlever i hver generasjon. Celler kan reprodusere seg på scenen av Mitosis, hvor de dobler og deler seg i to genetisk like celler.
Cellestørrelse
Cellestørrelse er svært variabel blant organismer, og noen alger som Caulerpa taxifolia er en enkelt celle som er flere meter lang. Planteceller er mye større enn dyreceller, og protister som Paramecium kan være 330 μm lange, mens en typisk menneskelig celle kan være 10 μm. Hvordan disse cellene "bestemmer" hvor store de skal være før de deler seg, er et åpent spørsmål. Kjemiske gradienter er kjent for å være delvis ansvarlige, og det antas at mekanisk spenningsdeteksjon av cytoskjelettstrukturer er involvert. Arbeid med emnet krever generelt en organisme hvis cellesyklus er godt karakterisert.
Gjærcellestørrelsesregulering
Forholdet mellom cellestørrelse og celledeling har blitt grundig studert i gjær . For noen celler er det en mekanisme der celledeling ikke startes før en celle har nådd en viss størrelse. Hvis næringsstofftilførselen er begrenset (etter tid t = 2 i diagrammet nedenfor), og hastigheten på økning i cellestørrelse reduseres, økes tidsperioden mellom celledelinger. Gjærcellestørrelsesmutanter ble isolert som begynner celledeling før de når en normal/vanlig størrelse ( små mutanter).
Wee1- protein er en tyrosinkinase som normalt fosforylerer Cdc2-cellesyklusreguleringsproteinet (homologen til CDK1 hos mennesker), en syklinavhengig kinase, på en tyrosinrest. Cdc2 driver inngang til mitose ved å fosforylere et bredt spekter av mål. Denne kovalente modifikasjonen av molekylstrukturen til Cdc2 hemmer den enzymatiske aktiviteten til Cdc2 og forhindrer celledeling. Wee1 virker for å holde Cdc2 inaktiv under tidlig G2 når cellene fremdeles er små. Når celler har nådd tilstrekkelig størrelse under G2, fjerner fosfatasen Cdc25 den hemmende fosforyleringen, og aktiverer dermed Cdc2 for å tillate mitotisk inntreden. En balanse mellom Wee1 og Cdc25 aktivitet med endringer i cellestørrelse koordineres av mitotisk inngangskontrollsystem. Det er vist i Wee1 -mutanter, celler med svekket Wee1 -aktivitet, at Cdc2 blir aktiv når cellen er mindre. Dermed oppstår mitose før gjæren når sin normale størrelse. Dette antyder at celledeling delvis kan reguleres ved fortynning av Wee1 -protein i celler etter hvert som de vokser seg større.
Kobler Cdr2 til Wee1
Proteinkinase Cdr2 (som regulerer Wee1 negativt) og Cdr2-relatert kinase Cdr1 (som direkte fosforylerer og hemmer Wee1 in vitro ) er lokalisert til et bånd av kortikale noder i midten av interfaseceller. Etter inngang til mitose rekrutteres cytokinesifaktorer som myosin II til lignende noder; disse nodene kondenserer til slutt til å danne den cytokinetiske ringen. Et tidligere ukarakterisert protein, Blt1 , ble funnet å kolokalisere med Cdr2 i de mediale interfase -nodene. Blt1 knockout -celler hadde økt lengde ved divisjon, noe som er i samsvar med en forsinkelse i mitotisk oppføring. Dette funnet forbinder en fysisk plassering, et bånd av kortikale noder, med faktorer som har vist seg å direkte regulere mitotisk oppføring, nemlig Cdr1, Cdr2 og Blt1.
Ytterligere eksperimentering med GFP -merkede proteiner og mutante proteiner indikerer at de mediale kortikale nodene dannes av den ordnede, Cdr2 -avhengige sammensetningen av flere interagerende proteiner under interfase. Cdr2 er øverst i dette hierarkiet og fungerer oppstrøms for Cdr1 og Blt1. Mitose fremmes av den negative reguleringen av Wee1 av Cdr2. Det har også blitt vist at Cdr2 rekrutterer Wee1 til den mediale kortikale noden. Mekanismen for denne rekrutteringen har ennå ikke blitt oppdaget. En Cdr2 kinasemutant, som er i stand til å lokalisere riktig til tross for tap av funksjon i fosforylering, forstyrrer rekrutteringen av Wee1 til medial cortex og forsinker inngangen til mitose. Dermed lokaliserer Wee1 med sitt hemmende nettverk, som demonstrerer at mitose kontrolleres gjennom Cdr2-avhengig negativ regulering av Wee1 ved mediale kortikale noder.
Cellepolaritetsfaktorer
Cellepolaritetsfaktorer plassert ved cellespissene gir romlige signaler for å begrense Cdr2 -fordelingen til cellemiddelet. I fisjonsgjær Schizosaccharomyces pombe ( S. Pombe ) deler celler seg med en definert, reproduserbar størrelse under mitose på grunn av den regulerte aktiviteten til Cdk1. Cellepolaritet proteinkinase Pom1 , et medlem av dobbelt-spesifisitet tyrosin-fosforyleringsregulert kinase (DYRK) kinase familie, lokaliserer til celleender. I Pom1 knockout -celler var Cdr2 ikke lenger begrenset til cellemiddelet, men ble sett diffust gjennom halvparten av cellen. Fra disse dataene blir det tydelig at Pom1 gir hemmende signaler som begrenser Cdr2 til midten av cellen. Det er videre vist at Pom1-avhengige signaler fører til fosforylering av Cdr2. Pom1 knockout-celler ble også vist å dele seg med en mindre størrelse enn villtype, noe som indikerer en tidlig inngang til mitose.
Pom1 danner polare gradienter som topper i celleender, noe som viser en direkte kobling mellom størrelseskontrollfaktorer og en bestemt fysisk plassering i cellen. Når en celle vokser i størrelse, vokser en gradient i Pom1. Når cellene er små, spres Pom1 diffust gjennom cellekroppen. Når cellen øker i størrelse, reduseres Pom1 -konsentrasjonen i midten og blir konsentrert i celleender. Små celler i tidlig G2 som inneholder tilstrekkelige nivåer av Pom1 i hele cellen har inaktiv Cdr2 og kan ikke gå inn i mitose. Det er ikke før cellene vokser til sent G2, når Pom1 er begrenset til celleendene, at Cdr2 i de mediale kortikale nodene aktiveres og kan starte inhiberingen av Wee1. Dette funnet viser hvordan cellestørrelse spiller en direkte rolle i regulering av starten av mitose. I denne modellen fungerer Pom1 som en molekylær kobling mellom cellevekst og mitotisk inngang gjennom en Cdr2-Cdr1-Wee1-Cdk1-bane. Pom1 -polargradienten videresender informasjon om cellestørrelse og geometri til Cdk1 -reguleringssystemet. Gjennom denne gradienten sikrer cellen at den har nådd en definert, tilstrekkelig størrelse for å gå inn i mitose.
Andre eksperimentelle systemer for studier av cellestørrelsesregulering
En vanlig måte å produsere veldig store celler er ved cellefusjon for å danne syncytia . For eksempel dannes veldig lange (flere tommer) skjelettmuskelceller ved sammensmelting av tusenvis av myocytter . Genetiske studier av fruktfluen Drosophila har avdekket flere gener som er nødvendige for dannelse av flerkjernede muskelceller ved fusjon av myoblaster . Noen av nøkkelproteinene er viktige for celleadhesjon mellom myocytter, og noen er involvert i vedheftsavhengig celle-til-celle signaltransduksjon som muliggjør en kaskade av cellefusjonshendelser.
Økninger i størrelsen på planteceller kompliseres av det faktum at nesten alle planteceller er inne i en solid cellevegg . Under påvirkning av visse plantehormoner kan celleveggen remodelleres, noe som gir mulighet for økning i cellestørrelse som er viktige for veksten av noen plantevev.
De fleste encellede organismer er mikroskopiske i størrelse, men det er noen gigantiske bakterier og protozoer som er synlige for det blotte øye. (Se tabell over cellestørrelser - Tette bestander av en gigantisk svovelbakterie i Namibiske hyllesedimenter - Store protister av slekten Chaos , nært beslektet med slekten Amoeba .)
I de stavformede bakteriene E. coli , styres cellestørrelsen Caulobacter crescentus og B. subtilis av en enkel mekanisme der celledeling oppstår etter at et konstant volum er lagt til siden forrige divisjon. Ved alltid å vokse med samme mengde, konvergerer celler født mindre eller større enn gjennomsnittet naturlig til en gjennomsnittlig størrelse som tilsvarer mengden som ble tilsatt i løpet av hver generasjon.
Celledeling
Celleformering er aseksuell . For de fleste bestanddelene i cellen er vekst en jevn, kontinuerlig prosess, bare kort avbrutt ved M -fasen når kjernen og deretter cellen deler seg i to.
Prosessen med celledeling, kalt cellesyklus , har fire hoveddeler som kalles faser. Den første delen, kalt G 1 -fase, er preget av syntese av forskjellige enzymer som er nødvendige for DNA -replikasjon. Den andre delen av cellesyklusen er S -fasen , hvor DNA -replikasjon produserer to identiske sett med kromosomer . Den tredje delen er G 2 -fasen der en signifikant proteinsyntese forekommer, hovedsakelig med produksjon av mikrotubuli som kreves under delingsprosessen, kalt mitose . Den fjerde fasen, M -fase , består av nukleær divisjon ( karyokinesis ) og cytoplasmatisk divisjon ( cytokinesis ), ledsaget av dannelsen av en ny cellemembran . Dette er den fysiske inndelingen av "mor" og "datter" celler. M -fasen er delt inn i flere forskjellige faser, sekvensielt kjent som profase , prometafase , metafase , anafase og telofase som fører til cytokinesis.
Celledeling er mer kompleks i eukaryoter enn i andre organismer. Prokaryote celler som bakterieceller reproduserer ved binær fisjon , en prosess som inkluderer DNA -replikasjon, kromosomsegregering og cytokinesis. Eukaryot celledeling innebærer enten mitose eller en mer kompleks prosess som kalles meiose . Mitose og meiose kalles noen ganger de to " atomdivisjon " -prosessene. Binær fisjon ligner reproduksjon av eukaryote celler som involverer mitose. Begge fører til produksjon av to datterceller med samme antall kromosomer som foreldrecellen. Meiose brukes til en spesiell celle -reproduksjonsprosess av diploide organismer. Den produserer fire spesielle datterceller ( gameter ) som har halvparten av den normale cellulære mengden DNA. En hann og en hunn gamette kan deretter kombinere for å produsere en zygote , en celle som igjen har den normale mengden kromosomer.
Resten av denne artikkelen er en sammenligning av hovedtrekkene til de tre cellene som reproduseres som enten involverer binær fisjon, mitose eller meiose. Diagrammet nedenfor viser likhetene og forskjellene mellom disse tre cellene.
Sammenligning av de tre celledelingstypene
DNA -innholdet i en celle dupliseres i begynnelsen av cellens reproduksjonsprosess. Før DNA -replikasjon kan DNA -innholdet i en celle representeres som mengden Z (cellen har Z -kromosomer). Etter DNA -replikasjonsprosessen er mengden DNA i cellen 2Z (multiplikasjon: 2 x Z = 2Z). Under binær fisjon og mitose blir det dupliserte DNA -innholdet i den reproduserende foreldresellen separert i to like halvdeler som er bestemt til å ende opp i de to dattercellene. Den siste delen av celleproduseringsprosessen er celledeling , når datterceller fysisk deler seg fra en foreldrecelle. Under meiose er det to celledelingstrinn som sammen produserer de fire dattercellene.
Etter fullført binær fisjon eller cellegjengivelse som involverer mitose, har hver dattercelle samme mengde DNA ( Z ) som foreldrekellen hadde før den replikerte sitt DNA. Disse to cellene reproduserte to datterceller som har samme antall kromosomer som foreldrecellen. Kromosomer dupliseres før celledeling når nye hudceller dannes for reproduksjon. Etter reproduksjon av meiotiske celler har de fire dattercellene halvparten av antallet kromosomer som foreldrecellen opprinnelig hadde. Dette er den haploide mengde DNA, ofte symbolisert som N . Meiose brukes av diploide organismer til å produsere haploide kjønnsceller. I en diploid organisme som den menneskelige organismen har de fleste cellene i kroppen den diploide mengden DNA, 2N . Ved å bruke denne notasjonen for å telle kromosomer sier vi at menneskelige somatiske celler har 46 kromosomer (2N = 46) mens menneskelige sæd og egg har 23 kromosomer (N = 23). Mennesker har 23 forskjellige kromosomtyper, de 22 autosomene og den spesielle kategorien sexkromosomer . Det er to forskjellige kjønnskromosomer, X -kromosomet og Y -kromosomet. En diploid menneskelig celle har 23 kromosomer fra personens far og 23 fra moren. Det vil si at kroppen din har to kopier av menneskelig kromosom nummer 2, en fra hver av foreldrene dine.
Umiddelbart etter DNA -replikasjon vil en menneskelig celle ha 46 "doble kromosomer". I hvert dobbeltkromosom er det to kopier av kromosomets DNA -molekyl. Under mitose deles de doble kromosomene for å produsere 92 "enkle kromosomer", hvorav halvparten går inn i hver dattercelle. Under meiose er det to trinn for kromosomseparasjon som sikrer at hver av de fire dattercellene får en kopi av hver av de 23 kromosomtypene.
Seksuell reproduksjon
Selv om cellegjengivelse som bruker mitose kan reprodusere eukaryote celler, plager eukaryoter med den mer kompliserte meiosprosessen fordi seksuell reproduksjon som meiose gir en selektiv fordel . Legg merke til at når meiosen starter, ligger de to kopiene av søsterkromatidene nummer 2 ved siden av hverandre. I løpet av denne tiden kan det være genetiske rekombinasjonshendelser . Informasjon fra kromosom 2 -DNA fra den ene forelderen (rød) vil overføres til kromosom 2 -DNA -molekylet som ble mottatt fra den andre forelder (grønn). Legg merke til at i mitose virker de to kopiene av kromosom nummer 2 ikke. Rekombinasjon av genetisk informasjon mellom homologe kromosomer under meiose er en prosess for å reparere DNA -skader . Denne prosessen kan også produsere nye kombinasjoner av gener, hvorav noen kan være adaptivt fordelaktige og påvirke utviklingen. Imidlertid kan sex i organismer med mer enn ett sett med kromosomer i livssyklusstadiet gi en fordel fordi det under tilfeldig parring produserer homozygoter og heterozygoter i henhold til Hardy - Weinberg -forholdet .
Lidelser
En rekke vekstforstyrrelser kan forekomme på mobilnivå, og disse underbygger følgelig mye av det påfølgende forløpet innen kreft , der en gruppe celler viser ukontrollert vekst og deling utover de normale grensene, invasjon (inntrengning og ødeleggelse av tilstøtende vev), og noen ganger metastase (spredt til andre steder i kroppen via lymfe eller blod). Flere viktige determinanter for cellevekst, som ploidi og regulering av cellulær metabolisme , blir ofte forstyrret i svulster . Derfor er heterogen cellevekst og pleomorfisme et av de tidligste kjennetegnene for kreftprogresjon . Til tross for forekomsten av pleomorfisme i menneskelig patologi, er dens rolle i sykdomsutviklingen uklar. I epitelvev kan pleomorfisme i cellestørrelse forårsake pakningsdefekter og spre sprikende celler. Men konsekvensen av atypisk cellevekst i andre dyrevev er ukjent.
Målemetoder
Celleveksten kan påvises ved en rekke metoder. Den cellestørrelsesveksten kan visualiseres ved mikroskopi , ved hjelp av egnede flekker. Men økningen i celletallet er vanligvis mer signifikant. Det kan måles ved manuell telling av celler under mikroskopiobservasjon, ved hjelp av fargestoffekskluderingsmetoden (dvs. trypanblått ) for å telle bare levedyktige celler. Mindre krevende, skalerbare metoder inkluderer bruk av cytometre , mens flytcytometri tillater kombinasjon av celletall ('hendelser') med andre spesifikke parametere: fluorescerende sonder for membraner, cytoplasma eller kjerner gjør det mulig å skille mellom døde/levedyktige celler, celletyper, celledifferensiering, uttrykk for en biomarkør som Ki67 .
Ved siden av å øke antall celler, kan man bli vurdert angående den metabolske aktivitet vekst , det vil si den cfda og calcein -AM mål (fluorimetrisk) ikke bare membranen funksjonalitet (fargestoff retensjon), men også funksjonaliteten av cytoplasmiske enzymer (esteraser) . De MTT-analyser (kolorimetrisk) og resazurin analysen (fluorimetrisk) dose mitokondrie redokspotensialet.
Alle disse analysene kan korrelere godt eller ikke, avhengig av cellevekstbetingelser og ønskede aspekter (aktivitet, spredning). Oppgaven er enda mer komplisert med populasjoner av forskjellige celler, videre når man kombinerer interferens av cellevekst eller toksisitet .
Se også
Referanser
Bøker
- Morgan, David O. (2007). Cellesyklusen: kontrollprinsipper . London: Sunderland, Mass. ISBN 978-0-9539181-2-6.
Eksterne linker
- En sammenligning av generasjons- og eksponentielle modeller for cellepopulasjonsvekst
- Lokal vekst i et array av disker Wolfram demonstrasjonsprosjekt