Livmorhalskreft - Cervical cancer
| Livmorhalskreft | |
|---|---|
 | |
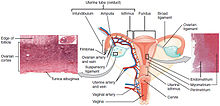
| Plassering av livmorhalskreft og et eksempel på normale og unormale celler | |
| Uttale | |
| Spesialitet | Onkologi |
| Symptomer |
Tidlig : ingen Senere : vaginal blødning , bekkenpine , smerter under samleie |
| Vanlig start | Over 10 til 20 år |
| Typer | Plateepitelkarsinom , adenokarsinom , andre |
| Årsaker | Human papillomavirusinfeksjon (HPV) |
| Risikofaktorer | Røyking , svakt immunsystem , p -piller , begynnende sex i ung alder, mange seksuelle partnere eller en partner med mange seksuelle partnere |
| Diagnostisk metode | Cervikal screening etterfulgt av en biopsi |
| Forebygging | Regelmessig cervikal screening, HPV -vaksiner , samleie med kondomer , seksuell avholdenhet |
| Behandling | Kirurgi , cellegift , strålebehandling , immunterapi |
| Prognose |
Fem års overlevelse : 68% (USA) 46% ( India ) |
| Frekvens | 604,127 nye saker (2020) |
| Dødsfall | 341 831 (2020) |
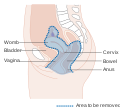
Livmorhalskreft er en kreft som oppstår fra livmorhalsen . Det skyldes den unormale veksten av celler som har evnen til å invadere eller spre seg til andre deler av kroppen. Tidlig sett blir vanligvis ingen symptomer sett. Senere symptomer kan omfatte unormal vaginal blødning , bekkenpine eller smerter under samleie . Selv om blødning etter sex ikke er alvorlig, kan det også indikere tilstedeværelse av livmorhalskreft.
Human papillomavirusinfeksjon (HPV) forårsaker mer enn 90% av tilfellene; de fleste som har hatt HPV -infeksjoner, utvikler imidlertid ikke livmorhalskreft. Andre risikofaktorer inkluderer røyking , et svakt immunsystem , p -piller , start sex i ung alder og å ha mange seksuelle partnere, men disse er mindre viktige. Livmorhalskreft utvikler seg vanligvis fra forstadier til kreft i løpet av 10 til 20 år. Omtrent 90% av livmorhalskreft -tilfellene er plateepitelkarsinomer , 10% er adenokarsinom , og et lite antall er andre typer. Diagnosen er vanligvis ved cervikal screening etterfulgt av en biopsi . Medisinsk bildebehandling gjøres deretter for å avgjøre om kreften har spredt seg eller ikke.
HPV-vaksiner beskytter mot to til syv høyrisikostammer av denne virusfamilien og kan forhindre opptil 90% av livmorhalskreft. Siden en risiko for kreft fortsatt eksisterer, anbefaler retningslinjer å fortsette vanlige Pap -tester . Andre metoder for forebygging inkluderer å ha få eller ingen seksuelle partnere og bruk av kondomer . Livmorhalskreftscreening ved bruk av Pap -testen eller eddiksyre kan identifisere forstadier til kreft, som ved behandling kan forhindre utvikling av kreft. Behandlingen kan bestå av en kombinasjon av kirurgi , cellegift og strålebehandling . Fem års overlevelse i USA er 68%. Resultatene avhenger imidlertid veldig av hvor tidlig kreften oppdages.
På verdensbasis er livmorhalskreft både den fjerde vanligste årsaken til kreft og den fjerde vanligste dødsårsaken av kreft hos kvinner. I 2012 skjedde anslagsvis 528 000 tilfeller av livmorhalskreft, med 266 000 dødsfall. Dette er omtrent 8% av de totale tilfellene og de totale dødsfallene av kreft. Omtrent 70% av livmorhalskreft og 90% av dødsfallene skjer i utviklingsland . I lavinntektsland er det en av de vanligste årsakene til kreftdød. I utviklede land har den utbredte bruken av cervical screening -programmer dramatisk redusert frekvensen av livmorhalskreft. I medisinsk forskning ble den mest berømte udødeliggjorte cellelinjen , kjent som HeLa , utviklet fra livmorhalskreftceller fra en kvinne ved navn Henrietta Lacks .
Tegn og symptomer
De tidlige stadiene av livmorhalskreft kan være helt symptomfrie . Vaginal blødning , kontaktblødning (en vanlig form for blødning etter samleie) eller (sjelden) en vaginal masse kan indikere tilstedeværelse av malignitet. Moderat smerte under samleie og vaginal utslipp er også symptomer på livmorhalskreft. Ved avansert sykdom kan metastaser være tilstede i magen , lungene eller andre steder.
Symptomer på avansert livmorhalskreft kan omfatte: tap av matlyst , vekttap, tretthet, bekkenpine, ryggsmerter, beinpine, hovne ben, kraftig vaginal blødning, beinbrudd og (sjelden) lekkasje av urin eller avføring fra skjeden. Blødning etter douching eller etter en bekkenundersøkelse er et vanlig symptom på livmorhalskreft.
Årsaker
Infeksjon med noen typer HPV er den største risikofaktoren for livmorhalskreft, etterfulgt av røyking. HIV -infeksjon er også en risikofaktor. Ikke alle årsakene til livmorhalskreft er imidlertid kjent, og flere andre medvirkende faktorer har vært implisert.
Humant papillomavirus
HPV -typer 16 og 18 er årsaken til 75% av livmorhalskreft -tilfellene globalt, mens 31 og 45 er årsakene til ytterligere 10%.
Kvinner som har sex med menn som har mange andre seksuelle partnere eller kvinner som har mange seksuelle partnere har en større risiko.
Av de 150-200 typer HPV som er kjent, er 15 klassifisert som høyrisikotyper (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 og 82) , tre som sannsynlig høyrisiko (26, 53 og 66) og 12 som lavrisiko (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 og CP6108).
Kjønnsvorter , som er en form for godartet svulst i epitelceller , er også forårsaket av forskjellige stammer av HPV. Imidlertid er disse serotypene vanligvis ikke relatert til livmorhalskreft. Å ha flere stammer samtidig er vanlig, inkludert de som kan forårsake livmorhalskreft sammen med de som forårsaker vorter. Det antas generelt at infeksjon med HPV er nødvendig for at livmorhalskreft skal oppstå.
Røyking
Sigarettrøyking, både aktiv og passiv, øker risikoen for livmorhalskreft. Blant HPV-infiserte kvinner har nåværende og tidligere røykere omtrent to til tre ganger forekomsten av invasiv kreft. Passiv røyking er også forbundet med økt risiko, men i mindre grad.
Røyking har også vært knyttet til utviklingen av livmorhalskreft. Røyking kan øke risikoen hos kvinner på noen forskjellige måter, som kan være ved direkte og indirekte metoder for å indusere livmorhalskreft. En direkte måte å smitte denne kreften på er at en røyker har større sjanse for at cervikal intraepitelial neoplasi (CIN3) oppstår, noe som har potensial til å danne livmorhalskreft. Når CIN3 -lesjoner fører til kreft, har de fleste av dem bistand fra HPV -viruset, men det er ikke alltid tilfelle, og derfor kan det betraktes som en direkte kobling til livmorhalskreft. Tung røyking og langvarig røyking ser ut til å ha større risiko for å få CIN3-lesjonene enn lettere røyking eller ikke røyking i det hele tatt. Selv om røyking har vært knyttet til livmorhalskreft, hjelper det i utviklingen av HPV, som er den viktigste årsaken til denne typen kreft. Det hjelper ikke bare i utviklingen av HPV, men også hvis kvinnen allerede er HPV-positiv, har hun enda større sannsynlighet for å få livmorhalskreft.
Orale prevensjonsmidler
Langvarig bruk av p-piller er forbundet med økt risiko for livmorhalskreft hos kvinner som har hatt HPV. Kvinner som har brukt p -piller i 5 til 9 år har omtrent tre ganger forekomsten av invasiv kreft, og de som har brukt dem i 10 år eller lenger har omtrent fire ganger risikoen.
Flere graviditeter
Å ha mange graviditeter er forbundet med en økt risiko for livmorhalskreft. Blant HPV-infiserte kvinner har de som har hatt syv eller flere graviditeter på fulltid rundt fire ganger risikoen for kreft sammenlignet med kvinner uten graviditet, og to til tre ganger risikoen for kvinner som har hatt en eller to fulltid svangerskap.
Diagnose
Biopsi
Den Pap test kan brukes som en screening test , men frembringer en falsk negativ i opp til 50% av tilfellene av livmorhalskreft. Andre bekymringer er kostnaden for å gjøre Pap -tester, noe som gjør dem uoverkommelige i mange områder av verden.
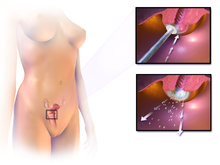
Bekreftelse av diagnosen livmorhalskreft eller forkreft krever en biopsi av livmorhalsen. Dette gjøres ofte gjennom kolposkopi , en forstørret visuell inspeksjon av livmorhalsen ved hjelp av en fortynnet eddiksyre (f.eks. Eddik ) løsning for å markere unormale celler på overflaten av livmorhalsen, med visuell kontrast ved å farge det normale vevet en mahogny brun med Lugols jod. Medisinsk utstyr som brukes til biopsi av livmorhalsen inkluderer slagpincett . Kolposkopisk inntrykk, estimatet av alvorlighetsgraden av sykdommen basert på den visuelle inspeksjonen, er en del av diagnosen. Ytterligere diagnostiske og behandlingsprosedyrer er sløyfe -elektrisk eksisjonsprosedyre og livmorhalskonisering , der livmorhalsens indre foring fjernes for å bli undersøkt patologisk. Disse utføres hvis biopsien bekrefter alvorlig cervikal intraepitelial neoplasi .

Ofte før biopsien ber legen om medisinsk bildebehandling for å utelukke andre årsaker til kvinnens symptomer. Imaging -metoder som ultralyd , CT -skanning og MR har blitt brukt til å lete etter vekslende sykdom, spredning av svulsten og effekt på tilstøtende strukturer. Vanligvis fremstår de som heterogen masse på livmorhalsen.
Intervensjoner som å spille musikk under prosedyren og se prosedyren på en skjerm kan redusere angsten forbundet med undersøkelsen.
Forkreftskader
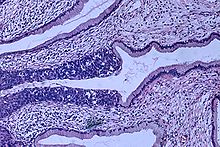
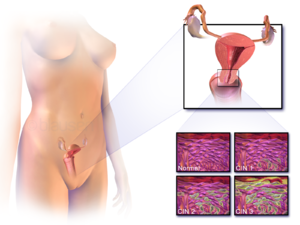
Cervikal intraepitelial neoplasi, den potensielle forløperen til livmorhalskreft, blir ofte diagnostisert ved undersøkelse av livmorhalsbiopsier av en patolog . Ved premaligne dysplastiske endringer brukes gradering av cervikal intraepitelial neoplasi .
Navngivningen og den histologiske klassifiseringen av forstadier til livmorhalsekreft har endret seg mange ganger i løpet av 1900 -tallet. The World Health Organization klassifiseringssystemet var beskrivende for lesjoner, navngi dem mild, moderat eller alvorlig dysplasi eller carcinoma in situ (CIS). Begrepet cervikal intraepitelial neoplasi (CIN) ble utviklet for å legge vekt på spekteret av abnormitet i disse lesjonene, og for å hjelpe til med å standardisere behandlingen. Den klassifiserer mild dysplasi som CIN1, moderat dysplasi som CIN2 og alvorlig dysplasi og CIS som CIN3. Mer nylig har CIN2 og CIN3 blitt kombinert til CIN2/3. Disse resultatene er hva en patolog kan rapportere fra en biopsi.
Disse skal ikke forveksles med Bethesda -systembetingelsene for Pap -test ( cytopatologi ) resultater. Blant Bethesda-resultatene: Lavgradig plateepitel intraepitelial lesjon (LSIL) og høyverdig squamous intraepitelial lesjon (HSIL). En LSIL Pap kan svare til CIN1, og HSIL kan svare til CIN2 og CIN3, men de er resultater av forskjellige tester, og Pap -testresultatene trenger ikke å matche de histologiske funnene.
Kreftundertyper

Histologiske undertyper av invasivt livmorhalskarsinom inkluderer: Selv om plateepitelkarsinom er livmorhalskreft med størst forekomst, har forekomsten av adenokarsinom i livmorhalsen vært økende de siste tiårene. Endocervikal adenokarsinom representerer 20–25% av de histologiske typene av livmorhalskarsinom. Gastric-type mucinøst adenokarsinom i livmorhalsen er en sjelden type kreft med aggressiv oppførsel. Denne typen malignitet er ikke relatert til høyrisiko humant papillomavirus (HPV).
- Plateepitelkarsinom (ca. 80–85%)
- adenokarsinom (ca. 15% av livmorhalskreft i Storbritannia)
- Adenosquamous karsinom
- Småcellet karsinom
- Nevroendokrine svulster
- Glassaktig cellekarsinom
- Villoglandulært adenokarsinom
Ikke -karsinom -maligniteter som sjelden kan forekomme i livmorhalsen inkluderer melanom og lymfom . Den International Federation of gynekologisk (FIGO) trinn tar ikke hensyn til lymfeknute engasjement i motsetning til TNM staging for de fleste andre kreftformer. For tilfeller som behandles kirurgisk, kan informasjon fra patologen brukes til å tilordne et eget patologisk stadium, men skal ikke erstatte det opprinnelige kliniske stadiet.
Iscenesettelse
Livmorhalskreft er iscenesatt av FIGO -systemet, som er basert på klinisk undersøkelse, snarere enn kirurgiske funn. Det gjør at bare disse diagnostiske testene som skal benyttes ved bestemmelse av fasen: palpering, inspeksjon, colposcopy , endocervikal utskrapning , hysteroskopi , cystoscopy , proctoscopy , intravenøs urografi , og røntgenundersøkelse av lungene og skjelett, og cervical conization .
Forebygging
Screening

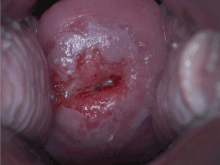
Kontroll av livmorhalsceller med Papanicolaou-testen (Pap-testen) for livmorhalskreft har dramatisk redusert antall tilfeller av og dødelighet fra livmorhalskreft. Væskebasert cytologi kan redusere antall utilstrekkelige prøver. Pap-test screening hvert tredje til femte år med passende oppfølging kan redusere forekomsten av livmorhalskreft med opptil 80%. Unormale resultater kan tyde på tilstedeværelse av forstadier til kreft , noe som muliggjør undersøkelse og mulig forebyggende behandling, kjent som kolposkopi . Behandling av lavgradige lesjoner kan påvirke påfølgende fruktbarhet og graviditet negativt. Personlige invitasjoner som oppfordrer kvinner til å bli vist, er effektive for å øke sannsynligheten for at de vil gjøre det. Utdanningsmateriell bidrar også til å øke sannsynligheten for at kvinner vil gå til screening, men de er ikke like effektive som invitasjoner.
I henhold til de europeiske retningslinjene for 2010 varierer alderen for å starte screening mellom 20 og 30 år, men fortrinnsvis ikke før 25 eller 30 år, og avhenger av sykdomsbyrden i befolkningen og tilgjengelige ressurser.
I USA anbefales screening å begynne ved 21 år, uavhengig av alder da en kvinne begynte å ha sex eller andre risikofaktorer. Pap -tester bør utføres hvert tredje år mellom 21 og 65 år. Hos kvinner over 65 år kan screening avbrytes hvis det ikke ble sett unormale screeningsresultater i løpet av de foregående 10 årene og det ikke finnes noen historie med CIN2 eller høyere. HPV -vaksinasjonsstatus endrer ikke screeningshastigheten.
Det finnes en rekke anbefalte alternativer for screening av de 30 til 65. Dette inkluderer cervikal cytologi hvert tredje år, HPV -testing hvert 5. år eller HPV -testing sammen med cytologi hvert 5. år. Screening er ikke gunstig før 25 år, da sykdomsraten er lav. Screening er ikke gunstig for kvinner eldre enn 60 år hvis de har en historie med negative resultater. The American Society of Clinical Oncology guideline har anbefalt for forskjellige nivåer av ressurstilgjengelighet.
Pap -tester har ikke vært like effektive i utviklingsland. Dette er delvis fordi mange av disse landene har en fattig helseinfrastruktur, for få utdannede og dyktige fagfolk til å skaffe og tolke Pap-tester, uinformerte kvinner som går seg vill til oppfølging, og en lang omgangstid for å få resultater. Visuell inspeksjon med eddiksyre og HPV DNA -testing har blitt prøvd, men med blandet suksess.
Barrierebeskyttelse
Barrierebeskyttelse eller bruk av spermicid gel under samleie reduseres, men eliminerer ikke risikoen for å overføre infeksjonen, selv om kondomer kan beskytte mot kjønnsvorter. De gir også beskyttelse mot andre seksuelt overførbare infeksjoner, for eksempel HIV og Chlamydia , som er forbundet med større risiko for å utvikle livmorhalskreft.
Vaksinasjon
Tre HPV -vaksiner ( Gardasil , Gardasil 9 og Cervarix ) reduserer risikoen for kreft eller forstadier til endringer i livmorhalsen og perineum med henholdsvis 93% og 62%. Vaksinene er mellom 92% og 100% effektive mot HPV 16 og 18 opp til minst 8 år.
HPV -vaksiner gis vanligvis i alderen 9 til 26 år, ettersom vaksinen er mest effektiv hvis den gis før infeksjon oppstår. Varigheten av effektivitet og om det vil være behov for en booster er ukjent. De høye kostnadene ved denne vaksinen har vært grunn til bekymring. Flere land har vurdert (eller vurderer) programmer for å finansiere HPV -vaksinasjon. The American Society of Clinical Oncology guideline har anbefalinger for forskjellige nivåer av ressurstilgjengelighet.
Siden 2010 har unge kvinner i Japan vært kvalifisert til å motta livmorhalskreftvaksinasjon gratis. I juni 2013 påla det japanske helse-, arbeids- og velferdsdepartementet at medisinske institusjoner må informere kvinner om at departementet ikke anbefaler det før administrering av vaksinen. Imidlertid er vaksinen fortsatt tilgjengelig uten kostnad for japanske kvinner som velger å godta vaksinasjonen.
Ernæring
Vitamin A er forbundet med en lavere risiko, som vitamin B12 , vitamin C , vitamin E og beta-karoten .
Behandling
Behandlingen av livmorhalskreft varierer over hele verden, hovedsakelig på grunn av tilgang til kirurger som er dyktige i radikal bekkenkirurgi, og fremveksten av fruktbarhetssparende terapi i utviklede nasjoner. Mindre avanserte stadier av livmorhalskreft har vanligvis behandlingsalternativer som gjør at fruktbarheten kan opprettholdes hvis pasienten ønsker det. Fordi livmorhalskreft er radiosensitiv, kan stråling brukes i alle stadier der kirurgiske alternativer ikke eksisterer. Kirurgisk inngrep kan ha bedre utfall enn radiologiske tilnærminger. I tillegg kan cellegift brukes til å behandle livmorhalskreft, og har vist seg å være mer effektivt enn stråling alene. Bevis tyder på at kjemoradioterapi kan øke total overlevelse og redusere risikoen for tilbakefall av sykdom sammenlignet med strålebehandling alene. Peri-operative omsorgstilnærminger, for eksempel 'fast-track-kirurgi' eller 'forbedrede restitusjonsprogrammer' kan senke kirurgisk stress og forbedre restitusjonen etter gynekologisk kreftoperasjon.
Mikroinvasiv kreft (stadium IA) kan behandles ved hysterektomi (fjerning av hele livmoren inkludert en del av skjeden ). For stadium IA2 blir lymfeknuter også fjernet. Alternativer inkluderer lokale kirurgiske prosedyrer, for eksempel en sløyfe -elektrisk eksisjonsprosedyre eller kjeglebiopsi . En systematisk gjennomgang konkluderte med at det er behov for mer bevis for å informere beslutninger om forskjellige kirurgiske teknikker for kvinner med livmorhalskreft i stadium IA2.
Hvis en kjeglebiopsi ikke gir klare marginer (funn på biopsi som viser at svulsten er omgitt av kreftfritt vev, noe som tyder på at hele svulsten er fjernet), er et annet mulig behandlingsalternativ for kvinner som ønsker å bevare fruktbarheten, trakelektomi . Dette prøver å fjerne kreften kirurgisk samtidig som eggstokkene og livmoren bevares, noe som gir en mer konservativ operasjon enn en hysterektomi. Det er et levedyktig alternativ for de i fase I livmorhalskreft som ikke har spredd seg; Imidlertid er det ennå ikke ansett som en standard for omsorg, ettersom få leger er dyktige i denne prosedyren. Selv den mest erfarne kirurgen kan ikke love at en trakelektomi kan utføres før etter kirurgisk mikroskopisk undersøkelse, ettersom omfanget av spredning av kreft er ukjent. Hvis kirurgen ikke er i stand til mikroskopisk å bekrefte klare marginer av livmorhalsvev når kvinnen er under narkose på operasjonssalen, kan det fortsatt være nødvendig med en hysterektomi. Dette kan bare gjøres under samme operasjon hvis kvinnen har gitt samtykke på forhånd. På grunn av den mulige risikoen for kreft som sprer seg til lymfeknuter i stadium 1B -kreft og noen stadium 1A -kreftformer, kan kirurgen også trenge å fjerne noen lymfeknuter fra livmoren for patologisk evaluering.
En radikal trakelektomi kan utføres abdominal eller vaginalt, og meninger er motstridende om hva som er bedre. En radikal abdominal trachelektomi med lymfadenektomi krever vanligvis bare to til tre dagers sykehusopphold, og de fleste kvinner blir raske raskt (ca. seks uker). Komplikasjoner er uvanlige, selv om kvinner som kan bli gravide etter operasjonen er utsatt for for tidlig fødsel og mulig sen abort. En ventetid på minst ett år anbefales vanligvis før du prøver å bli gravid etter operasjonen. Tilbakefall i gjenværende livmorhals er svært sjelden hvis kreften er fjernet med trakelektomi. Likevel anbefales det at kvinner praktiserer årvåken forebygging og oppfølging, inkludert Pap-screeninger/ kolposkopi , med biopsier av det gjenværende nedre livmorsegmentet etter behov (hver 3-4 måneder i minst 5 år) for å overvåke eventuell gjentakelse i tillegg til minimere eventuelle nye eksponeringer for HPV gjennom trygg sexpraksis til en aktivt prøver å bli gravid.
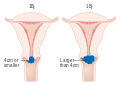
Tidlige stadier (IB1 og IIA mindre enn 4 cm) kan behandles med radikal hysterektomi med fjerning av lymfeknuter eller strålebehandling . Strålebehandling gis som ekstern strålebehandling til bekkenet og brachyterapi (intern stråling). Kvinner behandlet med kirurgi som har høyrisikofunksjoner funnet ved patologisk undersøkelse, får strålebehandling med eller uten cellegift for å redusere risikoen for tilbakefall. En Cochrane-gjennomgang har funnet bevis for moderat sikkerhet for at stråling reduserer risikoen for sykdomsprogresjon hos mennesker med stadium IB livmorhalskreft, sammenlignet med ingen videre behandling. Imidlertid ble det funnet lite bevis på effektene på total overlevelse.
Større tidlige svulster (IB2 og IIA mer enn 4 cm) kan behandles med strålebehandling og cisplatinbasert cellegift, hysterektomi (som da vanligvis krever adjuvant strålebehandling) eller cisplatin -cellegift etterfulgt av hysterektomi. Når cisplatin er tilstede, antas det å være det mest aktive enkeltmidlet ved periodiske sykdommer. Slik tillegg av platinabasert cellegift til kjemoradiering synes ikke bare å forbedre overlevelsen, men reduserer også risikoen for tilbakefall hos kvinner med livmorhalskreft i tidlig stadium (IA2-IIA). En Cochrane -gjennomgang fant mangel på bevis på fordelene og skadene ved primær hysterektomi sammenlignet med primær kjemoradioterapi for livmorhalskreft i stadium IB2.
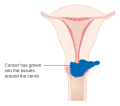
Svulster i avansert stadium (IIB-IVA) behandles med strålebehandling og cisplatinbasert cellegift. 15. juni 2006 godkjente US Food and Drug Administration bruk av en kombinasjon av to cellegiftmedisiner, hycamtin og cisplatin, for kvinner med sen fase (IVB) behandling av livmorhalskreft. Kombinasjonsbehandling har betydelig risiko for bivirkninger av nøytropeni , anemi og trombocytopeni .
Det er utilstrekkelig bevis på om kreftmedisiner etter standard omsorg hjelper kvinner med lokalt avansert livmorhalskreft til å leve lenger.
For at kirurgi skal være helbredende, må hele kreften fjernes uten at det finnes kreft i kanten av det fjernede vevet ved undersøkelse under et mikroskop. Denne prosedyren er kjent som eksenterasjon.
Det er ikke tilgjengelig bevis som tyder på at noen form for oppfølgingstilnærming er bedre eller verre når det gjelder å forlenge overlevelse, forbedre livskvaliteten eller veilede håndteringen av problemer som kan oppstå på grunn av behandlingen, og som ved behandling med strålebehandling forverres med tiden. En gjennomgang fra 2019 fant ingen kontrollerte studier angående effekt og sikkerhet av inngrep for vaginal blødning hos kvinner med avansert livmorhalskreft.
Tisotumab vedotin (Tivdak) ble godkjent for medisinsk bruk i USA i september 2021.
Prognose
Scene
Prognosen avhenger av kreftstadiet. Sjansen for overlevelse er nesten 100% for kvinner med mikroskopiske former for livmorhalskreft. Med behandling er den femårige relative overlevelsesraten for det tidligste stadiet av invasiv livmorhalskreft 92%, og den totale (alle stadiene tilsammen) femårige overlevelsesraten er omtrent 72%. Denne statistikken kan bli forbedret når den brukes på kvinner som nylig har fått diagnosen, med tanke på at disse resultatene delvis kan være basert på behandlingstilstanden for fem år siden da kvinnene som ble undersøkt først ble diagnostisert.
Med behandling lever 80–90% av kvinnene med stadium I -kreft og 60–75% av de med stadium II -kreft 5 år etter diagnosen. Overlevelsesraten reduseres til 30–40% for kvinner med stadium III -kreft og 15% eller færre av dem med stadium IV -kreft fem år etter diagnosen. Tilbakevendende livmorhalskreft oppdaget i de tidligste stadiene kan behandles med kirurgi, stråling, cellegift eller en kombinasjon av de tre. Omtrent 35% av kvinnene med invasiv livmorhalskreft har vedvarende eller tilbakevendende sykdom etter behandling.
Etter land
Fem års overlevelse i USA for hvite kvinner er 69% og for svarte kvinner er 57%.
Regelmessig screening har medført at endringer i forstadiet til kreft og livmorhalskreft i et tidlig stadium har blitt oppdaget og behandlet tidlig. Tall tyder på at livmorhalsscreening redder 5000 liv hvert år i Storbritannia ved å forhindre livmorhalskreft. Omtrent 1000 kvinner per år dør av livmorhalskreft i Storbritannia. Alle de nordiske landene har programmer for screening av livmorhalskreft. Pap -testen ble integrert i klinisk praksis i Norden på 1960 -tallet.
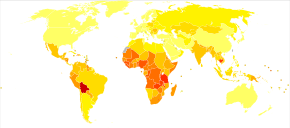
I Afrika er utfallene ofte verre, ettersom diagnosen ofte er på det siste stadiet av sykdommen. I en omfattende vurdering av planer for forebygging og kontroll av livmorhalskreft som er offentlig tilgjengelig fra afrikanske land, pleide planene å legge vekt på overlevelse i stedet for tidlig diagnostisering og forebygging av HPV.
Epidemiologi
|
ingen data
<2,4
2,4-4,8
4.8-7.2
7,2-9,6
9.6-12
12-14.4 |
14.4-16.8
16.8-19.2
19.2-21.6
21.6–24
24–26.4
> 26.4 |
På verdensbasis er livmorhalskreft både den fjerde vanligste årsaken til kreft og dødsfall av kreft hos kvinner. I 2018 ble det estimert 570 000 tilfeller av livmorhalskreft, med over 300 000 dødsfall. Det er den nest vanligste årsaken til kvinnespesifikk kreft etter brystkreft , og står for rundt 8% av både totale krefttilfeller og totale kreftdødsfall hos kvinner. Omtrent 80% av livmorhalskreft forekommer i utviklingsland. Det er den hyppigst oppdagede kreften under graviditet, med en forekomst på 1,5 til 12 for hver 100 000 graviditeter.
Australia
Australia hadde 734 tilfeller av livmorhalskreft i 2005. Antall kvinner diagnostisert med livmorhalskreft har falt i gjennomsnitt med 4,5% hvert år siden organisert screening begynte i 1991 (1991–2005). Vanlige Pap-tester to ganger årlig kan redusere forekomsten av livmorhalskreft med opptil 90% i Australia, og redde 1200 australske kvinner fra å dø av sykdommen hvert år. Det er spådd at på grunn av suksessen med det primære HPV -testprogrammet vil det være færre enn fire nye tilfeller per 100 000 kvinner årlig innen 2028.
Canada
I Canada vil anslagsvis 1300 kvinner ha blitt diagnostisert med livmorhalskreft i 2008 og 380 vil ha dødd.
India
I India øker antallet mennesker med livmorhalskreft, men generelt synker de aldersjusterte prisene. Bruk av kondomer i den kvinnelige befolkningen har forbedret overlevelse for kvinner med kreft i livmorhalsen.
Den Europeiske Union
I EU skjedde det rundt 34 000 nye tilfeller per år og over 16 000 dødsfall på grunn av livmorhalskreft i 2004.
Storbritannia
Livmorhalskreft er den 12. vanligste kreften hos kvinner i Storbritannia (rundt 3100 kvinner ble diagnostisert med sykdommen i 2011), og står for 1% av kreftdødsfallene (rundt 920 døde i 2012). Med en reduksjon på 42% fra 1988 til 1997, har det NHS-implementerte screeningsprogrammet vært svært vellykket, og screenet aldersgruppen med høyest risiko (25–49 år) hvert tredje år, og de i alderen 50–64 år hvert 5. år.
forente stater
Anslagsvis 13 170 nye livmorhalskreft og 4250 dødsfall i livmorhalskreft vil forekomme i USA i 2019. Medianalderen ved diagnosen er 50. Antall nye tilfeller i USA var 7,3 per 100 000 kvinner, basert på priser fra 2012 til 2016 . Dødsfall i livmorhalskreft gikk ned med omtrent 74% de siste 50 årene, hovedsakelig på grunn av utbredt screening av Pap -test. Den årlige direkte medisinske kostnaden for forebygging og behandling av livmorhalskreft før introduksjon av HPV -vaksinen ble estimert til 6 milliarder dollar.
Historie
- 400 fvt - Hippokrates bemerket at livmorhalskreft var uhelbredelig.
- 1925 - Hinselmann oppfant kolposkopet .
- 1928 - Papanicolaou utviklet Papanicolaou -teknikken.
- 1941 - Papanicolaou og Traut: Pap -test screening begynte.
- 1946 - Aylesbury spatel ble utviklet for å skrape livmorhalsen, samle prøven for Pap -testen.
- 1951-Første vellykkede in vitro cellelinje, HeLa , avledet fra biopsi av livmorhalskreft fra Henrietta Lacks .
- 1976 - Harald zur Hausen og Gisam fant HPV DNA i livmorhalskreft og kjønnsvorter; Hausen vant senere Nobelprisen for sitt arbeid.
- 1988 - Bethesda System for rapportering av Pap -resultater ble utviklet.
- 2006 - Den første HPV -vaksinen ble godkjent av FDA.
- 2015 - HPV -vaksine vist seg å beskytte mot infeksjon på flere kroppssteder.
- 2018-Bevis for enkeltdosebeskyttelse med HPV-vaksine.
Epidemiologer som jobbet på begynnelsen av 1900 -tallet bemerket at livmorhalskreft oppførte seg som en seksuelt overførbar sykdom. Oppsummert:
- Livmorhalskreft ble kjent for å være vanlig hos kvinnelige sexarbeidere .
- Det var sjelden hos nonner , bortsett fra de som hadde vært seksuelt aktive før de kom inn i klosteret (Rigoni i 1841).
- Det var mer vanlig hos de andre konene til menn hvis første koner hadde dødd av livmorhalskreft.
- Det var sjelden hos jødiske kvinner.
- I 1935 oppdaget Syverton og Berry et forhold mellom RPV (Rabbit Papillomavirus) og hudkreft hos kaniner (HPV er artsspesifikk og kan derfor ikke overføres til kaniner).
Disse historiske observasjonene antydet at livmorhalskreft kan være forårsaket av et seksuelt overførbart middel. Første forskning på 1940- og 1950 -tallet tilskrev livmorhalskreft til smegma (f.eks. Heins et al. 1958). I løpet av 1960- og 1970 -årene var det mistanke om at infeksjon med herpes simplex -virus var årsaken til sykdommen. Oppsummert ble HSV sett på som en sannsynlig årsak fordi det er kjent å overleve i den kvinnelige reproduktive kanalen, for å bli overført seksuelt på en måte som er kompatibel med kjente risikofaktorer, for eksempel promiskuitet og lav sosioøkonomisk status. Herpesvirus var også involvert i andre ondartede sykdommer, inkludert Burkitts lymfom , Nasopharyngeal carcinoma , Mareks sykdom og Lucké renal adenocarcinoma. HSV ble utvunnet fra livmorhalskreftceller.
En beskrivelse av humant papillomavirus (HPV) ved elektronmikroskopi ble gitt i 1949, og HPV-DNA ble identifisert i 1963. Det var først på 1980-tallet at HPV ble identifisert i livmorhalskreftvev. Det har siden blitt påvist at HPV er involvert i praktisk talt alle livmorhalskreft. Spesifikke virale subtyper som er involvert er HPV 16, 18, 31, 45 og andre.
I arbeid som ble startet på midten av 1980 -tallet, ble HPV -vaksinen utviklet parallelt av forskere ved Georgetown University Medical Center, University of Rochester , University of Queensland i Australia og US National Cancer Institute . I 2006 godkjente US Food and Drug Administration (FDA) den første forebyggende HPV -vaksinen, som ble markedsført av Merck & Co. under handelsnavnet Gardasil.
I november 2020 la Verdens helseorganisasjon , med støtte fra Verdens helseforsamling , en strategi for å eliminere livmorhalskreft innen 2050. Strategien innebærer å vaksinere 90% av jentene innen 15 år, og sjekke 70% av kvinnene etter alder av 35 og igjen i en alder av 45 år, og behandling av 90% av kvinnene identifisert med livmorhalssykdom.
Samfunn og kultur
Australia
I Australia er aboriginale kvinner mer enn fem ganger mer sannsynlig å dø av livmorhalskreft enn ikke-aboriginale kvinner, noe som tyder på at aboriginale kvinner er mindre sannsynlig å ha regelmessige Pap-tester. Det er flere faktorer som kan begrense urfolk til å delta i regelmessige cervical screening metoder, inkludert sensitivitet når det gjelder å diskutere temaet i aboriginalsamfunn, forlegenhet, angst og frykt for prosedyren. Vanskeligheter med å få tilgang til screeningstjenester (for eksempel transportvansker) og mangel på kvinnelige fastleger, utdannede pap -testleverandører og utdannede kvinnelige aboriginale helsearbeidere er også problemer.
The Australian Cervical Cancer Foundation (ACCF), grunnlagt i 2008, fremmer 'kvinners helse ved å eliminere livmorhalskreft og muliggjøre behandling for kvinner med livmorhalskreft og relaterte helseproblemer, i Australia og i utviklingsland.' Ian Frazer , en av utviklerne av Gardasil livmorhalskreftvaksine, er vitenskapelig rådgiver for ACCF. Janette Howard , kona til den daværende statsministeren i Australia, John Howard , ble diagnostisert med livmorhalskreft i 1996, og snakket først offentlig om sykdommen i 2006.

forente stater
En undersøkelse fra 2007 blant amerikanske kvinner fant at 40% hadde hørt om HPV -infeksjon, og mindre enn halvparten av dem visste at det forårsaker livmorhalskreft. Over en longitudinell studie fra 1975 til 2000, ble det funnet at personer med lavere sosioøkonomiske folketellinger hadde høyere frekvenser for sen stadium av kreftdiagnose og høyere sykelighet. Etter å ha kontrollert for scenen, eksisterte det fortsatt forskjeller i overlevelsesrater.
Referanser
Videre lesning
- Arbyn M, Castellsagué X, de Sanjosé S, Bruni L, Saraiya M, Bray F, Ferlay J (desember 2011). "Verdensomspennende byrde av livmorhalskreft i 2008" . Annals of Oncology . 22 (12): 2675–86. doi : 10.1093/annons/mdr015 . PMID 21471563 .
- Chuang LT, Temin S, Camacho R, Dueñas-Gonzalez A, Feldman S, Gultekin M, et al. (Oktober 2016). "Håndtering og omsorg for kvinner med invasiv livmorhalskreft: American Society of Clinical Oncology Resource-Stratified Clinical Practice Guideline" . Journal of Global Oncology . 2 (5): 311–340. doi : 10.1200/JGO.2016.003954 . PMC 5493265 . PMID 28717717 .
- Peto J, Gilham C, Fletcher O, Matthews FE (2004). "Livmorhalskreftepidemien som screening har forhindret i Storbritannia". Lancet . 364 (9430): 249–56. doi : 10.1016/S0140-6736 (04) 16674-9 . PMID 15262102 . S2CID 11059712 .
- Pimenta JM, Galindo C, Jenkins D, Taylor SM (november 2013). "Estimat av den globale byrden av cervikal adenokarsinom og potensiell innvirkning av profylaktisk humant papillomavirus -vaksinasjon" . BMC kreft . 13 (1): 553. doi : 10.1186/1471-2407-13-553 . PMC 3871005 . PMID 24261839 .
- Bhatla N, Aoki D, Sharma DN, Sankaranarayanan R (oktober 2018). "Kreft i livmorhalsen uteri" . International Journal of Gynecology and Obstetrics . 143 Suppl 2: 22–36. doi : 10.1002/ijgo.12611 . PMID 30306584 .
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |