Didemnin - Didemnin
Didemnins er sykliske depsipeptid forbindelser isolert fra et kappe ( ascidian , eller sjø-sprut) av slekten Trididemnum (familie av Didemnidæ ) som ble oppsamlet i den karibiske hav . De ble først isolert i 1978 ved University of Illinois .
Selv om mer enn ni didemniner (didemniner AE, G, X og Y) har blitt isolert fra ekstraktet av Trididemnum solidum , er didemnin B den som har de mest potente biologiske aktivitetene . Det er et sterkt antiviralt middel mot både DNA- og RNA- virus som herpes simplex-virus type 1 , et sterkt immunsuppressivt middel som viser noe potensial i hudtransplantasjon og som også er veldig cytotoksisk . Det viser sterk aktivitet mot murine leukemiceller . Store mengder didemnin B ble kjemisk syntetisert, og det ble videreført til kliniske studier av National Cancer Institute . Den har fullført fase II kliniske studier på mennesker mot adenokarsinom i nyrene , avansert epitelial eggstokkreft og metastatisk brystkreft. Dessverre viste forbindelsen høy toksisitet gjennom en høy forekomst av anafylaktiske reaksjoner hos pasienter, og studier ble avsluttet.
Didemninanalog plitidepsin var i fase II kliniske studier fra 2003.
Biosyntese
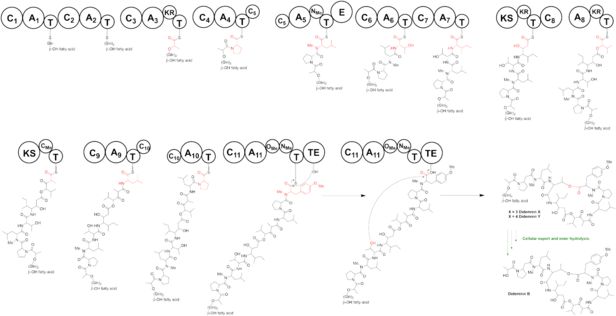
Biosyntese av depsipeptid Didemnin styres av en hybrid ikke-ribosomal peptidsyntetase-polyketidsyntetase (NRPS-PKS) -vei. Didemnin mega-synthetase består av 10 proteiner, hvorav 8 NRPS og 2 PKS, som dekker totalt 13 moduler.
Den foreslåtte veien for biosyntese av didemnin B starter på Did A. Modul 1 og 2 inneholder begge en glycin på en β-OH fettsyre. På DidB blir adenyleringsdomene (A) lastet av pyruvat og deretter redusert i sin cis-konformasjon av ketoreduktase (KR) domene, noe som gir laktatet avgrenset til tiolerings (T) domene. Monomodulær didC inkorporerer prolin, før tridomain forlenget peptidkjeden med 3 aminosyrer. Adenylering (A) -domenet til didD er fylt med leucin og deretter N-metylert av metyltransferase (MT) -domenet og omdannet til N-metylert D-leucin av epimerase (E) -domenet. Den N-metylerte leucinen er den eneste D-aminosyren i didemnin B. Den andre modulen på didD inneholder treonin og den tredje modulen på det domene som er festet isoleucin, og monterer tetrapeptidet (Pro) - (N-Me-D-Leu) - (Thr) - (Ile). DidE er et PKS, men mangler et acyltransferase (AT) domene. Modul 8 på didE fester et ketid-utvidet β-hydroksy-γ-isostatin. Det antydes at didemnin PKS mobiliserer AT-domene FabD fra en fettsyresyntase (FAS), siden det ikke er noe AT-domene til stede i didemin-genomet. DidF A-domenet er fylt med 2-oksoisovalerinsyre og inkorporerer a-hydroksysyre 2-hydroksysovalerinsyre. Modul 10 på PKS DidG legger til en andre runde med malonatforlengelse. MT-domenet på DidG legger til en α-metylgruppe i denne resten. Monomodulære domener DidH, DidI og DidJ forlenger kjeden med henholdsvis leucin, prolin og tyrosin. De to MT-domenene på DidJ-metylater tyrosin to ganger for å gi N-metyl-O-metyl-tyrosin, og fullfører monteringen av lineær didemnin B. Thioesterase (TE) -domenet på modul DidJ frigjør produktet i sin sykliserte form.
Se også
Referanser
- ^ Rinehart L., K. et al. . J. Am. Chem. Soc. 1981 , 103 , 1857-1859.
- ^ Rinehart L., K. et al. . J. Nat. Prod. 1988 , 51 , 1-21.
- ^ Montgomery, D .; Zukoshi, CF- transplantasjon 1985 , 40 , 49.
- ^ Belof, J (2006). "Survey of the didemnins: A class of depsipeptide natural products with lovende biomedisinske anvendelser". arXiv : q-bio / 0612040 .
- ^ Taylor, SA; Goodman, P .; Stuckey, WJ Stephens, RL; Gaynor, ER Invest. Nye stoffer 1992 , 10 , 55.
- ^ Cain, JM; Liu, PY; Alberta, DE; Gallion, JJ; Laufman, L .; O'Sullivan, J .; Weiss, G .; Bickers, JN Invest. Nye stoffer 1992 , 10 , 113.
- ^ Montgomery, D .; Zukoshi, CF- transplantasjon 1985 , 40 , 49.
- ^ Nuijen, B .; Bouma, M .; Manada, C .; Jimeno, JM; Schellens, JHM; Bult, A .; Beijnen, JH Anti-Cancer Drugs 2000 , 11 , 793.
- ^ Cárdenas, F. et al . The Journal of Organic Chemistry 2003 , 68 (25), 9554-9562.
- ^ Xu Y., et al. J. Am. Chem. Soc 2012 , 20 , 8625–8632. https://doi.org/10.1021/ja301735a