glykogen -Glycogen

Glykogen er et flerforgrenet polysakkarid av glukose som fungerer som en form for energilagring hos dyr , sopp og bakterier. Det er den viktigste lagringsformen for glukose i menneskekroppen.
Glykogen fungerer som en av to former for energireserver, glykogen er for kortsiktig og den andre formen er triglyseridlagre i fettvev (dvs. kroppsfett) for langtidslagring. Hos mennesker lages og lagres glykogen primært i cellene i leveren og skjelettmuskulaturen . I leveren kan glykogen utgjøre 5–6 % av organets friske vekt: leveren til en voksen, som veier 1,5 kg, kan lagre omtrent 100–120 gram glykogen. I skjelettmuskulatur finnes glykogen i en lav konsentrasjon (1–2 % av muskelmassen): skjelettmuskulaturen til en voksen som veier 70 kg lagrer omtrent 400 gram glykogen. Små mengder glykogen finnes også i andre vev og celler, inkludert nyrer , røde blodceller , hvite blodceller og gliaceller i hjernen . Livmoren lagrer også glykogen under graviditeten for å gi næring til embryoet.
Mengden glykogen som er lagret i kroppen avhenger for det meste av fysisk trening, basal metabolisme og spisevaner (spesielt oksidative type 1-fibre). Ulike nivåer av hvilende muskelglykogen oppnås ved å endre antall glykogenpartikler, i stedet for å øke størrelsen på eksisterende partikler, selv om de fleste glykogenpartikler i hvile er mindre enn deres teoretiske maksimum. Omtrent 4 gram glukose er tilstede i blodet til mennesker til enhver tid; hos fastende individer holdes blodsukkeret konstant på dette nivået på bekostning av glykogenlagrene i leveren og skjelettmuskulaturen. Glykogenlagre i skjelettmuskulaturen fungerer som en form for energilagring for selve muskelen; nedbrytningen av muskelglykogen hindrer imidlertid muskelglukoseopptak fra blodet, og øker dermed mengden blodsukker som er tilgjengelig for bruk i andre vev. Leverglykogenlagre fungerer som et lager av glukose for bruk i hele kroppen, spesielt sentralnervesystemet . Den menneskelige hjernen bruker omtrent 60 % av blodsukkeret hos fastende, stillesittende individer.
Glykogen er analogen til stivelse , en glukosepolymer som fungerer som energilagring i planter . Den har en struktur som ligner på amylopektin (en komponent av stivelse), men er mer omfattende forgrenet og kompakt enn stivelse. Begge er hvite pulvere i tørr tilstand. Glykogen finnes i form av granuler i cytosol /cytoplasma i mange celletyper , og spiller en viktig rolle i glukosesyklusen . Glykogen danner en energireserve som raskt kan mobiliseres for å dekke et plutselig behov for glukose, men en som er mindre kompakt enn energireservene til triglyserider ( lipider ). Som sådan finnes den også som lagringsreserve i mange parasittiske protozoer.
Struktur
Glykogen er en forgrenet biopolymer som består av lineære kjeder av glukoserester med en gjennomsnittlig kjedelengde på omtrent 8–12 glukoseenheter og 2 000–60 000 rester per ett glykogenmolekyl.
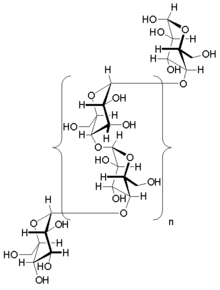
Som amylopektin er glukoseenheter koblet sammen lineært av α(1→4) glykosidbindinger fra en glukose til den neste. Grener er knyttet til kjedene som de forgrener seg fra ved α(1→6) glykosidbindinger mellom den første glukosen i den nye grenen og en glukose på stammekjeden.
Hvert glykogen er i hovedsak en kule av glukosetrær, med rundt 12 lag, sentrert på et glykogeninprotein , med tre typer glukosekjeder: A, B og C. Det er bare én C-kjede knyttet til glykogeninet. Denne C-kjeden dannes ved selvglukosylering av glykogeninet, og danner en kort primerkjede. Fra C-kjeden vokser det ut B-kjeder, og fra B-kjeder forgrener seg B- og A-kjeder. B-kjedene har i gjennomsnitt 2 grenpunkter, mens A-kjedene er terminale, dermed uforgrenede. I gjennomsnitt har hver kjede lengde 12, tett begrenset til å være mellom 11 og 15. Alle A-kjeder når den sfæriske overflaten til glykogenet.
Glykogen i muskel-, lever- og fettceller lagres i en hydrert form, sammensatt av tre eller fire deler vann per del glykogen assosiert med 0,45 millimol (18 mg) kalium per gram glykogen.
Glukose er et osmotisk molekyl, og kan ha dype effekter på osmotisk trykk i høye konsentrasjoner, noe som kan føre til celleskade eller død hvis det lagres i cellen uten å bli modifisert. Glykogen er et ikke-osmotisk molekyl, så det kan brukes som en løsning for å lagre glukose i cellen uten å forstyrre osmotisk trykk.
Funksjoner
Lever
Når et måltid som inneholder karbohydrater eller protein spises og fordøyes , stiger blodsukkernivået , og bukspyttkjertelen skiller ut insulin . Blodsukker fra portvenen går inn i leverceller ( hepatocytter ). Insulin virker på hepatocyttene for å stimulere virkningen av flere enzymer , inkludert glykogensyntase . Glukosemolekyler legges til kjedene av glykogen så lenge både insulin og glukose forblir rikelig. I denne postprandiale eller "matede" tilstanden tar leveren inn mer glukose fra blodet enn den frigjør.
Etter at et måltid er fordøyd og glukosenivået begynner å falle, reduseres insulinsekresjonen, og glykogensyntesen stopper. Når det er nødvendig for energi , brytes glykogen ned og omdannes igjen til glukose. Glykogenfosforylase er det primære enzymet for glykogennedbrytning. I de neste 8–12 timene er glukose avledet fra leverglykogen den primære kilden til blodsukker som brukes av resten av kroppen som drivstoff.
Glukagon , et annet hormon som produseres av bukspyttkjertelen, fungerer i mange henseender som et motsignal til insulin. Som respons på at insulinnivået er under normalt (når blodsukkernivået begynner å falle under normalområdet), utskilles glukagon i økende mengder og stimulerer både glykogenolyse (nedbrytningen av glykogen) og glukoneogenese (produksjon av glukose fra andre kilder) .
Muskel
Muskelcelleglykogen ser ut til å fungere som en umiddelbar reservekilde for tilgjengelig glukose for muskelceller. Andre celler som inneholder små mengder bruker det også lokalt. Siden muskelceller mangler glukose-6-fosfatase , som kreves for å føre glukose inn i blodet, er glykogenet de lagrer kun tilgjengelig for intern bruk og deles ikke med andre celler. Dette er i motsetning til leverceller, som på forespørsel lett bryter ned sitt lagrede glykogen til glukose og sender det gjennom blodstrømmen som drivstoff for andre organer.
Tilsynelatende optimalitet
I 1999 viste Meléndez et al at strukturen til glykogen er optimal under en bestemt metabolsk begrensningsmodell. I detalj er glykogenstrukturen den optimale utformingen som maksimerer en kondisjonsfunksjon basert på å maksimere tre mengder: antall glukoseenheter på overflaten av kjeden tilgjengelig for enzymatisk nedbrytning, antall bindingssteder for de nedbrytende enzymene å feste seg til, det totale antallet lagrede glukoseenheter; og minimere én kvalitet: totalt volum.
Hvis hver kjede har 0 eller 1 forgreningspunkter, får vi i hovedsak en lang kjede, ikke en kule, og den vil oppta et for stort volum med bare noen få terminale glukoseenheter for nedbrytning. Hvis hver kjede har 3 forgreningspunkter, vil glykogenet fylles opp for raskt. Balansepunktet er 2.
Med den grenen nummer 2, må kjedelengden være minst 4. Som modellert av Meléndez et al, når fitnessfunksjonen maksimum ved 13, og avtar deretter sakte.
Empirisk er grennummeret 2 og kjedelengden varierer 11-15 for de fleste organismer alt fra virveldyr til bakterier og sopp. Det eneste betydelige unntaket er østers, med glykogenkjedelengde på 2-30, gjennomsnittlig 7.
Historie
Glykogen ble oppdaget av Claude Bernard . Forsøkene hans viste at leveren inneholdt et stoff som kunne gi opphav til å redusere sukker ved påvirkning av en "gjæring" i leveren. I 1857 beskrev han isolasjonen av et stoff han kalte " la matière glycogène ", eller "sukkerdannende stoff". Rett etter oppdagelsen av glykogen i leveren fant A. Sanson at muskelvev også inneholder glykogen. Den empiriske formelen for glykogen av ( C
6H
10O
5) n ble etablert av Kekulé i 1858.
Metabolisme
Syntese
Glykogensyntese er, i motsetning til nedbrytningen, endergonisk - den krever tilførsel av energi. Energi for glykogensyntese kommer fra uridintrifosfat (UTP), som reagerer med glukose-1-fosfat , og danner UDP-glukose , i en reaksjon katalysert av UTP-glukose-1-fosfat uridylyltransferase . Glykogen syntetiseres fra monomerer av UDP-glukose i utgangspunktet av proteinet glykogenin , som har to tyrosin- ankre for den reduserende enden av glykogen, siden glykogenin er en homodimer. Etter at omtrent åtte glukosemolekyler er blitt tilsatt til en tyrosinrest, forlenger enzymet glykogensyntase gradvis glykogenkjeden ved å bruke UDP-glukose, og legger til α(1→4)-bundet glukose til den ikke-reduserende enden av glykogenkjeden.
Glykogenforgreningsenzymet katalyserer overføringen av et terminalt fragment av seks eller syv glukoserester fra en ikke-reduserende ende til C-6 hydroksylgruppen til en glukoserest dypere inn i det indre av glykogenmolekylet. Forgreningsenzymet kan virke på bare en gren som har minst 11 rester, og enzymet kan overføres til samme glukosekjede eller tilstøtende glukosekjeder.
Sammenbrudd
Glykogen spaltes fra de ikke-reduserende endene av kjeden av enzymet glykogenfosforylase for å produsere monomerer av glukose-1-fosfat:
In vivo fortsetter fosforolyse i retning av glykogennedbrytning fordi forholdet mellom fosfat og glukose-1-fosfat vanligvis er større enn 100. Glukose-1-fosfat omdannes deretter til glukose 6-fosfat (G6P) av fosfoglukomutase . Et spesielt avgreningsenzym er nødvendig for å fjerne α(1→6)-grenene i forgrenet glykogen og omforme kjeden til en lineær polymer. G6P-monomerene som produseres har tre mulige skjebner:
- G6P kan fortsette på glykolysebanen og brukes som drivstoff.
- G6P kan gå inn i pentosefosfatveien via enzymet glukose-6-fosfatdehydrogenase for å produsere NADPH og 5 karbonsukker.
- I leveren og nyrene kan G6P defosforyleres tilbake til glukose av enzymet glukose 6-fosfatase . Dette er det siste trinnet i glukoneogenesebanen .
Klinisk relevans
Forstyrrelser i glykogenmetabolismen
Den vanligste sykdommen der glykogenmetabolismen blir unormal, er diabetes , der leverglykogen kan akkumuleres unormalt eller tømmes på grunn av unormale mengder insulin. Gjenoppretting av normal glukosemetabolisme normaliserer vanligvis også glykogenmetabolismen.
Ved hypoglykemi forårsaket av overdreven insulin er glykogennivåene i leveren høye, men de høye insulinnivåene forhindrer glykogenolysen som er nødvendig for å opprettholde normale blodsukkernivåer. Glukagon er en vanlig behandling for denne typen hypoglykemi.
Ulike medfødte metabolismefeil er forårsaket av mangler på enzymer som er nødvendige for glykogensyntese eller nedbrytning. Disse er samlet referert til som glykogenlagringssykdommer .
Glykogenmangel og utholdenhetstrening
Langdistanseutøvere, som maratonløpere , langrennsløpere og syklister , opplever ofte glykogenmangel, der nesten alle utøverens glykogenlagre er oppbrukt etter lange perioder med anstrengelse uten tilstrekkelig karbohydratforbruk. Dette fenomenet omtales som " å treffe veggen " i løping og "bonking" i sykling.
Glykogenmangel kan forhindres på tre mulige måter:
- For det første, under trening, inntas karbohydrater med høyest mulig konverteringshastighet til blodsukker (høy glykemisk indeks ) kontinuerlig. Det best mulige resultatet av denne strategien erstatter ca. 35 % av glukose konsumert ved hjertefrekvenser over ca. 80 % av maksimum.
- For det andre, gjennom tilpasninger av utholdenhetstrening og spesialiserte regimer (f.eks. faste, utholdenhetstrening med lav intensitet), kan kroppen kondisjonere type I muskelfibre for å forbedre både drivstoffbrukseffektiviteten og arbeidsbelastningskapasiteten for å øke prosentandelen fettsyrer som brukes som drivstoff, og sparer karbohydrater bruk fra alle kilder.
- For det tredje, ved å innta store mengder karbohydrater etter å ha tømt glykogenlagrene som følge av trening eller kosthold, kan kroppen øke lagringskapasiteten til intramuskulære glykogenlagre. Denne prosessen er kjent som karbohydratbelastning . Generelt spiller den glykemiske indeksen for karbohydratkilden ingen rolle siden muskulær insulinfølsomhet øker som et resultat av midlertidig glykogenmangel.
Når idrettsutøvere får i seg både karbohydrater og koffein etter uttømmende trening, har glykogenlagrene en tendens til å fylles opp raskere; minimumsdosen av koffein der det er en klinisk signifikant effekt på glykogenreplesjon er imidlertid ikke fastslått.
Se også
Referanser
Eksterne linker
- "Glykogenlagringssykdom" . McArdles sykdommer .
- Glykogen ved US National Library of Medicine Medical Subject Headings (MeSH)