Grønt fluorescerende protein - Green fluorescent protein
| Grønt fluorescerende protein | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur av Aequorea victoria green fluorescent protein.
| |||||||||
| Identifikatorer | |||||||||
| Symbol | GFP | ||||||||
| Pfam | PF01353 | ||||||||
| Pfam klanen | CL0069 | ||||||||
| InterPro | IPR011584 | ||||||||
| CATH | 1ema | ||||||||
| SCOP2 | 1ema / SCOPe / SUPFAM | ||||||||
| |||||||||
| Grønt fluorescerende protein | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatorer | |||||||
| Organisme | |||||||
| Symbol | GFP | ||||||
| UniProt | P42212 | ||||||
| |||||||
Det grønne fluorescerende proteinet ( GFP ) er et protein som viser lys grønn fluorescens når det utsettes for lys i det blå til ultrafiolette området. Etiketten GFP refererer tradisjonelt til proteinet som først ble isolert fra manet Aequorea victoria og kalles noen ganger avGFP . Imidlertid er GFP funnet i andre organismer, inkludert koraller , sjøanemoner , zoanithider , copepods og lansetter .
GFP fra A. victoria har en stor eksitasjonstopp ved en bølgelengde på 395 nm og en mindre ved 475 nm. Utslippstoppen er ved 509 nm, som er i den nedre grønne delen av det synlige spekteret . Fluorescensen kvanteutbytte (QY) av GFP er 0,79. GFP fra sjøen pansy ( Renilla reniformis ) har en enkelt hovedtopp ved eksitasjon 498 nm. GFP er et utmerket verktøy i mange former for biologi på grunn av dets evne til å danne en intern kromofor uten å kreve noen ekstra kofaktorer , genprodukter eller andre enzymer / substrater enn molekylært oksygen.
I celle- og molekylærbiologi brukes GFP -genet ofte som en ekspresjonsreporter . Det har blitt brukt i modifiserte former for å lage biosensorer , og mange dyr har blitt opprettet som uttrykker GFP, som demonstrerer et bevis på at et gen kan uttrykkes gjennom en gitt organisme, i utvalgte organer eller i celler av interesse. GFP kan introduseres i dyr eller andre arter gjennom transgene teknikker , og opprettholdes i deres genom og avkom. Til dags dato har GFP blitt uttrykt i mange arter, inkludert bakterier, gjær, sopp, fisk og pattedyr, inkludert i menneskelige celler. Forskerne Roger Y. Tsien , Osamu Shimomura og Martin Chalfie ble tildelt Nobelprisen 2008 i kjemi 10. oktober 2008 for sin oppdagelse og utvikling av det grønne fluorescerende proteinet.
De fleste kommersielt tilgjengelige gener for GFP og lignende fluorescerende proteiner er rundt 730 basepar lange. Det naturlige proteinet har 238 aminosyrer. Molekylmassen er 27 kD. Derfor kan fusjon av GFP -genet til genet til et protein av interesse betydelig øke proteinets størrelse og molekylmasse, og kan svekke proteinets naturlige funksjon eller endre dets plassering eller transportbane i cellen.
Bakgrunn
Wild-type GFP (wtGFP)
På 1960- og 1970 -tallet ble GFP, sammen med det separate selvlysende protein aequorin (et enzym som katalyserer nedbrytningen av luciferin , frigjør lys), først renset fra manet Aequorea victoria og dets egenskaper studert av Osamu Shimomura . I A. victoria oppstår GFP -fluorescens når aequorin interagerer med Ca 2+ ioner, noe som induserer en blå glød. Noe av denne selvlysende energien overføres til GFP, og flytter den generelle fargen mot grønt. Imidlertid begynte bruken av det som et verktøy for molekylærbiologer ikke å bli realisert før i 1992 da Douglas Prasher rapporterte kloning og nukleotidsekvens av wtGFP i Gene . Finansieringen til dette prosjektet var tom, så Prasher sendte cDNA -prøver til flere laboratorier. Laboratoriet til Martin Chalfie uttrykte kodesekvensen til wtGFP, med de første få aminosyrene slettet, i heterologe celler av E. coli og C. elegans , og publiserte resultatene i Science i 1994. Frederick Tsujis laboratorium rapporterte uavhengig av uttrykket av den rekombinante protein en måned senere. Bemerkelsesverdig foldet GFP -molekylet seg og var fluorescerende ved romtemperatur, uten behov for eksogene kofaktorer som var spesifikke for manetene. Selv om denne nær-wtGFP var fluorescerende, hadde den flere ulemper, inkludert dobbelttoppede eksitasjonsspektre, pH-følsomhet, kloridfølsomhet, dårlig fluorescenskvanteutbytte, dårlig fotostabilitet og dårlig folding ved 37 ° C.
Den første rapporterte krystallstrukturen til en GFP var den for S65T-mutanten av Remington-gruppen i Science i 1996. En måned senere rapporterte Phillips-gruppen uavhengig av villtype-GFP-strukturen i Nature Biotechnology . Disse krystallstrukturene ga en avgjørende bakgrunn for kromofordannelse og interaksjoner mellom rester. Forskere har modifisert disse restene ved direkte og tilfeldig mutagenese for å produsere det store utvalget av GFP -derivater som brukes i dag. Videre forskning på GFP har vist at det er motstandsdyktig mot vaskemidler, proteaser, guanidiniumklorid (GdmCl) behandlinger og drastiske temperaturendringer.
GFP -derivater
På grunn av potensialet for utbredt bruk og forskernes behov, har mange forskjellige mutanter av GFP blitt konstruert. Den første store forbedringen var en enkeltpunktsmutasjon (S65T) rapportert i 1995 i Nature av Roger Tsien . Denne mutasjonen forbedret dramatisk de spektrale egenskapene til GFP, noe som resulterte i økt fluorescens, fotostabilitet og et skifte av den store eksitasjonstoppen til 488 nm, med toppemisjonen holdt på 509 nm. Dette samsvarer med de spektrale egenskapene til FITC -filtersett som er tilgjengelig , noe som øker bruken av den generelle forskeren. Et 37 ° C bretteffektivitetspunkt (F64L) -mutant for dette stillaset, noe som gir forbedret GFP ( EGFP ), ble oppdaget i 1995 av laboratoriene i Thastrup og Falkow. EGFP tillot praktisk bruk av GFP i pattedyrceller. EGFP har en ekstinksjonskoeffisient (betegnet ε) på 55 000 M −1 cm −1 . Fluorescensen kvanteutbytte (QY) av EGFP er 0,60. Den relative lysstyrken, uttrykt som ε • QY, er 33 000 M −1 cm −1 .
Supermappe GFP ( sfGFP ), en serie mutasjoner som gjør at GFP kan brette seg raskt og modne selv når det smeltes til dårlig foldbare peptider, ble rapportert i 2006.
Mange andre mutasjoner har blitt gjort, inkludert fargemutanter; spesielt blått fluorescerende protein (EBFP, EBFP2, Azurite, mKalama1), cyan fluorescerende protein (ECFP, Cerulean, CyPet, mTurquoise2) og gule fluorescerende proteinderivater (YFP, Citrine, Venus, YPet). BFP -derivater (unntatt mKalama1) inneholder Y66H -substitusjonen. De viser et bredt absorpsjonsbånd i ultrafiolett sentrert nær 380 nanometer og et utslippsmaksimum på 448 nanometer. En grønn fluorescerende proteinmutant ( BFPms1 ) som fortrinnsvis binder Zn (II) og Cu (II) er utviklet. BFPms1 har flere viktige mutasjoner, inkludert BFP-kromoforen (Y66H), Y145F for høyere kvanteutbytte, H148G for å lage et hull i beta-fatet og flere andre mutasjoner som øker løseligheten. Zn (II) binding øker fluorescensintensiteten, mens Cu (II) binding slukker fluorescens og flytter maksimal absorbans fra 379 til 444 nm. Derfor kan de brukes som Zn -biosensor.
Kromoforbinding . Den kritiske mutasjonen i cyanderivater er Y66W -substitusjonen, som får kromoforen til å dannes med en indol i stedet for en fenolkomponent . Flere ytterligere kompenserende mutasjoner i den omkringliggende fatningen er nødvendig for å gjenopprette lysstyrken til denne modifiserte kromoforen på grunn av den økte bulk av indolgruppen. I ECFP og Cerulean viser den N-terminale halvdelen av den syvende strengen to konformasjoner. Disse konformasjonene har begge et komplekst sett med van der Waals -interaksjoner med kromoforen. Y145A- og H148D -mutasjonene i Cerulean stabiliserer disse interaksjonene og gjør at kromoforen kan være mer plan, bedre pakket og mindre utsatt for kollisjonstrykk.
Ytterligere stedstilt tilfeldig mutagenese i kombinasjon med fluorescens levetid basert screening har ytterligere stabilisert den syvende β-strengen, noe som resulterer i en lys variant, mTurquoise2, med et kvanteutbytte (QY) på 0,93. Den rødforskyvede bølgelengden til YFP-derivatene oppnås ved T203Y-mutasjonen og skyldes π-elektronstableringsinteraksjoner mellom den substituerte tyrosinresten og kromoforen. Disse to klassene av spektralvarianter brukes ofte for Forsster resonans energioverføring ( FRET ) eksperimenter. Genetisk kodede FRET -journalister som er følsomme for cellesignalmolekyler, for eksempel kalsium eller glutamat, proteinfosforyleringstilstand, proteinkomplementering, reseptordimerisering og andre prosesser gir svært spesifikke optiske avlesninger av celleaktivitet i sanntid.
Semirasjonell mutagenese av en rekke rester førte til pH-sensitive mutanter kjent som pHluoriner, og senere superekliptiske pHluoriner. Ved å utnytte den raske endringen i pH ved synaptisk vesikelfusjon, har pHluoriner merket til synaptobrevin blitt brukt til å visualisere synaptisk aktivitet i nevroner.
Redox sensitiv GFP ( roGFP ) ble konstruert ved introduksjon av cystein i betatønnestrukturen . Den redoks- tilstand av cysteinene bestemmer de fluorescerende egenskapene til roGFP .
Nomenklatur
Nomenklaturen til modifiserte GFP -er er ofte forvirrende på grunn av overlappende kartlegging av flere GFP -versjoner på et enkelt navn. For eksempel refererer mGFP ofte til en GFP med en N-terminal palmitoylering som får GFP til å binde seg til cellemembraner . Imidlertid brukes det samme begrepet også for å referere til monomer GFP, som ofte oppnås ved at dimer -grensesnittet bryter A206K -mutasjon. GFP av vill type har en svak dimeriseringstendens ved konsentrasjoner over 5 mg/ml. mGFP står også for "modifisert GFP", som er optimalisert gjennom aminosyreutveksling for stabilt uttrykk i planteceller.
I naturen
Formålet med både (primær) bioluminescens (fra aequorins virkning på luciferin) og (sekundær) fluorescens av GFP i maneter er ukjent. GFP uttrykkes samtidig med aequorin i små granulater rundt kanten av manetklokken. Den sekundære eksitasjonstoppen (480 nm) til GFP absorberer noe av det blå utslippet av aequorin, noe som gir bioluminescensen en mer grønn fargetone. Serin 65-resten av GFP- kromoforen er ansvarlig for de to-toppede eksitasjonsspektrene til vill-type GFP. Den er bevart i alle tre GFP -isoformene som opprinnelig ble klonet av Prasher. Nesten alle mutasjoner av denne resten konsoliderer eksitasjonsspektrene til en enkelt topp ved enten 395 nm eller 480 nm. Den nøyaktige mekanismen for denne følsomheten er kompleks, men det ser ut til å innebære donering av et hydrogen fra serin 65 til glutamat 222, som påvirker kromoforionisering. Siden en enkelt mutasjon dramatisk kan forbedre 480 nm eksitasjonstoppen, noe som gjør GFP til en mye mer effektiv partner for aequorin, ser det ut til at A. victoria evolusjonært foretrekker det mindre effektive eksitasjonsspekteret med dobbel topp. Roger Tsien har spekulert i at varierende hydrostatisk trykk med dybde kan påvirke serin 65s evne til å donere et hydrogen til kromoforen og endre forholdet mellom de to eksitasjonstoppene. Dermed kan manetene endre fargen på bioluminescensen med dybde. Imidlertid har en kollaps i bestanden av maneter i Friday Harbor , der GFP opprinnelig ble oppdaget, hindret videre studier av GFPs rolle i manetenes naturlige miljø.
De fleste lansettarter er kjent for å produsere GFP i forskjellige områder av kroppen. I motsetning til A. victoria , produserer ikke lanseletter sitt eget blått lys, og opprinnelsen til deres endogene GFP er fremdeles ukjent. Noen spekulerer i at det tiltrekker plankton mot lansettens munn og fungerer som en passiv jaktmekanisme. Det kan også fungere som et fotobeskyttelsesmiddel i larvene, og forhindre skade forårsaket av blålys med høy intensitet ved å konvertere det til grønt lys med lavere intensitet. Imidlertid har disse teoriene ikke blitt testet.
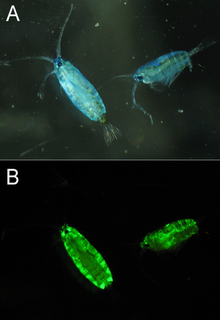
GFP-lignende proteiner har blitt funnet i flere arter av marine copepoder , spesielt fra Pontellidae- og Aetideidae- familiene. GFP isolert fra Pontella mimocerami har vist høye lysstyrker med et kvanteutbytte på 0,92, noe som gjør dem nesten to ganger lysere enn den vanlige EGFP isolert fra A. victoria.
Andre fluorescerende proteiner
Det er mange GFP-lignende proteiner som, til tross for at de er i samme proteinfamilie som GFP, ikke er direkte avledet fra Aequorea victoria . Disse inkluderer dsRed , eqFP611, Dronpa, TagRFPs, KFP, EosFP/IrisFP, Dendra, og så videre. Etter å ha blitt utviklet fra proteiner i forskjellige organismer, kan disse proteinene noen ganger vise unantipated tilnærminger til kromofordannelse. Noen av disse, for eksempel KFP, er utviklet fra naturlig ikke- eller svakt-fluorescerende proteiner for å bli sterkt forbedret ved mutagenese. Når GFP-lignende tønner med forskjellige spektraegenskaper brukes, kan eksitasjonsspektrene til en kromofor brukes til å drive en annen kromofor (FRET), noe som gir mulighet for konvertering mellom lysets bølgelengder.
FMN-bindende fluorescerende proteiner (FbFP) ble utviklet i 2007 og er en klasse med små (11-16 kDa), oksygenuavhengige fluorescerende proteiner som er avledet fra blålysreseptorer. De er spesielt beregnet for bruk under anaerobe eller hypoksiske forhold, siden dannelse og binding av Flavin -kromoforen ikke krever molekylært oksygen, slik det er tilfelle med syntesen av GFP -kromoforen.
Fluorescerende proteiner med andre kromoforer, for eksempel UnaG med bilirubin, kan vise unike egenskaper som rødskiftet utslipp over 600 nm eller fotokonvertering fra en grønnemitterende tilstand til en rødemitterende tilstand. De kan ha eksitasjons- og utslippsbølgelengder langt nok fra hverandre til å oppnå konvertering mellom rødt og grønt lys.
En ny klasse av fluorescerende protein ble utviklet fra et cyanobakterielt ( Trichodesmium erythraeum ) phycobiliprotein , α- allophycocyanin , og kalt lite ultrarødt fluorescerende protein ( smURFP ) i 2016. smURFP inkorporerer autokatalytisk selv kromoforen biliverdin uten behov for et eksternt protein , kjent som en lyase . Maneter - og korall -avledet GFP-lignende proteiner krever oksygen og produsere en støkiometrisk mengde av hydrogenperoksyd ved kromofor dannelse. smURFP krever ikke oksygen eller produserer hydrogenperoksid og bruker kromoforen , biliverdin . smURFP har en stor utryddelseskoeffisient (180 000 M −1 cm −1 ) og har et beskjedent kvanteutbytte (0,20), noe som gjør den sammenlignbar biofysisk lysstyrke med eGFP og ~ 2 ganger lysere enn de fleste røde eller langt røde fluorescerende proteiner avledet fra korall . smURFP -spektrale egenskaper ligner det organiske fargestoffet Cy5 .
Anmeldelser av nye klasser av fluorescerende proteiner og applikasjoner finnes i de nevnte anmeldelser.
Struktur
GFP har en beta-fatstruktur bestående av elleve β-tråder med et plissert arkarrangement, med en alfa-helix som inneholder den kovalent bundne kromoforen 4- ( p- hydroksybenzyliden) imidazolidin-5-on (HBI) som går gjennom midten. Fem kortere alfa -spiraler danner hetter på endene av strukturen. Den betatønnen struktur er en nesten perfekt sylinder, 42A lang og 24a i diameter (enkelte studier har rapportert en diameter på 30a), og gir det som refereres til som en "β-kan" formasjon, som er unik for den GFP-lignende familie . HBI, den spontant modifiserte formen av tripeptidet Ser65-Tyr66-Gly67, er ikke-fluorescerende i fravær av det riktig foldede GFP-stillaset og eksisterer hovedsakelig i den ikke-ioniserte fenolformen i wtGFP. Innadvendte sidekjeder i fatet induserer spesifikke sykliseringsreaksjoner i Ser65-Tyr66-Gly67 som induserer ionisering av HBI til fenolatformen og kromofordannelse . Denne prosessen med post-translasjonell modifikasjon kalles modning . Hydrogenbindingsnettverket og elektronstablende interaksjoner med disse sidekjedene påvirker fargen, intensiteten og fotostabiliteten til GFP og dens mange derivater. Tønnens tettpakkede natur utelukker løsningsmiddelmolekyler, og beskytter kromoforfluorescensen mot slukking av vann. I tillegg til autosykliseringen av Ser65-Tyr66-Gly67, skjer en 1,2-dehydrogeneringsreaksjon ved Tyr66-resten. Foruten de tre restene som danner kromoforen, fungerer rester som Gln94, Arg96, His148, Thr203 og Glu222 alle som stabilisatorer. Restene av Gln94, Arg96 og His148 er i stand til å stabilisere seg ved å delokalisere kromoforladningen. Arg96 er den viktigste stabiliserende resten på grunn av det faktum at den får de nødvendige strukturelle justeringer som er nødvendige fra HBI -ringen til å skje. Enhver mutasjon til Arg96 -resten vil resultere i en reduksjon i utviklingen av kromoforen fordi riktige elektrostatiske og steriske interaksjoner vil gå tapt. Tyr66 er mottakeren av hydrogenbindinger og ioniserer ikke for å produsere gunstig elektrostatikk.

GFP-molekyler tegnet i tegneseriestil, ett helt og ett med siden av betatønnen skåret bort for å avsløre kromoforen (fremhevet som ball-and-stick ). Fra PDB : 1GFL .
|
applikasjoner
Reporter analyserer
Grønt fluorescerende protein kan brukes som et reportergen .
For eksempel kan GFP brukes som en reporter for miljøgiftighetsnivåer. Dette proteinet har vist seg å være en effektiv måte å måle toksisitetsnivåene til forskjellige kjemikalier, inkludert etanol, p -formaldehyd, fenol, triklosan og paraben. GFP er flott som et reporterprotein fordi det ikke har noen effekt på verten når det blir introdusert i vertens mobilmiljø. På grunn av denne evnen er det ikke nødvendig med ekstern visualiseringsflekk, ATP eller kofaktorer. Når det gjelder forurensningsnivåer, ble fluorescensen målt for å måle effekten forurensningene har på vertscellen. Cellens tetthet av vertscellen ble også målt. Resultatene fra studien utført av Song, Kim og Seo (2016) viste at det var en nedgang i både fluorescens og celletetthet ettersom forurensningsnivået økte. Dette var et tegn på at mobilaktiviteten var redusert. Mer forskning på denne spesifikke applikasjonen for å bestemme mekanismen som GFP fungerer som en forurensende markør. Lignende resultater har blitt observert i sebrafisk fordi sebrafisk som ble injisert med GFP var omtrent tjue ganger mer utsatt for å gjenkjenne cellulære påkjenninger enn sebrafisk som ikke ble injisert med GFP.
Fordeler
Den største fordelen med GFP er at den kan være arvelig, avhengig av hvordan den ble introdusert, noe som muliggjør fortsatt studie av celler og vev den kommer til uttrykk i. Visualisering av GFP er ikke -invasiv, og krever bare belysning med blått lys. GFP alene forstyrrer ikke biologiske prosesser, men når det smeltes til proteiner av interesse, er det nødvendig med nøye design av koblinger for å opprettholde funksjonen til proteinet av interesse. Videre, hvis den brukes med en monomer, er den i stand til å diffundere lett gjennom cellene.
Fluorescensmikroskopi

Tilgjengeligheten av GFP og dets derivater har grundig omdefinert fluorescensmikroskopi og måten den brukes i cellebiologi og andre biologiske disipliner. Mens de fleste små fluorescerende molekyler som FITC (fluorescein isotiocyanat) er sterkt fototoksiske når de brukes i levende celler, er fluorescerende proteiner som GFP vanligvis mye mindre skadelige når de belyses i levende celler. Dette har utløst utviklingen av høyt automatiserte levende celle-fluorescensmikroskopisystemer, som kan brukes til å observere celler over tid som uttrykker ett eller flere proteiner merket med fluorescerende proteiner.
Det er mange teknikker for å bruke GFP i et levende celleavbildningseksperiment. Den mest direkte måten å bruke GFP på er å feste den direkte til et protein av interesse. For eksempel kan GFP inkluderes i et plasmid som uttrykker andre gener for å indikere en vellykket transfeksjon av et gen av interesse. En annen metode er å bruke en GFP som inneholder en mutasjon der fluorescensen vil endres fra grønt til gult over tid, som omtales som en fluorescerende timer. Med fluorescerende timer kan forskere studere tilstanden til proteinproduksjon, for eksempel nylig aktivert, kontinuerlig aktivert eller nylig deaktivert basert på fargen rapportert av det fluorescerende proteinet. I nok et eksempel har forskeren modifisert GFP for å bli aktiv bare etter eksponering for bestråling, noe som gir forskere et verktøy for å selektivt aktivere visse deler av en celle og observere hvor proteiner merket med GFP beveger seg fra startstedet. Dette er bare to eksempler i et spirende felt av fluorescerende mikrokopi og en mer fullstendig gjennomgang av biosensorer ved bruk av GFP og andre fluorescerende proteiner kan bli funnet her
For eksempel hadde GFP blitt mye brukt til å merke spermatozoa til forskjellige organismer for identifikasjonsformål som i Drosophila melanogaster , hvor uttrykk for GFP kan brukes som en markør for en bestemt egenskap. GFP kan også uttrykkes i forskjellige strukturer som muliggjør morfologisk skille. I slike tilfeller er genet for produksjon av GFP inkorporert i genomet til organismen i DNA -området som koder for målproteinene og som kontrolleres av den samme regulatoriske sekvensen ; det vil si at genets regulatoriske sekvens nå styrer produksjonen av GFP, i tillegg til de merkede proteinene. I celler der genet uttrykkes, og de merkede proteiner produseres, produseres GFP samtidig. Dermed vil bare de cellene der det merkede genet uttrykkes, eller målproteinene blir produsert, fluorescere når de observeres under fluorescensmikroskopi. Analyse av slike time -lapse -filmer har redefinert forståelsen av mange biologiske prosesser, inkludert proteinfolding, proteintransport og RNA -dynamikk, som tidligere hadde blitt studert ved bruk av fast (dvs. dødt) materiale. Innhentede data brukes også til å kalibrere matematiske modeller av intracellulære systemer og for å estimere frekvenser av genuttrykk. På samme måte kan GFP brukes som en indikator på proteinuttrykk i heterologe systemer. I dette scenariet blir fusjonsproteiner som inneholder GFP introdusert indirekte ved bruk av RNA av konstruksjonen, eller direkte, med selve merket protein. Denne metoden er nyttig for å studere strukturelle og funksjonelle egenskaper til det merkede proteinet på en makromolekylær eller enkeltmolekylær skala med fluorescensmikroskopi.
Den Vertico SMI mikroskop ved hjelp av SPDM Phymod teknologien benytter den såkalte "reversible fotobleking" effekt av fluorescerende fargestoffer som GFP og dets derivater for å lokalisere dem som enkeltmolekyler i en optisk oppløsning på 10 nm. Dette kan også utføres som en samlokalisering av to GFP-derivater (2CLM).
En annen kraftig bruk av GFP er å uttrykke proteinet i små sett med spesifikke celler. Dette gjør at forskere optisk kan oppdage spesifikke celletyper in vitro (i en tallerken), eller til og med in vivo (i den levende organismen). Genetisk å kombinere flere spektralvarianter av GFP er et nyttig triks for analyse av hjernekretser ( Brainbow ). Andre interessante anvendelser av fluorescerende proteiner i litteraturen omfatter bruk av FP-er som følerne i neuron membranpotensialet , sporing av AMPA- reseptorer på cellemembraner, viral inngang og infeksjon av individuelle influensa virus og lentivirale virus, etc.
Det har også blitt funnet at nye linjer med transgene GFP -rotter kan være relevante både for genterapi og for regenerativ medisin. Ved å bruke "high-expresser" GFP viser transgene rotter høyt uttrykk i de fleste vev, og mange celler som ikke har blitt karakterisert eller bare har blitt dårlig karakterisert i tidligere GFP-transgene rotter.
GFP har vist seg å være nyttig i kryobiologi som en levedyktighetsanalyse . Korrelasjon av levedyktighet målt ved trypanblå analyser var 0,97. En annen applikasjon er bruk av GFP co-transfeksjon som intern kontroll for transfeksjonseffektivitet i pattedyrceller.
En ny mulig bruk av GFP inkluderer bruk av den som en sensitiv monitor for intracellulære prosesser via et eGFP -lasersystem laget av en human embryonisk nyrecellelinje. Den første konstruerte levende laseren er laget av en eGFP -uttrykkende celle inne i et reflekterende optisk hulrom og slår den med pulser av blått lys. Ved en viss pulsterskel blir eGFPs optiske utgang lysere og helt jevn i fargen ren grønn med en bølgelengde på 516 nm. Før det sendes ut som laserlys, spretter lyset frem og tilbake i resonatorhulen og passerer cellen mange ganger. Ved å studere endringene i optisk aktivitet kan forskere bedre forstå cellulære prosesser.
GFP brukes mye i kreftforskning for å merke og spore kreftceller. GFP-merkede kreftceller har blitt brukt til å modellere metastaser, prosessen der kreftceller sprer seg til fjerne organer.
Split GFP
GFP kan brukes til å analysere kolokaliseringen av proteiner. Dette oppnås ved å "dele" proteinet i to fragmenter som er i stand til å samle seg selv, og deretter fusjonere hver av disse til de to proteinene av interesse. Disse ufullstendige GFP -fragmentene klarer ikke å fluorescere alene. Imidlertid, hvis de to proteinene av interesse kolokaliserer seg, samles de to GFP-fragmentene for å danne en GFP-lignende struktur som er i stand til å fluorescere. Derfor, ved å måle nivået av fluorescens er det mulig å avgjøre om de to proteiner av interesse colocalize.
Makrofotografering
Makroskala biologiske prosesser, for eksempel spredning av virusinfeksjoner, kan følges ved bruk av GFP-merking. Tidligere har mutagent ultrafiolett lys (UV) blitt brukt til å belyse levende organismer (f.eks. Se) for å oppdage og fotografere GFP -uttrykket. Nylig har en teknikk som bruker ikke-mutagene LED-lys blitt utviklet for makrofotografering. Teknikken bruker et epifluorescens -kameravedlegg basert på det samme prinsippet som ble brukt i konstruksjonen av epifluorescensmikroskoper .
Transgene kjæledyr
Alba , en grønn-fluorescerende kanin, ble opprettet av et fransk laboratorium bestilt av Eduardo Kac ved bruk av GFP for kunstformål og sosiale kommentarer. Det amerikanske selskapet Yorktown Technologies markedsfører til akvariebutikker grønn fluorescerende sebrafisk ( GloFish ) som opprinnelig ble utviklet for å oppdage forurensning i vannveier. NeonPets, et amerikansk selskap, har markedsført grønne fluorescerende mus til kjæledyrindustrien som NeonMice. Grønne fluorescerende griser, kjent som Noels, ble avlet av en gruppe forskere ledet av Wu Shinn-Chih ved Institutt for dyrevitenskap og teknologi ved National Taiwan University . Et japansk-amerikansk team laget grønn-fluorescerende katter som bevis på konseptet for å bruke dem potensielt som modellorganismer for sykdommer, spesielt HIV . I 2009 avlet et sørkoreansk team fra Seoul National University de første transgene beaglene med fibroblastceller fra sjøanemoner. Hundene avgir et rødt fluorescerende lys, og de er ment å tillate forskere å studere genene som forårsaker menneskelige sykdommer som narkolepsi og blindhet.
Kunst
Julian Voss-Andreae , en tyskfødt kunstner som spesialiserer seg på "proteinskulpturer", laget skulpturer basert på strukturen til GFP, inkludert det 1,70 m høye "grønne fluorescerende proteinet" (2004) og 1,40 m ( 4'7 ") høy" Steel Maneter "(2006). Den sistnevnte skulpturen ligger på stedet for GFPs oppdagelse av Shimomura i 1962, University of Washington 's Friday Harbor Laboratories .

Se også
Referanser
Videre lesning
- Pieribone V, Gruber D (2006). Aglow in the Dark: The Revolutionary Science of Biofluorescence . Cambridge: Belknap Press. ISBN 978-0-674-01921-8. OCLC 60321612 . Populærvitenskapelig bok som beskriver historie og oppdagelse av GFP
- Zimmer M (2005). Glowing Genes: A Revolution In Biotechnology . Buffalo, NY: Prometheus Books. ISBN 978-1-59102-253-4. OCLC 56614624 .
Eksterne linker
|
Bibliotekressurser om grønt fluorescerende protein |
- En omfattende artikkel om fluorescerende proteiner på Scholarpedia
- Kort sammendrag av landemerker i GFP
- Interaktiv Java -applet som demonstrerer kjemien bak dannelsen av GFP -kromoforen
- Video fra 2008 Nobelprisforedrag av Roger Tsien om fluorescerende proteiner
- Eksitasjons- og utslippsspektre for forskjellige fluorescerende proteiner
- Green Fluorescent Protein Chem Soc Rev temautgave dedikert til Nobelprisvinnerne i kjemi 2008, professorene Osamu Shimomura , Martin Chalfie og Roger Y. Tsien
- Månedens molekyl, juni 2003 : en illustrert oversikt over GFP av David Goodsell.
- Månedens molekyl, juni 2014 : en illustrert oversikt over GFP-lignende varianter av David Goodsell.
- Grønt fluorescerende protein på FPbase, en fluorescerende proteindatabase
- Oversikt over all strukturell informasjon tilgjengelig i PDB for UniProt : P42212 (grønt fluorescerende protein) på PDBe-KB .