Vaktcelle - Guard cell
Vaktceller er spesialiserte planteceller i overhuden av blader, stengler og andre organer som brukes til å kontrollere gassutveksling. De produseres parvis med et mellomrom mellom dem som danner en stomatalpore. Stomatale porene er størst når vann er fritt tilgjengelig og beskyttelsescellene tørrer , og lukkes når vanntilgjengeligheten er kritisk lav og beskyttelsescellene blir slappe. Fotosyntese avhenger av diffusjonen av karbondioksid (CO 2 ) fra luften gjennom stomata inn i mesofyllvevet . Oksygen (O 2 ), produsert som et biprodukt av fotosyntese, kommer ut av planten via stomata. Når stomata er åpen, går vann tapt ved fordampning og må byttes ut via transpirasjonsstrømmen , med vann tatt opp av røttene. Planter må balansere mengden CO 2 som absorberes fra luften med vanntapet gjennom stomatalporene, og dette oppnås ved både aktiv og passiv kontroll av vaktcelle- turgortrykk og stomatal porestørrelse.
Vaktcellefunksjon
Vaktceller er celler som omgir hver stomi . De hjelper til med å regulere transpirasjonshastigheten ved å åpne og lukke stomata. Lys er hovedutløseren for åpning eller lukking. Hver beskyttelsescelle har en relativt tykk neglebånd på poresiden og en tynn overfor den. Når vann kommer inn i cellen, buler den tynne siden utover som en ballong og trekker den tykke siden sammen med den og danner en halvmåne; de kombinerte halvmånene danner åpningen av porene.
Vaktceller inneholder fototropinproteiner som er serin- og treoninkinaser med blålys fotoreseptoraktivitet. Fototrofiner inneholder to domener for lys, oksygen og spenningssensor (LOV), og er en del av superfamilien PAS-domene. Fototropiner utløser mange responser som fototropisme, kloroplastbevegelse og bladutvidelse samt stomatalåpning. Det var ikke mye kjent om hvordan disse fotoreseptorene fungerte før rundt 1998. Mekanismen som fototropiner virker med, ble belyst gjennom eksperimenter med bredbønne ( Vicia faba ). Immunodeteksjon og fjern-vestlig blotting viste at blått lys stimulerer fototropin 1 og fototropin 2, noe som får proteinfosfatase 1 til å starte en fosforyleringskaskade, som aktiverer H + -ATPase, en pumpe som er ansvarlig for å pumpe H + -ioner ut av cellen. Den fosforylerte H + -ATPase tillater binding av et 14-3-3 protein til et autoinhiberende domene av H + -ATPase ved C-enden. Serin og treonin fosforyleres deretter i proteinet, noe som induserer H + -ATPase-aktivitet. Det samme eksperimentet fant også at ved fosforylering ble et 14-3-3 protein bundet til fototropiner før H + -ATPase var blitt fosforylert. I et lignende eksperiment konkluderte de med at bindingen av 14-3-3 protein til fosforyleringsstedet er viktig for aktivering av plasmamembran H + -ATPase-aktivitet. Dette ble gjort ved å tilsette fosfopeptider som P-950, som hemmer bindingen av 14-3-3 protein, til fosforylerte H + -ATPase og observere aminosyresekvensen. Når protoner pumpes ut, ble det dannet et negativt elektrisk potensial over plasmamembranen. Denne hyperpolarisering av membranen tillot oppsamling av ladet kalium (K + ) ioner og klorid (Cl - ) ioner, som i sin tur øker den konsentrasjon av oppløste stoffer slik at vann potensiale til å avta. Det negative vannpotensialet gjør det mulig for osmose å oppstå i beskyttelsescellen, slik at vann kommer inn, slik at cellen blir turgid.
Åpning og lukking av stomatalporen medieres av endringer i turgortrykket til de to beskyttelsescellene. Turgortrykket til beskyttelsesceller styres av bevegelser av store mengder ioner og sukker inn og ut av beskyttelsescellene. Vaktceller har cellevegger av ulik tykkelse (dens indre region, ved siden av stomatalporen er tykkere og sterkt kutinisert) og ulik orienterte cellulosemikrofibre, noe som får dem til å bøye seg utover når de er tørre, noe som igjen får munnåpning. Stomata lukkes når det er et osmotisk tap av vann, som oppstår fra tap av K + til naboceller, hovedsakelig kalium (K + ) -ioner
Vanntap og vannbruk effektivitet
Vannstress (tørke og saltstress) er et av de største miljøproblemene som forårsaker store tap i landbruket og i naturen. Tørketoleranse for planter formidles av flere mekanismer som fungerer sammen, inkludert å stabilisere og beskytte planten mot skader forårsaket av uttørking, og også kontrollere hvor mye vannplanter taper gjennom stomatale porene under tørke. Et plantehormon, abscisic acid (ABA), produseres som svar på tørke. En hovedtype ABA-reseptor er identifisert. Plantehormonet ABA får stomatale porene til å stenge som svar på tørke, noe som reduserer vanntap fra planter via transpirasjon til atmosfæren og lar planter unngå eller redusere vanntap under tørke. Bruk av tørketolerante avlingsplanter vil føre til reduksjon i avlingstap under tørke. Siden beskyttelsesceller kontrollerer vanntap av planter, kan undersøkelsen av hvordan stomatalåpning og -lukking reguleres føre til utvikling av planter med forbedret unngåelse eller treghet av uttørking og bedre vannbruk . Forskning utført Jean-Pierre Rona viser at ABA er utløseren for stenging av stomatalåpningen. For å utløse dette aktiverer det frigjøring av anioner og kaliumioner. Denne tilstrømningen av anioner forårsaker en depolarisering av plasmamembranen. Denne depolarisasjonen utløser kalium pluss ioner i cellen for å forlate cellen på grunn av ubalansen i membranpotensialet. Denne plutselige endringen i ionekonsentrasjoner får beskyttelsescellen til å krympe, noe som får stomata til å lukkes, som igjen reduserer mengden vann som går tapt. Alt dette er en kjedereaksjon ifølge hans forskning. Økningen i ABA fører til at det er en økning i kalsiumionkonsentrasjonen. Selv om de først trodde det var en tilfeldighet, oppdaget de senere at denne kalsiumøkningen er viktig. De fant at Ca2 + -ioner er involvert i aktivering av anionkanaler, som gjør det mulig for anioner å strømme inn i beskyttelsescellen. De er også involvert i å forby proton ATPase fra å korrigere og hindre at membranen blir depolarisert. For å støtte hypotesen om at kalsium var ansvarlig for alle disse endringene i cellen, gjorde de et eksperiment der de brukte proteiner som hemmet kalsiumionene for å bli produsert. Hvis deres antagelse om at kalsium er viktig i disse prosessene, ville de se at med hemmerne ville de se mindre av følgende ting. Antagelsen deres var riktig, og da inhibitorene ble brukt, så de at proton ATPase fungerte bedre for å balansere depolarisering. De fant også at strømmen av anioner inn i vaktcellene ikke var like sterk. Dette er viktig for å få ioner til å strømme inn i beskyttelsescellen. Disse to tingene er avgjørende for å få stomatalåpningen til å lukke for å forhindre vanntap for planten.
Opptak og frigjøring av ioner
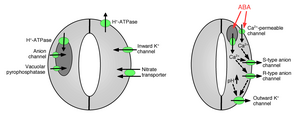
Ionopptak i beskyttelsesceller forårsaker stomatal åpning: Åpningen av gassutvekslingsporer krever opptak av kaliumioner i beskyttelsesceller. Kaliumkanaler og pumper er identifisert og vist å fungere i opptak av ioner og åpning av stomatale åpninger. Ionfrigjøring fra beskyttelsesceller forårsaker stomatal porelukking: Andre ionekanaler er identifisert som medierer frigjøring av ioner fra beskyttelsesceller, noe som resulterer i osmotisk vannutstrømning fra beskyttelsesceller på grunn av osmose , krymping av beskyttelsescellene og lukking av stomatale porer ( Figur 1 og 2). Spesialiserte kaliumutstrømningskanaler deltar i formidling av frigjøring av kalium fra beskyttelsesceller. Anionkanaler ble identifisert som viktige kontrollere for stomatallukking. Anionkanaler har flere hovedfunksjoner for å kontrollere stomatallukking: (a) De tillater frigjøring av anioner, slik som klorid og malat fra beskyttelsesceller, som er nødvendig for stomatallukking. (b) Anionkanaler aktiveres av signaler som forårsaker stomatal lukking, for eksempel av intracellulært kalsium og ABA. Den resulterende frigjøringen av negativt ladede anioner fra beskyttelsesceller resulterer i en elektrisk forskyvning av membranen til mer positive spenninger ( depolarisering ) ved den intracellulære overflaten av beskyttelsescellens plasmamembran . Denne elektriske depolarisasjonen av beskyttelsesceller fører til aktivering av de ytre kaliumkanalene og frigjøring av kalium gjennom disse kanalene. Minst to hovedtyper av anionkanaler har blitt karakterisert i plasmamembranen: anionkanaler av S-type og anionkanaler av R-type.
Vacuolar iontransport
Vakuoler er store intracellulære lagringsorganeller i planter celler. I tillegg til ionekanalene i plasmamembranen har vakuolare ionekanaler viktige funksjoner i regulering av stomatal åpning og lukking fordi vakuoler kan oppta opptil 90% av beskyttelsescellens volum. Derfor frigjøres flertallet av ioner fra vakuoler når stomata lukkes. Vascuolar K + (VK) kanaler og raske vakuolære kanaler kan formidle K + frigjøring fra vakuoler. Vacuolar K + (VK) -kanaler aktiveres ved høyde i den intracellulære kalsiumkonsentrasjonen. En annen type kalsiumaktivert kanal, er den langsomme vakuolarkanalen (SV). SV-kanaler har vist seg å fungere som kationskanaler som er gjennomtrengelige for Ca 2+ ioner, men deres eksakte funksjoner er ennå ikke kjent i planter.
Vaktceller kontrollerer gassutveksling og ionebytte gjennom åpning og lukking. K + er et ion som flyter både inn i og ut av cellen, og får en positiv ladning til å utvikle seg. Malate er en av hovedanionene som brukes til å motvirke denne positive ladningen, og den beveges gjennom AtALMT6-ionekanalen. AtALMT6 er en aluminiumaktivert malattransportør som finnes i beskyttelsesceller, spesielt i vakuolene. Denne transportkanalen ble funnet å forårsake enten tilstrømning eller utstrømning av malat avhengig av konsentrasjonen av kalsium. I en studie av Meyer et al ble det utført patch-clamp-eksperimenter på mesofyllvakuoler fra arabidopsis rdr6-11 (WT) og arabidopsis som overuttrykker AtALMT6-GFP. Det ble funnet fra disse eksperimentene at det i WT bare var små strømmer når kalsiumioner ble introdusert, mens det i AtALMT6-GFP-mutanten ble observert en enorm innadgående likestrøm. Når transportøren blir slått ut av vakuoler fra beskyttelsesceller, er det en betydelig reduksjon i malatstrøm. Strømmen går fra en enorm innadgående strøm til ikke mye annerledes enn WT, og Meyer et al antydet at dette skyldes gjenværende malatkonsentrasjoner i vakuolen. Det er også en lignende respons i knockoutmutantene mot tørke som i WT. Det ble ikke observert noen fenotypisk forskjell mellom knockout-mutantene, villtypen eller AtALMT6-GFP-mutantene, og den eksakte årsaken til dette er ikke helt kjent.
Signaltransduksjon
Vaktceller oppfatter og behandler miljømessige og endogene stimuli som lys, fuktighet, CO 2 konsentrasjon, temperatur, tørke og plantehormoner for å utløse cellulære responser som resulterer i stomatal åpning eller lukking. Disse signaloverføringsveiene bestemmer for eksempel hvor raskt en plante vil miste vann i en tørkeperiode. Vaktceller har blitt en modell for enkelcellesignalering. Ved å bruke Arabidopsis thaliana har etterforskningen av signalbehandling i enkeltbeskyttelsesceller blitt åpen for kraften til genetikk . Cytosoliske og kjernefysiske proteiner og kjemiske budbringere som fungerer i stomatale bevegelser er identifisert som formidler transduksjon av miljøsignaler og styrer dermed CO 2 -inntaket i planter og plantetapstap. Forskning på transduksjonsmekanismer for vaktceller gir forståelse for hvordan planter kan forbedre deres respons på tørkestress ved å redusere vanntap fra planter. Vaktceller gir også en utmerket modell for grunnleggende studier om hvordan en celle integrerer mange typer inngangssignaler for å produsere en respons (stomatal åpning eller lukking). Disse svarene krever koordinering av en rekke cellebiologiske prosesser i beskyttelsesceller, inkludert signalmottak, ionekanal- og pumperegulering, membranhandel , transkripsjon , omlegging av skjelett og mer. En utfordring for fremtidig forskning er å tildele funksjonene til noen av de identifiserte proteinene til disse forskjellige cellebiologiske prosessene.
Utvikling
Under utviklingen av planteblader skiller de spesialiserte vaktcellene seg fra "vaktmoderceller". Tettheten av stomatalporene i blader reguleres av miljøsignaler, inkludert økende atmosfærisk CO 2 -konsentrasjon, noe som reduserer tettheten av stomatalporer i bladoverflaten i mange plantearter ved for tiden ukjente mekanismer. Genetikken til stomatal utvikling kan studeres direkte ved avbildning av bladepidermis ved hjelp av et mikroskop. Flere viktige kontrollproteiner som fungerer i en vei som formidler utviklingen av beskyttelsesceller og stomatale porene er identifisert.