Høyytende væskekromatografi - High-performance liquid chromatography
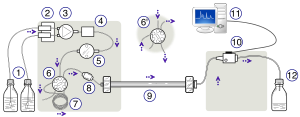
 Et HPLC -oppsett; Fra venstre til høyre: En pumpeinnretning som genererer en gradient av to forskjellige løsningsmidler- en stålsikret kolonne og en detektor for måling av absorbansen.
| |
| Akronym | HPLC |
|---|---|
| Klassifisering | Kromatografi |
| Analytiker |
organiske molekyler biomolekyler ioner polymerer |
| Andre teknikker | |
| I slekt |
Kromatografi Vandig normal-fase-kromatografi hydrofil reaksjonskromatografi lonebytterkromatografi størrelseseksklusjonskromatografi Micellar væskekromatografi |
| Bindestrek | Væskekromatografi-massespektrometri |
Høyytende væskekromatografi ( HPLC ), tidligere referert til som høytrykksvæskekromatografi , er en teknikk innen analytisk kjemi som brukes til å skille, identifisere og kvantifisere hver komponent i en blanding. Den avhenger av pumper til å passere en trykksatt flytende løsemiddel som inneholder prøveblandingen gjennom en kolonne fylt med en fast adsorbent materiale . Hver komponent i prøven interagerer litt ulikt med det adsorberende materialet, forårsaker forskjellige strømningshastigheter for de forskjellige komponentene og fører til separasjon av komponentene når de strømmer ut av kolonnen.
HPLC har blitt brukt til produksjon ( f.eks . Under produksjonsprosessen av farmasøytiske og biologiske produkter), juridiske ( f.eks . Påvisning av prestasjonsforbedrende legemidler i urin), forskning ( f.eks . Separering av komponentene i en kompleks biologisk prøve eller lignende syntetiske kjemikalier fra hverandre), og medisinske ( f.eks . deteksjon av vitamin D -nivåer i blodserum).
Kromatografi kan beskrives som en masseoverføringsprosess som involverer adsorpsjon . HPLC er avhengig av pumper for å føre en væske under trykk og en prøveblanding gjennom en kolonne fylt med adsorbent, noe som fører til separering av prøvekomponentene. Den aktive komponenten i kolonnen, adsorbenten, er vanligvis et granulært materiale laget av faste partikler ( f.eks . Silika , polymerer, etc.), 2–50 um i størrelse. Komponentene i prøveblandingen skilles fra hverandre på grunn av deres forskjellige grader av interaksjon med de adsorberende partiklene. Væsken under trykk er vanligvis en blanding av løsningsmidler ( f.eks . Vann, acetonitril og/eller metanol) og omtales som en "mobil fase". Sammensetningen og temperaturen spiller en stor rolle i separasjonsprosessen ved å påvirke samspillet mellom prøvekomponenter og adsorbent. Disse interaksjonene er fysiske, for eksempel hydrofob (dispersiv), dipol -dipol og ionisk, oftest en kombinasjon.
HPLC skiller seg fra tradisjonell ("lavtrykk") væskekromatografi fordi driftstrykket er betydelig høyere (50–350 bar), mens vanlig væskekromatografi vanligvis er avhengig av tyngdekraften for å passere mobilfasen gjennom kolonnen. På grunn av den lille prøvestørrelsen som er adskilt i analytisk HPLC, er typiske kolonnedimensjoner 2,1–4,6 mm diameter og 30–250 mm lengde. HPLC -kolonner er også laget med mindre adsorberende partikler (2–50 um i gjennomsnittlig partikkelstørrelse). Dette gir HPLC overlegen oppløsningsevne (evnen til å skille mellom forbindelser) ved separering av blandinger, noe som gjør den til en populær kromatografisk teknikk.
Skjematikken til et HPLC -instrument inkluderer vanligvis en avgasser, prøvetaker, pumper og en detektor. Prøvetakeren bringer prøveblandingen inn i den mobile fasestrømmen som fører den inn i kolonnen. Pumpene leverer ønsket flyt og sammensetning av mobilfasen gjennom kolonnen. Detektoren genererer et signal som er proporsjonalt med mengden av prøvekomponenter som kommer ut fra kolonnen, og dermed tillater kvantitativ analyse av prøvekomponentene. En digital mikroprosessor og brukerprogramvare styrer HPLC -instrumentet og gir dataanalyse. Noen modeller av mekaniske pumper i et HPLC-instrument kan blande flere løsningsmidler sammen i forhold på endring i tid, å generere en sammensetning gradient i den mobile fasen. Ulike detektorer er i vanlig bruk, for eksempel UV/Vis , fotodiodearray (PDA) eller basert på massespektrometri . De fleste HPLC -instrumenter har også en kolonneovn som gjør det mulig å justere temperaturen som separasjonen utføres ved.
Operasjon
Prøveblandingen som skal skilles og analyseres, innføres i et diskret lite volum (typisk mikroliter) i strømmen av mobilfase som perkolerer gjennom kolonnen. Komponentene i prøven beveger seg gjennom kolonnen med forskjellige hastigheter, som er en funksjon av spesifikke fysiske interaksjoner med adsorbenten (også kalt stasjonær fase). Hastigheten til hver komponent avhenger av dens kjemiske natur, av naturen til den stasjonære fasen (kolonnen) og sammensetningen av den mobile fasen. Tiden da en bestemt analyt eluerer (kommer ut av kolonnen) kalles dens retensjonstid. Oppbevaringstiden målt under spesielle forhold er en identifiserende egenskap for en gitt analyt.
Mange forskjellige typer kolonner er tilgjengelige, fylt med adsorbenter som varierer i partikkelstørrelse, porøsitet og overflatekjemi. Bruk av pakningsmaterialer med mindre partikkelstørrelser krever bruk av høyere driftstrykk ("mottrykk") og forbedrer vanligvis kromatografisk oppløsning (graden av toppseparasjon mellom påfølgende analytter som kommer fra kolonnen). Sorbentpartikler kan være hydrofobe eller polare.
Vanlige mobile faser som brukes inkluderer enhver blandbar kombinasjon av vann med forskjellige organiske løsningsmidler (de vanligste er acetonitril og metanol ). Noen HPLC-teknikker bruker vannfrie mobilfaser (se normalfasekromatografi nedenfor). Den vandige komponenten i mobilfasen kan inneholde syrer (slik som maursyre, fosforsyre eller trifluoreddiksyre ) eller salter for å hjelpe til med separasjonen av prøvekomponentene. Sammensetningen av mobilfasen kan holdes konstant ("isokratisk elueringsmodus") eller variert ("gradientelueringsmodus") under den kromatografiske analysen. Isokratisk eluering er vanligvis effektiv ved separering av prøvekomponenter som er veldig forskjellige i sin affinitet for den stasjonære fasen. Ved gradienteluering varieres sammensetningen av mobilfasen typisk fra lav til høy elueringsstyrke. Elueringsstyrken til mobilfasen gjenspeiles av analytretensjonstider med høy elueringsstyrke som gir rask eluering (= korte retensjonstider). En typisk gradientprofil ved omvendt fasekromatografi kan starte ved 5% acetonitril (i vann eller vandig buffer) og gå lineært til 95% acetonitril i løpet av 5–25 minutter. Perioder med konstant mobilfasesammensetning kan være en del av enhver gradientprofil. For eksempel kan mobilfasesammensetningen holdes konstant ved 5% acetonitril i 1-3 minutter, etterfulgt av en lineær endring opp til 95% acetonitril.

Den valgte sammensetningen av mobilfasen avhenger av intensiteten av interaksjoner mellom forskjellige prøvekomponenter ("analytter") og stasjonær fase ( f.eks . Hydrofobe interaksjoner i revers-fase HPLC). Avhengig av deres affinitet for de stasjonære og mobile fasene, analyserer partisjonen mellom de to under separasjonsprosessen som finner sted i kolonnen. Denne delingsprosessen ligner den som skjer under en væske-væske-ekstraksjon, men er kontinuerlig, ikke trinnvis. I dette eksemplet, ved bruk av en vann/acetonitril -gradient, elueres flere hydrofobe komponenter (kommer av kolonnen) sent, når mobilfasen blir mer konsentrert i acetonitril ( dvs. i en mobil fase med høyere elueringsstyrke).
Valget av mobile fasekomponenter, tilsetningsstoffer (som salter eller syrer) og gradientforhold avhenger av arten av kolonnen og prøvekomponentene. Ofte utføres en serie prøvekjøringer med prøven for å finne HPLC -metoden som gir tilstrekkelig separasjon.
Historie og utvikling
Før HPLC brukte forskere standard væskekromatografiske teknikker. Væskekromatografiske systemer var stort sett ineffektive på grunn av at strømningshastigheten til løsningsmidler var avhengig av tyngdekraften. Separasjoner tok mange timer, og noen ganger dager å fullføre. Gaskromatografi (GC) på den tiden var kraftigere enn væskekromatografi (LC), men det ble antatt at gassfaseseparasjon og analyse av meget polare høymolekylære biopolymerer var umulig. GC var ineffektivt for mange biokjemikere på grunn av den termiske ustabiliteten til oppløste stoffer. Som et resultat ble det antatt alternative metoder som snart ville resultere i utviklingen av HPLC.
Etter det sentrale arbeidet til Martin og Synge i 1941, ble det spådd av Cal Giddings, Josef Huber og andre på 1960-tallet at LC kunne opereres i høyeffektiv modus ved å redusere paknings-partikkeldiameteren vesentlig under den typiske LC (og GC) nivå på 150 μm og bruk av trykk for å øke den mobile fasehastigheten. Disse spådommene gjennomgikk omfattende eksperimentering og foredling gjennom 60 -tallet og inn på 70 -tallet. Tidlig utviklingsforskning begynte å forbedre LC -partikler, og oppfinnelsen av Zipax, en overfladisk porøs partikkel, var lovende for HPLC -teknologi.
1970 -tallet medførte mange utviklinger innen maskinvare og instrumentering. Forskere begynte å bruke pumper og injektorer for å lage en rudimentær design av et HPLC -system. Gassforsterkerpumper var ideelle fordi de opererte med konstant trykk og ikke krevde lekkasjefrie tetninger eller tilbakeslagsventiler for jevn strømning og god kvantifisering. Maskinvare-milepæler ble gjort ved Dupont IPD (Industrial Polymers Division), for eksempel en gradient-enhet med lavt volum som ble brukt, samt å erstatte septuminjektoren med en loop-injeksjonsventil.
Selv om instrumentell utvikling var viktig, handler historien til HPLC først og fremst om historien og utviklingen av partikkelteknologi . Etter introduksjonen av porøse lagpartikler har det vært en jevn trend med redusert partikkelstørrelse for å forbedre effektiviteten. Imidlertid oppsto nye problemer ved å redusere partikkelstørrelsen. De praktiske ulempene skyldes det store trykkfallet som trengs for å tvinge mobil væske gjennom kolonnen og vanskeligheten med å forberede en jevn pakning av ekstremt fine materialer. Hver gang partikkelstørrelsen reduseres betydelig, må en ny runde med instrumentutvikling vanligvis skje for å håndtere trykket.
Typer
Partisjonskromatografi

Partisjonskromatografi var en av de første typene kromatografi som kjemikere utviklet. Den Fordelingskoeffisienten prinsipp har vært anvendt i papir-kromatografi , tynnsjiktkromatografi , gassfasen og væske-væske-separasjonsapplikasjoner. Nobelprisen i kjemi fra 1952 ble tjent av Archer John Porter Martin og Richard Laurence Millington Synge for deres utvikling av teknikken, som ble brukt til separering av aminosyrer . Partisjonskromatografi bruker et beholdt løsningsmiddel, på overflaten eller i kornene eller fibrene i en "inert" fast bærermatrise som ved papirkromatografi ; eller utnytter noen coulombisk og/eller hydrogendonor -interaksjon med den stasjonære fasen. Analyttmolekyler skiller mellom en flytende stasjonær fase og elueringsmiddelet. På samme måte som ved hydrofil interaksjonskromatografi (HILIC; en underteknikk innen HPLC), skiller denne metoden analyser basert på forskjeller i polariteten. HILIC bruker oftest en bundet polær stasjonær fase og en mobil fase hovedsakelig laget av acetonitril med vann som den sterke komponenten. Partisjon HPLC har blitt brukt historisk på ikke -bundet silika eller aluminiumoksydstøtter. Hver fungerer effektivt for å skille analytter med relative polare forskjeller. HILIC -bundne faser har fordelen av å skille sure , basiske og nøytrale oppløste stoffer i en enkelt kromatografisk kjøring.
Polaranalytene diffunderer inn i et stasjonært vannsjikt assosiert med den polare stasjonære fasen og beholdes dermed. Jo sterkere samspillet mellom polaranalytten og den polære stasjonære fasen (i forhold til mobilfasen) jo lengre elueringstid. Interaksjonsstyrken avhenger av den funksjonelle gruppedelen av analytmolekylstrukturen, med flere polariserte grupper ( f.eks . Hydroksyl-) og grupper som er i stand til hydrogenbinding som induserer mer retensjon. Coulombiske (elektrostatiske) interaksjoner kan også øke retensjonen. Bruk av flere polare løsningsmidler i mobilfasen vil redusere oppbevaringstiden til analytter, mens flere hydrofobe løsningsmidler har en tendens til å øke retensjonstiden.
Normalfasekromatografi
Normalfasekromatografi var en av de første typene HPLC som kjemikere utviklet. Også kjent som normalfase HPLC (NP-HPLC) denne metoden skiller analytter basert på deres affinitet for en polær stasjonær overflate som silika, derfor er den basert på analytens evne til å engasjere seg i polare interaksjoner (for eksempel hydrogenbinding eller dipol- dipol -type interaksjoner) med sorbentoverflaten. NP-HPLC bruker en ikke-polær, ikke-vandig mobil fase ( f.eks . Kloroform ), og fungerer effektivt for å separere analytter som er lett oppløselige i upolare løsningsmidler. Analyten assosierer seg med og beholdes av den polære stasjonære fasen. Adsorpsjonsstyrker øker med økt analytpolaritet. Interaksjonsstyrken avhenger ikke bare av de funksjonelle gruppene som er tilstede i strukturen til analytmolekylet, men også av steriske faktorer . Effekten av sterisk hindring på interaksjonsstyrke gjør at denne metoden kan løse (separate) strukturelle isomerer .
Bruken av flere polare løsningsmidler i mobilfasen vil redusere oppbevaringstiden for analytter, mens flere hydrofobe løsningsmidler har en tendens til å indusere langsommere eluering (økte retensjonstider). Svært polare løsningsmidler som spor av vann i mobilfasen har en tendens til å adsorbere til den faste overflaten av den stasjonære fasen og danne et stasjonært bundet (vann) lag som anses å spille en aktiv rolle i retensjon. Denne oppførselen er noe særegen ved normalfasekromatografi fordi den nesten utelukkende styres av en adsorptiv mekanisme ( dvs. analytter samhandler med en fast overflate i stedet for med det solvatiserte laget av en ligand festet til sorbentoverflaten; se også revers-fase HPLC nedenfor ). Adsorpsjonskromatografi er fremdeles mye brukt for strukturelle isomerseparasjoner i både kolonne- og tynnsjiktskromatografiformater på aktivert (tørket) silika eller aluminiumoksydunderlag.
Partisjon- og NP-HPLC falt i unåde på 1970-tallet med utviklingen av reversfase- HPLC på grunn av dårlig reproduserbarhet av retensjonstider på grunn av tilstedeværelsen av et vann eller et protisk organisk løsningsmiddellag på overflaten av silika- eller aluminiumoksydkromatografiske medier . Dette laget endres med eventuelle endringer i sammensetningen av mobilfasen ( f.eks . Fuktighetsnivå) som forårsaker drivende retensjonstider.
Nylig har partisjonskromatografi blitt populær igjen med utviklingen av Hiliske bindingsfaser som viser forbedret reproduserbarhet, og på grunn av en bedre forståelse av bruksområdet for teknikken.
Forskyvningskromatografi
Det grunnleggende prinsippet for forskyvningskromatografi er: Et molekyl med høy affinitet for kromatografimatrisen (fortrengeren) vil konkurrere effektivt om bindingssteder, og dermed fortrenge alle molekyler med mindre affiniteter. Det er tydelige forskjeller mellom forskyvning og elueringskromatografi. I elueringsmodus dukker det vanligvis opp stoffer fra en kolonne i smale, gaussiske topper. Bred separasjon av topper, fortrinnsvis til baseline, er ønsket for å oppnå maksimal rensing. Hastigheten med hvilken som helst komponent i en blanding som beveger seg nedover kolonnen i elueringsmodus, avhenger av mange faktorer. Men for at to stoffer skal bevege seg med forskjellige hastigheter og derved bli løst, må det være vesentlige forskjeller i en viss interaksjon mellom biomolekylene og kromatografimatrisen. Driftsparametere justeres for å maksimere effekten av denne forskjellen. I mange tilfeller kan grunnlinjeseparasjon av toppene bare oppnås med gradienteluering og lave kolonnbelastninger. Således er to ulemper ved kromatografi i elueringsmodus, spesielt i den preparative skalaen, driftskompleksitet på grunn av pumping av gradientoppløsningsmiddel og lav gjennomstrømning på grunn av lave kolonnbelastninger. Forskyvningskromatografi har fordeler fremfor elueringskromatografi ved at komponenter løses opp i påfølgende soner av rene stoffer i stedet for "topper". Fordi prosessen drar fordel av ikke -lineariteten til isotermene, kan en større kolonnemating skilles på en gitt kolonne med de rensede komponentene gjenvunnet ved betydelig høyere konsentrasjon.
Omvendt fase kromatografi (RPC)
Omvendt fase HPLC (RP-HPLC) har en ikke-polær stasjonær fase og en vandig, moderat polar mobil fase. En vanlig stasjonær fase er et silisiumdioksyd som er blitt overflatemodifisert med RME 2 SiCl, hvor R er en rettkjedet alkylgruppe slik som C 18 H 37 eller C 8 H 17 . Med slike stasjonære faser er retensjonstiden lengre for molekyler som er mindre polare, mens polare molekyler eluerer lettere (tidlig i analysen). En etterforsker kan øke oppbevaringstiden ved å tilføre mer vann til mobilfasen; derved gjør affiniteten til den hydrofobe analytten for den hydrofobe stasjonære fasen sterkere i forhold til den nå mer hydrofile mobile fasen. På samme måte kan en etterforsker redusere oppbevaringstiden ved å tilsette mer organisk løsningsmiddel til elueringsmiddelet. RP-HPLC er så vanlig at det ofte blir feilaktig referert til som "HPLC" uten ytterligere spesifikasjon. Legemiddelindustrien bruker regelmessig RP-HPLC for å kvalifisere medisiner før de slippes.
RP-HPLC opererer etter prinsippet om hydrofobe interaksjoner, som stammer fra den høye symmetrien i den dipolare vannstrukturen og spiller den viktigste rollen i alle prosesser innen biovitenskap. RP-HPLC tillater måling av disse interaktive kreftene. Bindingen av analytten til den stasjonære fasen er proporsjonal med kontaktoverflaten rundt det ikke-polare segmentet av analytmolekylet ved assosiasjon med liganden på den stasjonære fasen. Denne solvofobe effekten domineres av vannkraften for " hulredsreduksjon " rundt analytten og C 18 -kjeden kontra komplekset av begge. Energien som frigjøres i denne prosessen er proporsjonal med overflatespenningen til elueringsmiddelet (vann: 7,3 × 10 −6 J /cm², metanol: 2,2 × 10 −6 J /cm²) og til den hydrofobe overflaten til henholdsvis analytten og liganden . Retensjonen kan reduseres ved å tilsette et mindre polart løsningsmiddel (metanol, acetonitril ) i mobilfasen for å redusere overflatespenningen til vann. Gradienteluering bruker denne effekten ved automatisk å redusere polariteten og overflatespenningen til den vandige mobile fasen i løpet av analysen.
Strukturelle egenskaper til analytmolekylet spiller en viktig rolle i dets oppbevaringsegenskaper. Generelt beholdes en analyt med et større hydrofobt overflateareal (C – H, C – C og generelt upolare atombindinger, for eksempel SS og andre) lenger fordi den ikke påvirker vannstrukturen. På den annen side, analytter med høyere polare overflateareal (overdratt ved tilstedeværelse av polare grupper, så som -OH, -NH 2 , COO - eller -NH 3 + i sin struktur) er mindre beholdes som de er bedre integrert i vann . Slike interaksjoner er utsatt for steriske effekter ved at svært store molekyler bare kan ha begrenset tilgang til porene i den stasjonære fasen, der interaksjonene med overflateligander (alkylkjeder) finner sted. Slik overflatehindring resulterer vanligvis i mindre retensjon.
Retensjonstiden øker med hydrofobt (upolært) overflateareal. Forgrenede kjedeforbindelser eluerer raskere enn de tilsvarende lineære isomerer fordi det totale overflatearealet er redusert. På samme måte eluerer organiske forbindelser med enkelt C – C bindinger senere enn de med en C = C eller C – C trippelbinding, ettersom dobbelt- eller trippelbindingen er kortere enn en enkelt C – C -binding.
Bortsett fra mobil faseflatespenning (organisasjonsstyrke i elueringsstruktur), kan andre mobile fasemodifikatorer påvirke analytretensjon. For eksempel forårsaker tilsetning av uorganiske salter en moderat lineær økning i overflatespenningen til vandige oppløsninger (ca. 1,5 × 10 −7 J/cm² per Mol for NaCl, 2,5 × 10 −7 J/cm² per Mol for (NH 4 ) 2 SO 4 ), og fordi entropien til analyt-løsningsmiddelgrensesnittet styres av overflatespenning, har tilsetning av salter en tendens til å øke retensjonstiden. Denne teknikken brukes for mild separasjon og utvinning av proteiner og beskyttelse av deres biologiske aktivitet i proteinanalyse (hydrofob interaksjonskromatografi, HIC).
En annen viktig faktor er mobilfase -pH siden den kan endre analyttens hydrofobe karakter. Av denne grunn bruker de fleste metoder et buffermiddel , for eksempel natriumfosfat , for å kontrollere pH. Buffere tjener flere formål: kontroll av pH, nøytralisere ladningen på silikaoverflaten i den stasjonære fasen og fungere som ionparingsmidler for å nøytralisere analytladning. Ammoniumformiat blir ofte lagt i massespektrometri for å forbedre deteksjon av visse analytter ved dannelsen av analytt-ammonium- addukter . En flyktig organisk syre som eddiksyre , eller oftest maursyre , blir ofte tilsatt til mobilfasen hvis massespektrometri brukes til å analysere kolonneelueringsmiddelet. Trifluoreddiksyre brukes sjelden i massespektrometri -applikasjoner på grunn av dens utholdenhet i detektoren og løsningsmiddelsystemet, men kan være effektivt for å forbedre retensjonen av analytter som karboksylsyrer i applikasjoner som bruker andre detektorer, ettersom det er en ganske sterk organisk syre. Virkningene av syrer og buffere varierer etter anvendelse, men forbedrer generelt kromatografisk oppløsning.
Omvendte fasekolonner er ganske vanskelig å skade sammenlignet med vanlige silisiumkolonner; Imidlertid består mange reversfasekolonner av alkylderivatiserte silikapartikler og bør aldri brukes med vandige baser, da disse vil ødelegge den underliggende silika -partikkelen. De kan brukes med vandig syre, men kolonnen bør ikke utsettes for syren for lenge, da den kan tære metalldelene i HPLC -utstyret. RP-HPLC-kolonner skal skylles med rent løsemiddel etter bruk for å fjerne resterende syrer eller buffere, og lagres i en passende løsningsmiddelblanding. Metallinnholdet i HPLC -kolonner må holdes lavt for å beholde best mulig evne til å skille stoffer. En god test for metallinnholdet i en kolonne er å injisere en prøve som er en blanding av 2,2'- og 4,4'- bipyridin . På grunn av at 2,2'-bipy kan chelatere metall, vil formen av toppen for den 2,2'-bipy bli forvrengt (halet) når metallioner er tilstede på overflaten av silika ...
Størrelsesekskluderingskromatografi
Størrelsesekskluderingskromatografi (SEC), også kjent som gelgjennomtrengningskromatografi eller gelfiltreringskromatografi , skiller partikler på grunnlag av molekylær størrelse (faktisk ved en partikkels Stokes radius ). Det er generelt en lavoppløselig kromatografi, og det er derfor ofte forbeholdt det siste, "polerende" trinnet i rensingen. Det er også nyttig for å bestemme den tertiære strukturen og den kvartære strukturen til rensede proteiner. SEC brukes først og fremst til analyse av store molekyler som proteiner eller polymerer. SEC fungerer ved å fange disse mindre molekylene i porene i en partikkel. De større molekylene går rett og slett forbi porene da de er for store til å komme inn i porene. Større molekyler flyter derfor raskere gjennom kolonnen enn mindre molekyler, det vil si at jo mindre molekylet er, jo lengre oppbevaringstid.
Denne teknikken er mye brukt for molekylvektbestemmelse av polysakkarider. SEC er den offisielle teknikken (foreslått av europeisk farmakopeia) for sammenligning av molekylvekt av forskjellige kommersielt tilgjengelige lavmolekylære hepariner .
Ionbytte-kromatografi
Ved ionebytterkromatografi (IC) er retensjon basert på tiltrekningen mellom oppløste ioner og ladede steder bundet til den stasjonære fasen. Oppløste ioner av samme ladning som de ladede stedene i kolonnen er ekskludert fra binding, mens oppløste ioner av den motsatte ladningen til de ladede stedene i kolonnen beholdes på kolonnen. Oppløste ioner som beholdes på kolonnen kan elueres fra kolonnen ved å endre løsningsmiddelbetingelsene ( f.eks . Øke ioneffekten av løsningsmiddelsystemet ved å øke saltkonsentrasjonen av løsningen, øke kolonnetemperaturen, endre pH i løsningsmidlet , etc.).
Typer av ionbyttere inkluderer polystyrenharpikser, cellulose- og dekstranionbyttere (geler) og kontrollert poreglass eller porøst silika. Polystyrenharpikser tillater tverrbinding som øker kjedens stabilitet. Høyere tverrbinding reduserer svingning, noe som øker likevektstiden og til slutt forbedrer selektiviteten. Cellulose- og dekstranionbyttere har større porestørrelser og lave ladningstettheter, noe som gjør dem egnet for proteinseparasjon
Generelt favoriserer ionbytterne bindingen av ioner med høyere ladning og mindre radius.
En økning i motion (med hensyn til de funksjonelle gruppene i harpikser) konsentrasjon reduserer retensjonstiden. En nedgang i pH reduserer retensjonstiden i kationbytte mens en økning i pH reduserer retensjonstiden i anionbytter. Ved å senke løsningsmidlets pH i en kationbytterkolonne, er for eksempel flere hydrogenioner tilgjengelig for å konkurrere om posisjoner på den anioniske stasjonære fasen, og eluerer dermed svakt bundne kationer.
Denne formen for kromatografi er mye brukt i følgende applikasjoner: vannrensing, forkonsentrasjon av sporkomponenter, ligandbytningskromatografi, ionebytterkromatografi av proteiner, anionbytterkromatografi med høy pH av karbohydrater og oligosakkarider og andre.
Bioaffinitetskromatografi
Denne kromatografiske prosessen er avhengig av egenskapen til biologisk aktive stoffer for å danne stabile, spesifikke og reversible komplekser. Dannelsen av disse kompleksene involverer deltakelse av vanlige molekylære krefter som Van der Waals-interaksjonen , elektrostatisk interaksjon, dipol-dipol-interaksjon, hydrofob interaksjon og hydrogenbindingen. En effektiv, biospesifikk binding dannes ved en samtidig og samordnet handling av flere av disse kreftene på de komplementære bindingsstedene.
Vandig normalfasekromatografi
Vandig normalfasekromatografi (ANP) er en kromatografisk teknikk som omfatter mobilfaseregionen mellom reversfasekromatografi (RP) og organisk normalfasekromatografi (ONP). Denne teknikken brukes for å oppnå unik selektivitet for hydrofile forbindelser, som viser normal faseeluering ved bruk av omvendte fase løsemidler.
Isokratisk og gradienteluering
En separasjon der mobilfasesammensetningen forblir konstant gjennom hele prosedyren kalles isokratisk (betyr konstant sammensetning ). (Eksemplet på disse andelen metanol gjennom hele prosedyren vil forbli konstant dvs. 10%) Ordet ble laget av Csaba Horvath som var en av pionerene for HPLC.,
Mobilfasesammensetningen trenger ikke å forbli konstant. En separasjon der mobilfasesammensetningen endres under separasjonsprosessen beskrives som en gradienteluering . Ett eksempel er en gradient som starter med 10% metanol og slutter på 90% metanol etter 20 minutter. De to komponentene i mobilfasen kalles vanligvis "A" og "B"; A er det "svake" løsningsmidlet som lar oppløsningen bare eluere sakte, mens B er det "sterke" løsningsmidlet som raskt eluerer oppløste stoffer fra kolonnen. Ved omvendt fase-kromatografi er løsningsmiddel A ofte vann eller en vandig buffer, mens B er et organisk løsningsmiddel som kan blandes med vann, for eksempel acetonitril , metanol, THF eller isopropanol .
Ved isokratisk eluering øker toppbredden med retensjonstiden lineært i henhold til ligningen for N, antall teoretiske plater. Dette fører til ulempen at sen-eluerende topper blir veldig flate og brede. Formen og bredden kan hindre dem i å bli anerkjent som topper.
Gradienteluering reduserer retensjonen til de senere eluerende komponentene slik at de eluerer raskere, noe som gir smalere (og høyere) topper for de fleste komponenter. Dette forbedrer også toppformen for haletopper, ettersom den økende konsentrasjonen av det organiske elueringsmiddel skyver haledelen av en topp fremover. Dette øker også topphøyden (toppen ser "skarpere" ut), noe som er viktig i sporanalyse. Gradientprogrammet kan inneholde plutselige "trinn" -økninger i prosentandelen av den organiske komponenten, eller forskjellige bakker på forskjellige tidspunkter - alt etter ønsket om optimal separasjon på minimumstid.
I isokratisk eluering endres ikke selektiviteten hvis kolonnedimensjonene (lengde og indre diameter) endres - det vil si at toppene eluerer i samme rekkefølge. Ved gradienteluering kan elueringsrekkefølgen endres etter hvert som dimensjonene eller strømningshastigheten endres.
Drivkraften i omvendt fasekromatografi har sin opprinnelse i vannordens høye rekkefølge. Rollen til den organiske komponenten i mobilfasen er å redusere denne høye ordenen og dermed redusere den vandige komponentens forsinkelsesstyrke.
Parametere
Teoretisk
HPLC -separasjoner har teoretiske parametere og ligninger for å beskrive separasjonen av komponenter i signaltopper når det oppdages ved instrumentering, for eksempel av en UV -detektor eller et massespektrometer. Parametrene er i stor grad avledet fra to sett med kromatagrafisk teori: plateteori (som en del av partisjonskromatografi ) og hastighetsteorien om kromatografi / Van Deemter -ligning . Selvfølgelig kan de settes i praksis gjennom analyse av HPLC -kromatogrammer, selv om hastighetsteori anses som den mer nøyaktige teorien.
De er analoge med beregningen av retensjonsfaktor for en papirkromatografisk separasjon, men beskriver hvor godt HPLC skiller en blanding i to eller flere komponenter som oppdages som topper (bånd) på et kromatogram. HPLC -parameterne er: effektivitetsfaktor ( N ), retensjonsfaktor (kappa prime) og separasjonsfaktor (alfa). Sammen er faktorene variabler i en oppløsningsligning, som beskriver hvor godt to komponenters topper separerte eller overlappet hverandre. Disse parametrene brukes stort sett bare for å beskrive HPLC -reversfase- og HPLC -normale faseseparasjoner, siden disse separasjonene har en tendens til å være mer subtile enn andre HPLC -moduser ( f.eks . Ionbytte og størrelsesekskludering).
Tomrumsvolum er mengden plass i en kolonne som er opptatt av løsningsmiddel. Det er plassen i kolonnen som er utenfor kolonnens indre emballasjemateriale. Tomrumsvolum måles på et kromatogram som den første komponenttoppen detektert, som vanligvis er løsningsmidlet som var tilstede i prøveblandingen; ideelt sett flyter prøveoppløsningsmidlet gjennom kolonnen uten å samhandle med kolonnen, men er fortsatt påviselig som forskjellig fra HPLC -løsningsmidlet. Tomrumsvolumet brukes som en korrigeringsfaktor.
Effektivitetsfaktor ( N ) måler praktisk talt hvor skarpe komponenttopper på kromatogrammet er, som forholdet mellom komponenttoppens areal ("retensjonstid") i forhold til bredden på toppene på det bredeste punktet (ved grunnlinjen). Topper som er høye, skarpe og relativt smale indikerer at separasjonsmetoden effektivt fjernet en komponent fra en blanding; høy effektivitet. Effektiviteten er veldig avhengig av HPLC -kolonnen og HPLC -metoden som brukes. Effektivitetsfaktor er synonymt med platenummer og 'antall teoretiske plater'.
Retensjonsfaktor ( kappa prime ) måler hvor lenge en komponent av blandingen sitter fast i kolonnen, målt ved arealet under kurven for toppen i et kromatogram (siden HPLC -kromatogrammer er en funksjon av tiden). Hver kromatogramtopp vil ha sin egen retensjonsfaktor ( f.eks . Kappa 1 for retensjonsfaktoren for den første toppen). Denne faktoren kan korrigeres for av hulromets volum.
Separasjonsfaktor ( alfa ) er en relativ sammenligning av hvor godt to nabokomponenter i blandingen ble skilt ( dvs. to nabobånd på et kromatogram). Denne faktoren er definert i forhold til et forhold mellom retensjonsfaktorene for et par av nabokromatogramtoppene, og kan også korrigeres for hulromets volum. Jo større separasjonsfaktorverdien er over 1,0, desto bedre blir separasjonen, til ca. 2,0 utover det sannsynligvis ikke er nødvendig med en HPLC -metode for separasjon. Oppløsningsligninger relaterer de tre faktorene slik at høy effektivitet og separasjonsfaktorer forbedrer oppløsningen av komponenttopper i en HPLC -separasjon.
Innvendig diameter
Den indre diameteren (ID) til en HPLC -kolonne er en viktig parameter som påvirker detekteringsfølsomheten og separasjonsselektiviteten i gradienteluering. Den bestemmer også mengden analyt som kan lastes på kolonnen. Større kolonner sees vanligvis i industrielle applikasjoner, for eksempel rensing av et legemiddelprodukt for senere bruk. Kolonner med lav ID har forbedret følsomhet og lavere løsemiddelforbruk på bekostning av lastekapasitet.
Større ID -søyler (over 10 mm) brukes til å rense brukbare mengder materiale på grunn av deres store lastekapasitet.
Analytiske skala -kolonner (4,6 mm) har vært den vanligste typen kolonner, selv om mindre kolonner raskt øker i popularitet. De brukes i tradisjonell kvantitativ analyse av prøver og bruker ofte en UV-Vis absorbansdetektor .
Smalborede kolonner (1-2 mm) brukes til applikasjoner når mer følsomhet er ønsket enten med spesielle UV-vis-detektorer, fluorescensdeteksjon eller med andre deteksjonsmetoder som væskekromatografi-massespektrometri
Kapillærkolonner (under 0,3 mm) brukes nesten utelukkende med alternative deteksjonsmidler som massespektrometri . De er vanligvis laget av smeltede silikakapillærer, i stedet for rørene i rustfritt stål som større kolonner bruker.
Partikkelstørrelse
Mest tradisjonell HPLC utføres med den stasjonære fasen festet til utsiden av små sfæriske silikapartikler (veldig små perler). Disse partiklene kommer i en rekke størrelser med 5 µm perler som er de vanligste. Mindre partikler gir generelt mer overflateareal og bedre separasjoner, men trykket som kreves for optimal lineær hastighet øker med inversen av partikkeldiameteren i kvadrat.
I henhold til ligningene for kolonnehastigheten, effektiviteten og mottrykket , reduserer partikkeldiameteren til det halve og holder størrelsen på kolonnen den samme, dobler kolonnehastigheten og effektiviteten; men øker mottrykket fire ganger. Og de små partiklene HPLC kan også redusere breddeutvidelsen. Større partikler brukes i preparativ HPLC (kolonnediametere 5 cm opp til> 30 cm) og til ikke-HPLC-applikasjoner som ekstraksjon i fast fase .
Porestørrelse
Mange stasjonære faser er porøse for å gi større overflateareal. Små porer gir større overflateareal mens større porestørrelse har bedre kinetikk, spesielt for større analytter. For eksempel kan et protein som bare er litt mindre enn en pore komme inn i poren, men ikke lett forlate det når det er inne.
Pumpetrykk
Pumper varierer i trykkapasitet, men ytelsen måles på deres evne til å gi en konsekvent og reproduserbar volumetrisk strømningshastighet . Trykk kan nå så høyt som 60 MPa (6000 lbf/in 2 ), eller omtrent 600 atmosfærer. Moderne HPLC -systemer har blitt forbedret for å fungere ved mye høyere trykk, og kan derfor bruke mye mindre partikkelstørrelser i kolonnene (<2 μm). Disse "ultra high performance liquid chromatography" -systemene eller UHPLC -ene, som også kan bli kjent som ultrahøytrykkskromatografisystemer, kan fungere på opptil 120 MPa (17 405 lbf/in 2 ), eller omtrent 1200 atmosfærer. Begrepet "UPLC" er et varemerke for Waters Corporation , men brukes noen ganger for å referere til den mer generelle teknikken til UHPLC.
Detektorer
HPLC -detektorer faller inn i to hovedkategorier: universell eller selektiv. Universelle detektorer måler vanligvis en bulkegenskap ( f.eks . Brytningsindeks ) ved å måle en forskjell på en fysisk egenskap mellom mobilfasen og mobilfasen med oppløst stoff mens selektive detektorer måler en oppløst egenskap ( f.eks . UV-Vis-absorbans ) ved ganske enkelt å reagere på den fysiske eller kjemiske egenskapen til oppløsningen. HPLC bruker oftest en UV-Vis absorbansdetektor , men et bredt spekter av andre kromatografidetektorer kan brukes. En universell detektor som utfyller UV-Vis absorbansdeteksjon er Charged aerosoldetektor (CAD). En slags vanlig detektor inkluderer brytningsindeksdetektorer, som gir avlesninger ved å måle endringene i brytningsindeksen til elueringsmiddelet når det beveger seg gjennom strømningscellen. I visse tilfeller er det mulig å bruke flere detektorer, for eksempel kombinerer LCMS vanligvis UV-Vis med et massespektrometer.
Autosamplere
Et stort antall prøver kan injiseres automatisk på et HPLC -system ved bruk av HPLC -autosamplere. I tillegg har HPLC -autosamplere et injeksjonsvolum og en teknikk som er nøyaktig den samme for hver injeksjon, derfor gir de en høy grad av injeksjonsvolum presisjon. Det er mulig å muliggjøre omrøring av prøven i prøvetakingskammeret, og dermed fremme homogenitet.
applikasjoner
Produksjon
HPLC har mange bruksområder i både laboratorium og klinisk vitenskap. Det er en vanlig teknikk som brukes i farmasøytisk utvikling, da det er en pålitelig måte å skaffe og sikre produktrenhet på. Selv om HPLC kan produsere (rene) produkter av ekstrem høy kvalitet, er det ikke alltid den primære metoden som brukes ved produksjon av bulkmedisiner. I følge den europeiske farmakopéen brukes HPLC i bare 15,5% av syntesene. Imidlertid spiller det en rolle i 44% av syntesene i USAs farmakopé. Dette kan muligens skyldes forskjeller i penge- og tidsbegrensninger, ettersom HPLC i stor skala kan være en dyr teknikk. En økning i spesifisitet, presisjon og nøyaktighet som oppstår med HPLC tilsvarer dessverre en økning i kostnadene.
Lovlig
Denne teknikken brukes også for påvisning av ulovlige legemidler i urinen. Den vanligste metoden for påvisning av medikamenter er en immunanalyse. Denne metoden er mye mer praktisk. Imidlertid kommer bekvemmeligheten på bekostning av spesifisitet og dekning av et bredt spekter av medisiner. Siden HPLC er en metode for å bestemme (og muligens øke) renhet, er bruk av HPLC alene for å evaluere konsentrasjoner av legemidler noe utilstrekkelig. Med dette utføres HPLC i denne sammenhengen ofte i forbindelse med massespektrometri . Bruk av væskekromatografi i stedet for gasskromatografi i forbindelse med MS omgår nødvendigheten av derivitisering med acetylerings- eller alkyleringsmidler, noe som kan være et belastende ekstra trinn. Denne teknikken har blitt brukt til å oppdage en rekke midler som dopingmidler, stoffmetabolitter, glukuronidkonjugater, amfetamin, opioider, kokain, BZD, ketamin, LSD, cannabis og plantevernmidler. Utførelse av HPLC i forbindelse med massespektrometri reduserer det absolutte behovet for standardisering av HPLC -eksperimentelle kjøringer.
Forskning
Lignende analyser kan utføres for forskningsformål, og påvise konsentrasjoner av potensielle kliniske kandidater som soppdrepende og astmamedisiner. Denne teknikken er åpenbart også nyttig for å observere flere arter i innsamlede prøver, men krever bruk av standardløsninger når informasjon om artidentitet søkes. Det brukes som en metode for å bekrefte resultater av syntesereaksjoner, ettersom renhet er avgjørende i denne typen forskning. Massespektrometri er imidlertid fortsatt den mer pålitelige måten å identifisere arter på.
Medisinsk
Medisinsk bruk av HPLC kan omfatte legemiddelanalyse, men faller nærmere under kategorien næringsstoffanalyse. Selv om urin er det vanligste mediet for å analysere legemiddelkonsentrasjoner, er blodserum prøven som er samlet for de fleste medisinske analyser med HPLC. Andre metoder for påvisning av molekyler som er nyttige for kliniske studier har blitt testet mot HPLC, nemlig immunoassays. I et eksempel på dette ble konkurransedyktige proteinbindingsanalyser (CPBA) og HPLC sammenlignet for sensitivitet ved påvisning av vitamin D. Nyttig for diagnostisering av vitamin D -mangler hos barn, ble det funnet at sensitivitet og spesifisitet for denne CPBA nådde bare 40% og 60 %, henholdsvis, av kapasiteten til HPLC. Selv om det er et dyrt verktøy, er nøyaktigheten til HPLC nesten uten sidestykke.
Se også
- Kromatografiens historie
- Kapillær elektrokromatografi
- Kolonnekromatografi
- Csaba Horváth
- Ionkromatografi
- Micellar væskekromatografi
Referanser
Videre lesning
- LR Snyder, JJ Kirkland og JW Dolan, Introduction to Modern Liquid Chromatography, John Wiley & Sons, New York, 2009.
- MW Dong, Modern HPLC for praktiserende forskere. Wiley, 2006.
- LR Snyder, JJ Kirkland og JL Glajch, Practical HPLC Method Development, John Wiley & Sons, New York, 1997.
- S. Ahuja og HT Rasmussen (red), HPLC Method Development for Pharmaceuticals, Academic Press, 2007.
- S. Ahuja og MW Dong (red), Handbook of Pharmaceutical Analysis av HPLC, Elsevier/Academic Press, 2005.
- YV Kazakevich og R. LoBrutto (red.), HPLC for farmasøytiske forskere, Wiley, 2007.
- UD Neue, HPLC Columns: Theory, Technology, and Practice, Wiley-VCH, New York, 1997.
- MC McMaster, HPLC, en praktisk brukerhåndbok, Wiley, 2007.





