Hirschsprungs sykdom - Hirschsprung's disease
| Hirschsprungs sykdom | |
|---|---|
| Andre navn | Aganglionisk megakolon, medfødt megakolon, medfødt tarmaganglionose |
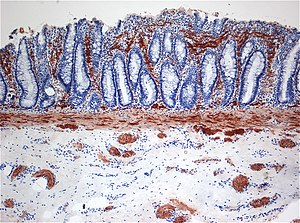 | |
| Histopatologi ved Hirschsprungs sykdom som viser unormal acetylkolinesterase (AchE) -positive nervefibre (brun) i slimhinnen | |
| Spesialitet | Medisinsk genetikk |
| Symptomer | Forstoppelse , oppkast , magesmerter , diaré , langsom vekst |
| Komplikasjoner | Enterocolitt , megakolon , tarmobstruksjon , tarmperforering |
| Vanlig start | De første 2 månedene av livet |
| Typer | Kort segment, langt segment |
| Årsaker | Genetisk |
| Risikofaktorer | Familie historie |
| Diagnostisk metode | Basert på symptomer, biopsi |
| Differensialdiagnose | Kronisk intestinal pseudo-obstruksjon , meconium ileus |
| Behandling | Kirurgi |
| Frekvens | 1 av 5000 nyfødte |
Hirschsprungs sykdom ( HD eller HSCR ) er en fødselsdefekt der nerver mangler fra deler av tarmen . Det mest fremtredende symptomet er forstoppelse . Andre symptomer kan være oppkast , magesmerter , diaré og langsom vekst . Symptomer blir vanligvis tydelige i de to første månedene av livet. Komplikasjoner kan omfatte enterokolitt , megakolon , tarmobstruksjon og tarmperforering .
Lidelsen kan oppstå av seg selv eller i forbindelse med andre genetiske lidelser som Downs syndrom eller Waardenburg syndrom . Omtrent halvparten av isolerte tilfeller er knyttet til en spesifikk genetisk mutasjon , og omtrent 20% forekommer i familier. Noen av disse forekommer på en autosomal dominerende måte. Årsaken til de resterende sakene er uklar. Hvis ellers normale foreldre har ett barn med tilstanden, har det neste barnet 4% risiko for å bli påvirket. Tilstanden er delt inn i to hovedtyper, kortsegment og langsegment, avhengig av hvor mye av tarmen som påvirkes. Sjelden kan tynntarmen også bli påvirket. Diagnosen er basert på symptomer og bekreftet av biopsi .
Behandlingen er vanligvis ved kirurgi for å fjerne den berørte delen av tarmen. Den kirurgiske prosedyren som oftest utføres er kjent som en "gjennomtrengning". Noen ganger kan en tarmtransplantasjon anbefales. Hirschsprungs sykdom forekommer hos omtrent en av 5000 av nyfødte. Hanner rammes oftere enn kvinner. Tilstanden antas å ha blitt beskrevet først i 1691 av den nederlandske anatomisten Frederik Ruysch og er oppkalt etter dansk lege Harald Hirschsprung etter hans beskrivelse i 1888.
Tegn og symptomer
Vanligvis diagnostiseres Hirschsprung sykdom kort tid etter fødselen, selv om den kan utvikle seg godt inn i voksen alder, på grunn av tilstedeværelsen av megakolon , eller fordi barnet ikke klarer å passere den første avføringen ( mekonium ) innen 48 timer etter fødselen. Normalt passerer 90% av babyene sitt første mekonium innen 24 timer, og 99% innen 48 timer. Andre symptomer inkluderer grønt eller brunt oppkast, hevelse i magen, overdreven gass og blodig diaré.
Noen tilfeller blir diagnostisert senere, i barndommen, men vanligvis før 10. år. Barnet kan oppleve avføring, forstoppelse eller oppblåsthet i magen.
Tilknyttede syndromer
Hirschsprungs sykdom kan også presentere seg som en del av multisystemforstyrrelser, for eksempel:
- Bardet - Biedl syndrom
- Brusk - hårhypoplasi
- Medfødt sentralt hypoventilasjonssyndrom
- MENN2
- Mowat - Wilsons syndrom
- Smith – Lemli – Opitz syndrom
- Trisomi 21 ( Downs syndrom )
- Noen former for Waardenburg syndrom
Årsaken
Lidelsen kan oppstå av seg selv eller i forbindelse med andre genetiske lidelser som Downs syndrom . Omtrent halvparten av isolerte tilfeller er knyttet til en spesifikk genetisk mutasjon, og omtrent 20% forekommer i familier. Noen av disse forekommer på en autosomal dominerende måte. Årsaken til de resterende sakene er uklar. Hvis ellers normale foreldre har ett barn med tilstanden, har det neste barnet en risiko på 4% for å bli påvirket.
Genetikk
| Type | OMIM | Gene | Lokus |
|---|---|---|---|
| HSCR1 | 142623 | RET | 10q11.2 |
| HSCR2 | 600155 | EDNRB | 13q22 |
| HSCR3 | 600837 | GDNF | 5p13.1-p12 |
| HSCR4 | 131242 | EDN3 | 20q13.2-q13.3 |
| HSCR5 | 600156 | ? | 21q22 |
| HSCR6 | 606874 | ? | 3p21 |
| HSCR7 | 606875 | ? | 19q12 |
| HSCR8 | 608462 | ? | 16q23 |
| HSCR9 | 611644 | ? | 4q31-32 |
| - | 602229 | SOX10 | 22q13 |
| - | 600423 | ECE1 | 1p36.1 |
| - | 602018 | NRTN | 19p13.3 |
| - | 602595 | GEMIN2 ( Gem-assosiert protein 2 ) | 14q13-q21 |
| - | 191315 | NTRK1 | 1q23.1 |
| - | 605802 | ZEB2 | 2q22.3 |
Flere gener og spesifikke regioner på kromosomer ( loci ) har blitt vist eller foreslått å være assosiert med Hirschsprungs sykdom:
De RET proto-onkogen står for den høyeste andelen av både familiære og sporadiske tilfeller, med et bredt spekter av mutasjoner spredt langs hele kodende region. Et proto-onkogen kan forårsake kreft hvis det er mutert eller overuttrykt.
RET proto-onkogen
RET er et gen som koder for proteiner som hjelper cellene i nevrale kam i bevegelsen gjennom fordøyelseskanalen under utviklingen av embryoet. Disse nevrale kamcellene danner til slutt bunter av nerveceller som kalles ganglioner. EDNRB koder for proteiner som kobler disse nervecellene til fordøyelseskanalen. Dermed kan mutasjoner i disse to genene direkte føre til fravær av visse nervefibre i tykktarmen. Forskning tyder på at flere gener er assosiert med Hirschsprungs sykdom. Ny forskning tyder også på at mutasjoner i genomiske sekvenser involvert i regulering av EDNRB har større innvirkning på Hirschsprungs sykdom enn tidligere antatt.
RET kan mutere på mange måter og er forbundet med Downs syndrom. Siden Downs syndrom er komorbid i 2% av Hirschsprungs tilfeller, er det en sannsynlighet for at RET er sterkt involvert i både Hirschsprungs sykdom og Downs syndrom. RET er også assosiert med medullær kreft i skjoldbruskkjertelen og nevroblastom , som er en type kreft som er vanlig hos barn. Begge disse lidelsene er mer vanlige hos Hirschsprungs pasienter enn i befolkningen generelt. En funksjon som RE T kontrollerer er bevegelsen av de nevrale kamcellene gjennom tarmene hos fosteret som utvikler seg . Jo tidligere RET -mutasjonen oppstår i Hirschsprungs sykdom, jo mer alvorlig blir lidelsen.
Andre gener
Vanlige og sjeldne DNA -variasjoner i neuregulin 1 ( NRG1 ) og NRG3 ( NRG3 ) ble først vist å være assosiert med sykdommen hos kinesiske pasienter gjennom en Genome Wide Association Study av Hong Kong -teamet i henholdsvis 2009 og 2012, Etterfølgende studier i begge Asiatiske og kaukasiske pasienter bekreftet de første funnene ved University of Hong Kong. Både sjeldne og vanlige varianter i disse to genene er identifisert hos flere kinesiske, thailandske, koreanske, indonesiske og spanske pasienter. Disse to genene er kjent for å spille en rolle i dannelsen av det enteriske nervesystemet; dermed er de sannsynligvis involvert i patologien til Hirschsprungs sykdom, i hvert fall i noen tilfeller.
Et annet gen assosiert med denne tilstanden er NADPH oksidase, EF-hånd kalsiumbindende domene 5 ( NOX5 ). Dette genet ligger på den lange armen til kromosom 15 (15q23).
Patofysiologi
Under normal prenatal utvikling , celler fra den nevrale kløft til å migrere inn i tykktarmen (colon) danner nettverk av nerver kalles myenterisk plexus (Auerbach plexus) (mellom de glatte muskellagene i den gastrointestinale trakt vegg) og submucosal plexus (Meissner plexus) (i submucosa i mage -tarmkanalen). Ved Hirschsprungs sykdom er migrasjonen ikke fullført, og en del av tykktarmen mangler disse nervelegemene som regulerer aktiviteten til tykktarmen. Det berørte segmentet av tykktarmen kan ikke slappe av og føre avføring gjennom tykktarmen, noe som skaper en obstruksjon.
Den mest aksepterte teorien om årsaken til Hirschsprung er en defekt i kraniokaudal migrasjon av nevroblaster som stammer fra nevrale kam som oppstår i løpet av de første 12 ukene av svangerskapet . Defekter i differensiering av neuroblaster til ganglionceller og akselerert ødeleggelse av ganglionceller i tarmen kan også bidra til lidelsen.
Denne mangelen på ganglionceller i myenteric og submucosal plexus er godt dokumentert ved Hirschsprungs sykdom. Med Hirschsprungs sykdom blir segmentet som mangler nevroner (aganglionisk) innsnevret, noe som får den normale, proksimale delen av tarmen til å bli oppblåst med avføring. Denne innsnevringen av den distale kolon og svikt i avslapning i det aganglioniske segmentet antas å være forårsaket av mangel på nevroner som inneholder nitrogenoksydsyntase.
Den mest siterte egenskapen er fravær av ganglionceller: spesielt hos menn har 75% ingen i enden av tykktarmen (rectosigmoid) og 8% mangler ganglionceller i hele tykktarmen. Den forstørrede delen av tarmen finnes proksimalt, mens den innsnevrede, aganglioniske delen finnes distalt, nærmere enden av tarmen. Fraværet av ganglionceller resulterer i en vedvarende overstimulering av nerver i den berørte regionen, noe som resulterer i sammentrekning.
Tilsvarende sykdom hos hester er dødelig hvitt syndrom .
Diagnose

Definitiv diagnose stilles ved sugebiopsi av det distalt innsnevrede segmentet. En histologisk undersøkelse av vevet ville vise mangel på ganglioniske nerveceller. Diagnostiske teknikker involverer anorektal manometri , bariumklyster og rektal biopsi . Suge rektal biopsi regnes som den nåværende internasjonale gullstandarden i diagnosen Hirschsprungs sykdom.
Radiologiske funn kan også hjelpe til med diagnosen. Cineanografi ( fluoroskopi av kontrastmedium som passerer anorektal region) hjelper til med å bestemme nivået på de berørte tarmene.
Behandling
Behandling av Hirschsprungs sykdom består av kirurgisk fjerning (reseksjon) av den unormale delen av tykktarmen, etterfulgt av reanastomose .
Kolostomi
Det første behandlingsstadiet pleide å være en reversibel kolostomi . I denne tilnærmingen blir den friske enden av tykktarmen kuttet og festet til en åpning som er opprettet på forsiden av magen. Innholdet i tarmen slippes ut gjennom hullet i magen og inn i en pose. Senere, når pasientens vekt, alder og tilstand er riktig, er den "nye" funksjonelle enden av tarmen forbundet med anus. Den første kirurgiske behandlingen som involverte kirurgisk reseksjon etterfulgt av reanastomose uten kolostomi skjedde allerede i 1933 av doktor Baird i Birmingham på en ett år gammel gutt.
Andre prosedyrer
Den svensk-amerikanske kirurgen, Orvar Swenson (1909–2012), som oppdaget årsaken til Hirschsprungs, utførte først sin kirurgiske behandling, gjennomkjøringsoperasjonen , i 1948. Gjennomtrengningsprosedyren reparerer tykktarmen ved å koble den fungerende delen av tarmen til anus. Gjennomtrengningsprosedyren er den typiske metoden for behandling av Hirschsprungs hos yngre pasienter. Swenson utarbeidet den opprinnelige prosedyren, og gjennomtrekksoperasjonen har blitt endret mange ganger. '
For tiden brukes flere forskjellige kirurgiske tilnærminger, som inkluderer Swenson, Soave, Duhamel og Boley prosedyrer. Swenson -prosedyren etterlater en liten del av den syke tarmen. Soave -prosedyren, oppkalt etter den italienske barnekirken, Franco Soave (1917–1984), etterlater ytterveggen i tykktarmen uendret. Boley-prosedyren, som ble pioner av den amerikanske kirurgen, Scott Boley (f. 1941), er en liten modifikasjon av Soave-prosedyren, så begrepet "Soave-Boley" -prosedyre brukes noen ganger. Duhamel -prosedyren, oppkalt etter den franske barnekirken Bernard Duhamel (1917–1996), bruker en kirurgisk stiftemaskin for å koble den gode og dårlige tarmen.
For de 15% av barna som ikke får full tarmkontroll, er andre behandlinger tilgjengelige. Forstoppelse kan avhjelpes med avføringsmidler eller et fiberrik kost. Hos disse pasientene kan alvorlig dehydrering spille en viktig faktor i deres livsstil. Mangel på tarmkontroll kan løses av en ileostomi - ligner en kolostomi, men bruker enden av tynntarmen i stedet for tykktarmen. Malone antegrade tykktarmsklyster (ACE) er også et alternativ. I en Malone ACE går et rør gjennom bukveggen til vedlegget, eller hvis tilgjengelig, til tykktarmen. Tarmen skylles deretter daglig. Barn så unge som 6 år kan administrere denne daglige skyllingen alene.
Hvis den berørte delen av nedre tarmen er begrenset til den nedre delen av endetarmen, kan andre kirurgiske prosedyrer utføres, for eksempel en posterior rektal myektomi. Prognosen er god i 70% av tilfellene. Kronisk postoperativ forstoppelse er tilstede i 7 til 8% av de opererte tilfellene. Postoperativ enterokolitt , en alvorlig manifestasjon, er tilstede hos 10–20% av opererte pasienter.
Epidemiologi
I følge en studie fra 1984 utført i Maryland , vises Hirschsprungs sykdom hos 18,6 per 100 000 levendefødte. I Japan forekommer det med omtrent en av 5000 fødsler (20 per 100 000). Det er mer vanlig hos menn enn kvinner (4,32: 1) og i hvitt i stedet for ikke -hvitt. Ni prosent av tilfellene med Hirschsprung ble også diagnostisert som Downs syndrom. De fleste tilfellene blir diagnostisert før pasienten er 10 år.
Historie
Den første rapporten om Hirschsprungs sykdom stammer fra 1691, da den ble beskrevet av den nederlandske anatomisten Frederik Ruysch . Sykdommen er imidlertid oppkalt etter Harald Hirschsprung , den danske legen som først beskrev to spedbarn som døde av denne lidelsen i 1888.
Hirschsprungs sykdom er en medfødt lidelse i tykktarmen der visse nerveceller, kjent som ganglionceller , er fraværende og forårsaker kronisk forstoppelse . Hos pasienter med Hirschsprung sykdom er både myenteriske og submukosale plexus fraværende. Et bariumklyster er bærebjelken i diagnosen Hirschsprungs, selv om en rektal biopsi som viser mangel på ganglionceller, er den eneste sikre diagnosemåten.
Den første publikasjonen om en viktig genetisk oppdagelse av sykdommen var fra Martucciello Giuseppe et al. i 1992. Forfatterne beskrev et tilfelle av en pasient med total tykktarmsanganglionose assosiert med en 46, XX, del 10 (q11.21 q21.2) karyotype. Hovedgenet for Hirschsprung sykdom ble identifisert i denne kromosomale 10 regionen, det var RET proto-onkogenet.
Den vanlige behandlingen er "pull-through" kirurgi der delen av tykktarmen som har nerveceller, blir trukket gjennom og sydd over delen som mangler nerveceller. I lang tid ble Hirschsprungs ansett som en multifaktoriell lidelse, der en kombinasjon av natur og pleie ble ansett som årsaken. I august 1993 sa imidlertid to artikler av uavhengige grupper i Nature Genetics at Hirschsprungs sykdom kan kartlegges til en strekning av kromosom 10 .
Denne forskningen antydet også at et enkelt gen var ansvarlig for lidelsen. Forskerne klarte imidlertid ikke å isolere det.
Se også
- Achalasia
- Ileus , svikt i peristaltisk muskelaktivitet i tarmen
- Intestinal neuronal dysplasi
Referanser
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |
