Kallmann syndrom - Kallmann syndrome
| Kallmann syndrom | |
|---|---|
| Andre navn | Kallmanns arvelige anosmi |
| Spesialitet | Endokrinologi |
| Symptomer | Fraværende eller forsinket pubertet , infertilitet , manglende lukt |
| Komplikasjoner | Osteoporose |
| Vanlig start | Tilstede ved fødselen |
| Varighet | Livslang |
| Behandling |
Hormonbehandling Gonadotropin terapi |
| Frekvens | 1: 30 000 (hanner), 1: 125 000 (kvinner) |
Kallmann syndrom ( KS ) er en genetisk lidelse som forhindrer en person i å starte eller fullføre puberteten . Kallmann syndrom er en form for en gruppe tilstander som kalles hypogonadotrop hypogonadisme . For å skille det fra andre former for hypogonadotrop hypogonadisme, har Kallmann syndrom det ekstra symptomet på total mangel på luktesans (anosmi) eller redusert luktesans . Hvis de ikke behandles, vil mennesker ha dårlig definerte sekundære seksuelle egenskaper , vise tegn på hypogonadisme , nesten alltid er ufruktbare og har økt risiko for å utvikle osteoporose . En rekke andre fysiske symptomer som påvirker ansikt, hender og skjelettsystem kan også forekomme.
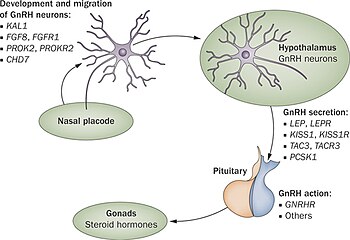
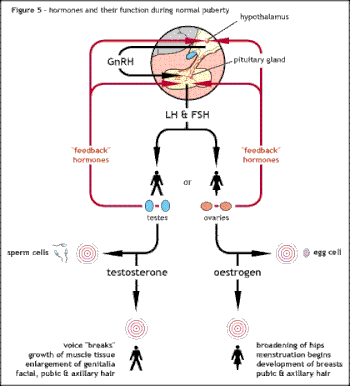
Den underliggende årsaken er svikt i riktig produksjon eller aktivitet av gonadotropinfrigivende hormon av hypothalamus . Dette resulterer i lave nivåer av kjønnshormonene testosteron hos menn eller østrogen og progesteron hos kvinner. Diagnose skjer vanligvis i tenårene når puberteten ikke starter.
Normalt kreves livslang behandling for begge kjønn. Hormonbehandling (HRT) er den viktigste behandlingsformen med sikte på å erstatte manglende testosteron eller østrogen og progesteron. Spesialiserte fruktbarhetsbehandlinger er også tilgjengelige.
Tilstanden er oftere diagnostisert hos menn enn hos kvinner. En studie fra 2011 av den finske befolkningen ga en estimert forekomst av 1 av 48 000 mennesker totalt sett, med 1 av 30 000 for menn og 1 av 125 000 for kvinner. Kallmann syndrom ble først beskrevet med navn i et papir publisert i 1944 av Franz Josef Kallmann , en tysk - amerikansk genetiker . Koblingen mellom anosmi og hypogonadisme hadde allerede blitt notert av den spanske legen Aureliano Maestre de San Juan i 1856.
Tegn og symptomer

Det er normalt vanskelig å skille et tilfelle av Kallmann syndrom (KS)/hypogonadotrop hypogonadisme (HH) fra en enkel konstitusjonell forsinkelse av puberteten . Imidlertid, hvis puberteten ikke har startet enten ved 14 år (jenter) eller 15 (gutter) år og en eller flere av de ikke-reproduktive trekkene som er nevnt nedenfor er tilstede, kan en henvisning til reproduktiv endokrinolog være tilrådelig.
Funksjonene til KS og andre former for HH kan deles inn i to forskjellige kategorier; "reproduktiv" og "ikke-reproduktiv".
Reproduktive trekk
- Unnlatelse av å starte eller fullføre puberteten.
- Mangel på testikkelutvikling hos menn (størrelse <4 ml, mens normalområdet er mellom 12 og 25 ml).
- Primær amenoré (unnlatelse av å starte menstruasjon ).
- Dårlig definerte sekundære seksuelle egenskaper.
- Mikropenis i 5-10% av mannlige tilfeller.
- Kryptorkidisme (testamenter uten nedstigning) ved fødselen.
- Lave nivåer av gonadotropinene LH og FSH .
- Hypogonadisme på grunn av lave nivåer av testosteron hos menn eller østrogen / progesteron hos kvinner.
- Infertilitet .
Ikke-reproduktive trekk
- Total mangel på luktesans ( anosmi ) eller markant redusert luktesans (hyposmi). Dette er det kjennetegn ved Kallmann syndrom; det er ikke sett i andre tilfeller av HH. Omtrent 50% av HH -tilfellene forekommer med anosmi og kan betegnes som Kallmann syndrom.
- Gane , leppespalte eller andre kranio-ansiktsdefekter i midtlinjen.
- Nevral hørselshemming
- Fravær av en av nyrene (ensidig renal agenese)
- Skjelettdefekter inkludert delt hånd/fot ( ectrodactyly ), forkortet langfinger (metakarpal) eller skoliose
- Manuell synkinesis ( speilbevegelser i hendene)
- Manglende tenner (hypodonti)
- Dårlig balanse eller koordinering på grunn av cerebral ataksi .
- Øyedefekter som coloboma eller ptosis .
- Økt forekomst av fargeblindhet
Den eksakte genetiske naturen til hvert enkelt tilfelle av KS/HH vil avgjøre hvilke, om noen, av de ikke-reproduktive trekkene som vil forekomme. Alvorlighetsgraden av symptomene vil også variere fra sak til sak. Selv familiemedlemmer vil ikke vise det samme området eller alvorlighetsgraden av symptomer.
KS/HH er oftest tilstede fra fødselen, men voksne versjoner finnes hos både menn og kvinner. Den hypothalamus-hypofyse-gonadal-aksen (HPG-aksen) fungerer normalt ved fødselen og godt inn i voksne liv, noe som gir normal pubertet og normal reproduktiv funksjon. HPG -aksen svikter da helt eller reduseres til et svært lavt nivå av GnRH -frigjøring i voksenlivet uten noen åpenbar årsak (f.eks. En hypofyse). Dette vil føre til et fall i testosteron- eller østrogennivået og infertilitet.
Funksjonell hypothalamisk amenoré ses hos kvinner der HPG -aksen undertrykkes som reaksjon på fysisk eller psykologisk stress eller underernæring, men er reversibel med fjerning av stressoren.
Noen tilfeller av KS/HH ser ut til å snu i løpet av voksenlivet der HPG -aksen gjenopptar sin normale funksjon og GnRH-, LH- og FSH -nivåene går tilbake til normale nivåer. Dette forekommer hos anslagsvis 10 til 22% av menneskene, hovedsakelig normosmiske CHH -tilfeller i stedet for KS -tilfeller, og bare funnet hos personer som har gjennomgått en eller annen form for testosteronerstatningsterapi. Det oppdages normalt bare når testikkelvolumet øker mens du er på testosteronbehandling alene og testosteronnivået går tilbake til det normale når behandlingen stoppes. Denne typen KS/HH forekommer sjelden i tilfeller der hanner har hatt en historie med ikke-nedstigende testikler.
Berørte personer med KS og andre former for HH er nesten alltid født med normal seksuell differensiering; dvs. de er fysisk mann eller kvinne. Dette skyldes det humane koriongonadotrofinet (hCG) produsert av morkaken ved omtrent 12 til 20 ukers svangerskap (graviditet), som vanligvis ikke påvirkes av KS eller CHH.
Personer med KS/HH mangler bølge av GnRH, LH og FSH som vanligvis oppstår mellom fødsel og seks måneders alder. Denne bølgen er spesielt viktig hos spedbarnsgutter da den hjelper med testikulær nedstigning i pungen. Bølgen av GnRH/LH/FSH hos ikke -KS/HH -barn gir påvisbare testosteronnivåer hos gutter og østrogen og progesteron hos jenter. Mangelen på denne bølgen kan noen ganger brukes som et diagnostisk verktøy hvis KS/HH mistenkes hos en nyfødt gutt, men normalt ikke er tydelig nok for diagnose hos jenter.
Osteoporose
En mulig bivirkning ved å ha KS/CHH er økt risiko for å utvikle sekundær osteoporose eller osteopeni . Østrogen (kvinner) eller testosteron (hanner) er avgjørende for å opprettholde bentetthet . Mangel på enten testosteron eller østrogen kan øke hastigheten på beinresorpsjon, samtidig som det reduserer hastigheten på beindannelse . Totalt sett kan dette føre til svekkede, skjøre bein som har en høyere tendens til brudd.
Selv kort tid med lavt østrogen eller testosteron, som i tilfeller av forsinket diagnose av KS/CHH kan føre til økt risiko for å utvikle osteoporose, men andre risikofaktorer, for eksempel røyking er involvert, så risikoen for å utvikle det vil variere fra person til person person. Ben tetthet skanning anbefales for å overvåke beinmineraltettheten.
Beintetthetsskanningen er kjent som en røntgenabsorptiometri- skanning med dobbel energi (DEXA- eller DXA-skanning). Det er en enkel test som tar mindre enn 15 minutter å utføre. Det innebærer å ta et spesialisert røntgenbilde av ryggraden og hoftene og måle beinmineraltettheten og sammenligne resultatet med gjennomsnittsverdien for en ung frisk voksen i befolkningen generelt.
Tilstrekkelige kalsiumnivåer og sannsynligvis enda viktigere vitamin D -nivåer er avgjørende for sunn bentetthet. Noen mennesker med KS/CHH vil få nivåene sjekket og kan bli foreskrevet ekstra vitamin D -tabletter eller injeksjoner for å forhindre at tilstanden blir verre. D -vitaminets rolle for generell generell helse er under nøye granskning for øyeblikket. Noen forskere hevder at vitamin D -mangel er utbredt i mange populasjoner og kan knyttes til andre sykdommer.
Noen mennesker med alvorlig osteoporose kan bli foreskrevet bisfosfonater for å bevare beinmasse, i tillegg til hormonbehandling.
Genetikk
Til dags dato har minst 25 forskjellige gener blitt implisert i å forårsake Kallmann syndrom eller andre former for hypogonadotrop hypogonadisme gjennom en forstyrrelse i produksjonen eller aktiviteten til GnRH (37). Disse involverte genene dekker alle former for arv, og ingen genfeil har vist seg å være felles for alle tilfeller, noe som gjør genetisk testing og arvsprediksjon vanskelig.
Antall gener som er kjent for å forårsake tilfeller av KS/CHH, øker fortsatt. I tillegg antas det at noen tilfeller av KS/CHH er forårsaket av to separate genfeil som oppstår samtidig.
Individuelle genfeil kan være assosiert med spesifikke symptomer som kan hjelpe til med å identifisere hvilke gener som skal testes for. Mellom 35-45% av tilfellene av KS/CHH har en ukjent genetisk årsak.
Den ANOS1 gen feil (tidligere kjent som KAL-1) var den første oppdaget, og man oftest testet for. Det forårsaker den x-koblede formen for Kallmann syndrom og er forbundet med de ekstra symptomene på anosmi , bimanual synkinesis og renal agenese . Denne defekten antas å være ansvarlig for mellom 5 og 10% av alle Kallmann syndrom/CHH -tilfeller.
Patofysiologi

Den underliggende årsaken til Kallmann syndrom eller andre former for hypogonadotrop hypogonadisme er en feil i den korrekte virkningen av det hypothalamiske hormonet GnRH . Begrepet isolert GnRH -mangel (IGD) har i økende grad blitt brukt for å beskrive denne gruppen av tilstander ettersom det fremhever hovedårsaken til disse tilstandene og skiller dem fra andre tilstander som Klinefelters syndrom eller Turners syndrom som har noen lignende symptomer, men som har en annen etiologi . Begrepet hypogonadisme beskriver et lavt nivå av sirkulerende kjønnshormoner ; testosteron hos menn og østrogen og progesteron hos kvinner. Hypogonadisme kan forekomme gjennom en rekke forskjellige mekanismer. Bruken av begrepet hypogonadotropic relaterer seg til det faktum at hypogonadismen som finnes i HH er forårsaket av en forstyrrelse i produksjonen av gonadotropinhormonene som normalt frigjøres av den fremre hypofysen, kjent som luteiniserende hormon (LH) og follikelstimulerende hormon (FSH). Svikt i GnRH -aktivitet kan ellers skyldes fraværet av GnRH -frigivende nevroner inne i hypothalamus. HH kan oppstå som en isolert tilstand med bare LH- og FSH -produksjonen som påvirkes, eller det kan forekomme i kombinerte hypofysemangelbetingelser.
I de første 10 ukene av normal embryonal utvikling migrerer de GnRH -frigivende nevronene fra sin opprinnelige kilde i neseregionen og havner inne i hypothalamus. Disse nevronene har sin opprinnelse i et område av hodet som utvikler seg, luktestedsploden , som vil gi opphav til luktepitelet; de passerer deretter gjennom cribriform -platen , sammen med fibrene i luktnervene, og inn i rostral forhjerne . Derfra vandrer de til det som skal bli hypothalamus. Eventuelle problemer med utviklingen av luktfibrene forhindrer progresjonen av GnRH som frigjør nevroner mot hjernen.
Diagnose
Diagnose av KS og andre former for CHH kompliseres av vanskeligheter med å skille mellom en normal konstitusjonell forsinkelse av puberteten eller et tilfelle av KS/CHH. Diagnosen er ofte en eksklusjon som finnes under opparbeidelse av forsinket pubertet .
Hos menn kan bruk av alderssvarende nivåer av testosteron bidra til å skille mellom et tilfelle av KS/CHH fra et tilfelle av forsinket pubertet. Hvis ingen pubertet er synlig, spesielt ingen testikkelutvikling, kan en gjennomgang av en reproduktiv endokrinolog være passende. Hvis puberteten ikke er synlig innen 16 år, bør personen henvises til endokrinologisk undersøkelse. Postnatal diagnose av KS/CHH før 6 måneders alder er noen ganger mulig, siden normal hormonell bølge av gonadotropiner etter fødsel sammen med testosteron eller østrogen er fraværende hos babyer med KS/CHH. Denne mangelen på påviselige hormoner i blodet kan brukes som en diagnostisk indikator, spesielt hos mannlige spedbarn.
Hos kvinner blir diagnosen noen ganger forsinket ytterligere, ettersom andre årsaker til amenoré normalt må undersøkes først før et tilfelle av KS/CHH blir vurdert.
Diagnose av KS/CHH normal innebærer en rekke kliniske, biokjemiske og radiologiske tester for å utelukke andre forhold som kan forårsake lignende symptomer.
Kliniske tester
- Sammenligning av høyde med standard vekstdiagrammer.
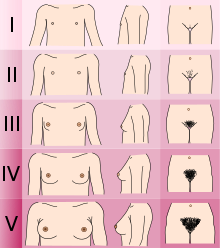
- Bestemmelse av Tanner -stadiet av seksuell utvikling. (Hanner med KS/CHH er normalt på stadium I eller II med kjønnsorganer, hunner på stadium I med brystutvikling og både menn og kvinner på stadium III med kjønnshårutvikling).
- Kontrollerer om det er mikropenis og testamenter uten nedstigning ( kryptorkidisme ) hos menn.
- Måling av testikkelvolum.
- Kontrollerer brystutvikling og alder ved menarche hos kvinner.
- Kontrollere luktesansen ved hjelp av luktstoffpanel eller University of Pennsylvania Smell Identification Test (UPSIT)
- Se etter hørselshemming.
- Undersøkelse for manglende tenner eller tilstedeværelse av leppespalte og/eller ganespalte .
- Kontrollerer pigmentering av hud og hår.
- Se etter speilbevegelser i hendene eller tegn på nevroutviklingsforsinkelse .
Laboratorietester
- Tidlig morgen hormonelle tester inkludert FSH , LH , testosteron , østrogen og prolaktin .
- GnRH- og/eller hCG -stimuleringstest for å bestemme aktiviteten til hypothalamus og hypofyse .
- Sperm test
- Leverfunksjon , nyrefunksjon og betennelsesmarkør testing.
- Karyotype for å se etter kromosomavvik.
Medisinsk bildebehandling
- Utføre håndledd røntgen for å fastslå skjelettalder.
- Brain MR for å utelukke eventuelle strukturelle abnormiteter i hypothalamus eller hypofysen og for å kontrollere om det finnes olfaktoriske pærer .
- Ultralyd av nyrer for å utelukke ensidig renal agenese .
- Beintetthetsskanning ( DXA ) for å se etter osteoporose eller osteopeni .
Behandling
For både menn og kvinner er det opprinnelige målet for behandling utviklingen av de sekundære seksuelle egenskapene som normalt sett ved puberteten. Når dette er oppnådd, er det nødvendig med fortsatt hormonbehandling for både menn og kvinner for å opprettholde seksuell funksjon, beinhelse, libido og generelt velvære. Hos menn er det nødvendig med testosteronerstatningsterapi for å opprettholde normal muskelmasse.
Noen ganger er det nødvendig med tidlig behandling for mannlige spedbarn med mistenkt KS/CHH for å korrigere testamenter og mikropenis uten nedstigning hvis de er tilstede ved bruk eller kirurgi eller gonadotropin eller DHT -behandling. Kvinner med KS/CHH trenger vanligvis ingen behandling før ungdomsårene. For øyeblikket finnes det ingen behandlinger for mangel på luktesans, speilbevegelse av hendene eller fravær av en nyre.
Behandling for både menn og kvinner med KS/CHH består normalt av ett av tre alternativer som kan brukes både til hormonbehandling og/eller fertilitetsbehandling.
- Kjønnshormonerstatning (testosteron eller østrogen og progesteron).
- Gonadotropinbehandling (medisiner som replikerer aktiviteten til FSH og LH).
- GnRH pulserende terapi.
Hormonbehandling
Metoden og dosen av behandlingen vil variere avhengig av personen som behandles. Initial behandling utføres normalt med lavere doser hos yngre pasienter for å utvikle de sekundære seksuelle egenskapene før voksne doser oppnås.
For menn med KS/CHH inkluderer typer testosteronlevering daglige patcher, daglig gelbruk, daglige kapsler, subkutane eller intramuskulære injeksjoner eller seks måneders implantater. Ulike formuleringer av testosteron brukes for å sikre at både de anabole og androgene effektene av testosteron oppnås. Nasale testosteronleveringsmetoder er utviklet, men bruken av dem i KS/CHH -behandling har ikke blitt formelt evaluert.
Gonadotropinbehandling, i form av human chorionic gonadotropin (hCG) injeksjoner, med eller uten bruk av FSH, kan også brukes hos mannlige pasienter for å indusere sekundær seksuell karakteristisk utvikling ved siden av mulig fruktbarhetsinduksjon.
For kvinner innebærer hormonerstatning bruk av østrogen og progesteron. For det første brukes østrogen i tablett- eller gelform for å maksimere brystutviklingen, deretter brukes en kombinasjon av østrogen og progesteron. Syklisk progesteron er normalt nødvendig for å holde endometrium (slimhinnen i livmoren ) frisk.
Hos menn krever overvåkning av behandlingen normalt måling av serumtestosteron, inhibin B , hematokrit og prostata-spesifikt antigen (PSA). Hvis injeksjoner brukes, tas nivåer for å sikre at et tilstrekkelig nivå av testosteron oppnås gjennom injeksjonssyklusen.
Hos kvinner består overvåkning normalt av måling av østrogen, FSH, LH, inhibin B og anti-Müllerian hormon (AMH).
Standard hormonbehandling kan normalt ikke føre til fruktbarhet hos menn eller kvinner, uten testikkelvekst hos menn. Tidlig behandling som ungdom kan hjelpe med psykologisk velvære hos mennesker med KS/CHH.
Fertilitetsbehandlinger
Gonadotropinbehandling kan brukes hos både mannlige og kvinnelige pasienter for å oppnå fruktbarhet for noen mennesker.
Pulserende GnRH -terapi kan også brukes til å indusere fruktbarhet, spesielt hos kvinner, men bruken er begrenset til noen få spesialiserte behandlingssentre.
Hos menn med KS/CHH skyldes infertilitet først og fremst mangel på sædproduksjon i testiklene . Sædproduksjon kan oppnås enten ved bruk av GnRH administrert via en mikroinfusjonspumpe eller ved bruk av gonadotropininjeksjoner ( hCG , FSH, hMG ). Tiden det tar å oppnå tilstrekkelig sædproduksjon for naturlig unnfangelse vil variere fra person til person. Hvis testbehandlingen er veldig liten og det har vært en testament uten nedstigninger, kan det ta lengre tid å oppnå sædproduksjon. I disse tilfellene kan assistert reproduktiv teknologi , for eksempel sædutvinning ved bruk av testikulær sædekstraksjon (TESE) og/eller intracytoplasmatisk sædinjeksjon (ICSI), være nødvendig.
Hos kvinner med KS/CHH skyldes infertilitet først og fremst mangel på modning av egg i eggstokkene . Eggløsningsinduksjon kan oppnås enten med pulserende GnRH -terapi eller alternativt med gonadotropininjeksjoner (hCG, FSH, hMG) gitt med faste intervaller for å utløse modning og frigjøring av egget for naturlig unnfangelse.
Prognose
Tilbakeføring av symptomer er rapportert i mellom 10% og 22% av tilfellene.
Tilbakefallstilfeller har blitt sett i både KS og normosmisk CHH, men ser ut til å være mindre vanlige i tilfeller av KS (der luktesansen også påvirkes). Tilbakeføring er ikke alltid permanent, og de presise genetiske årsakene er ennå ikke fullt ut forstått.
Epidemiologi
Epidemiologien til Kallmann syndrom er ikke godt forstått. Individuelle studier inkluderer en rapport fra 1986 som gjennomgikk medisinske journaler i den sardinske hæren, som fant en prevalens på 1 av 86 000 menn og en rapport fra 2011 fra Finland som fant en prevalens på 1: 30 000 for menn og 1: 125 000 for kvinner.
Kallmann syndrom forekommer omtrent 4 ganger oftere hos menn enn kvinner, men er bare 2,5 ganger mer vanlig blant menn i familiære tilfeller.
Historie

Kallmann syndrom ble først beskrevet med navn i et papir publisert i 1944 av Franz Josef Kallmann , en tysk - amerikansk genetiker . Koblingen mellom anosmi og hypogonadisme hadde allerede blitt notert av den spanske legen Aureliano Maestre de San Juan i 1856. På 1950 -tallet rapporterte De Morsier og Gauthier om delvis eller fullstendig fravær av olfaktorisk pære i hjernen til menn med hypogonadisme.
Terminologi
Terminologien som brukes ved beskrivelse av tilfeller av HH varierer og kan omfatte: {
- GnRH -mangel
- medfødt hypogonadotrop hypogonadisme (CHH)
- idiopatisk/ isolert hypogonadotropisk hypogonadisme (IHH)
- normosmisk hypogonadotrop hypogonadisme (nHH)
- hypotalamisk hypogonadisme
- olfakto-genital syndrom
Forskning
Kisspeptin er et protein som regulerer frigjøringen av GnRH fra hypothalamus, som igjen regulerer frigjøringen av LH og, i mindre grad, FSH fra den fremre hypofysen. Kisspeptin og den tilhørende reseptoren KISS1R er kjent for å være involvert i reguleringen av puberteten. Studier har vist at det er potensial for at kisspeptin kan brukes til diagnostisering og behandling av visse tilfeller av Kallmann syndrom og CHH.
Referanser
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |