Lymphangioleiomyomatosis - Lymphangioleiomyomatosis
| Lymphangioleiomyomatosis (LAM) | |
|---|---|
| Andre navn | lymfangiomyomatose, LAM |
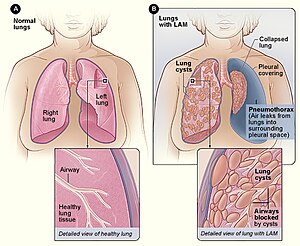 | |
| Figur A viser plasseringen av lungene og luftveiene i kroppen. Det innfelte bildet viser et tverrsnitt av en frisk lunge. Figur B viser en oversikt over lungene med LAM og en kollapset lunge ( pneumothorax ). Det innfelte bildet viser et tverrsnitt av en lunge med LAM. | |
| Spesialitet |
Pulmonologi |
Lymphangioleiomyomatosis ( LAM ) er en sjelden, progressiv og systemisk sykdom som vanligvis resulterer i cystisk lungedestruksjon . Det påvirker hovedsakelig kvinner, spesielt i fertil alder. Begrepet sporadisk LAM brukes om pasienter med LAM som ikke er assosiert med tuberøs sklerose-kompleks (TSC), mens TSC-LAM refererer til LAM som er assosiert med TSC.
Tegn og symptomer
Gjennomsnittsalderen for begynnelsen er tidlig til midten av 30 -årene. Anstrengende dyspné (kortpustethet) og spontan pneumothorax (lungekollaps) har blitt rapportert som den første presentasjonen av sykdommen hos henholdsvis 49% og 46% av pasientene.
Diagnosen er vanligvis forsinket 5 til 6 år. Tilstanden blir ofte feildiagnostisert som astma eller kronisk obstruktiv lungesykdom . Den første pneumothorax , eller lungekollaps, går foran diagnosen LAM hos 82% av pasientene. Konsensusklinisk definisjon av LAM inkluderer flere symptomer:
- Utmattelse
- Hoste
- Hoster blod (sjelden massiv)
- Brystsmerter
- Chylous komplikasjoner som skyldes lymfatisk obstruksjon, inkludert
- Chylothorax
- Chylous ascites
- Kyloperikard
- Kyloptyse
- Chyluria
- Chyle i vaginal utslipp
- Chyle i krakk.
- Angiomyolipomer (fete nyretumorer) er tilstede hos omtrent 30% av pasientene med sporadisk LAM og opptil 90% av pasientene med TSC-LAM. Angiomyolipomer kan noen ganger spontant blø og forårsake smerte eller lavt blodtrykk .
- Cystiske lymfangiomer eller lymfeknuter med hypodense sentre, som etterligner nekrotiserende lymfomer, eggstokkreft eller nyrekreft eller andre maligniteter kan forekomme i retroperitoneum, bekken eller mediastinum.
Lungedestruksjon i LAM er en konsekvens av diffus infiltrasjon av neoplastiske glattmuskellignende celler som invaderer alle lungestrukturer inkludert lymfatiske , luftveisvegger, blodkar og interstitielle mellomrom . Konsekvensene av obstruksjon av fartøy og luftveier inkluderer akkumulering av chylous væske, hemoptyse , luftstrømobstruksjon og pneumothorax . Det typiske sykdomsforløpet viser progressiv dyspné ved anstrengelse, fordelt på tilbakevendende pneumotororaser og hos noen pasienter, chylous pleural effusjoner eller ascites.
De fleste har dyspné ved anstrengelse med daglige aktiviteter innen 10 år etter symptomdebut. Mange pasienter krever supplerende oksygen over dette intervallet.
Genetikk
LAM forekommer i to innstillinger: i sykdommen tuberøs sklerose-kompleks (TSC-LAM) og i en sporadisk form, hos kvinner som ikke har TSC (sporadisk LAM). I begge innstillinger indikerer genetisk bevis på at LAM er forårsaket av inaktiverende eller "tap av funksjon" -mutasjoner i TSC1- eller TSC2 -genene, som ble klonet i henholdsvis 1997 og 1993. TSC1 -genet er lokalisert på den lange armen til kromosom 9 (9q34) og TSC2 -genet er lokalisert på den korte armen til kromosom 16 (16p13). TSC-LAM forekommer hos kvinner som har kimlinemutasjoner i enten TSC1- eller TSC2-genet.
Sporadisk LAM er først og fremst forbundet med somatiske TSC2 -genmutasjoner. Germline og somatiske mutasjoner i LAM inkluderer mange typer mutasjoner spredt over genene, uten klare "hot spots", inkludert missense-endringer, slettinger i rammen og tullmutasjoner. På grunn av generens store størrelse (sammen har de mer enn 60 eksoner) og fordi mutasjoner kan lokaliseres praktisk talt hvor som helst i genene, er mutasjonsdeteksjon ofte utfordrende.
På mobilbasis bærer LAM-celler bi-allel inaktivering av TSC2-genene, i samsvar med "to-hit" tumorsuppressorgenmodellen. Den andre treffhendelsen i LAM-celler er ofte tap av kromosomregionen som inneholder villtypekopien av TSC2-genet; dette kalles tap av heterozygositet eller LOH. LOH kan påvises i mikrodissekterte LAM -celler, i angiomyolipomer og lymfeknuter fra kvinner med LAM, og i sirkulerende LAM -celler (celler i blod og urin).
Angiomyolipomer og pulmonale LAM -celler fra kvinner med sporadisk form for LAM bærer identiske mutasjoner i TSC2. Dette, sammen med det faktum at tilbakevendende LAM etter lungetransplantasjon bærer de samme TSC2 -mutasjonene som den opprinnelige LAM, har ført til "godartet metastase" -hypotesen om at LAM -celler kan migrere eller metastasere fra et sted til et annet.
Patofysiologi
En variabel prosentandel av celler i LAM -lesjonen inneholder mutasjonsinaktivering av tumorsuppressorgener av tuberøs sklerose -kompleks (TSC1 eller TSC2). TSC1 -mutasjoner forårsaker en mindre alvorlig klinisk fenotype enn TSC2 -mutasjoner. Oppdagelsen av TSC1/2 -genfunksjon som negativ regulator av pattedyrmålet til rapamycinkompleks 1 (mTORC1) førte til vellykket bruk av rapamycinanalog sirolimus i kliniske studier og FDA -godkjenning av sirolimus for behandling av LAM.
TSC1 og TSC2 danner et svulstundertrykkende kompleks som regulerer pattedyrmål for rapamycin (mTOR) signalkompleks ved å direkte kontrollere aktiviteten til det lille GTPase Rheb via GTPase -aktiverende protein (GAP) domenet til TSC2. Rheb binder seg til Raptor og kontrollerer aktiviteten til mTOR-kompleks 1 (mTORC1) som fosforylerer direkte p70 S6- kinase (S6K1) og 4E-BP1. mTOR danner to fysisk og funksjonelt forskjellige multiproteinkomplekser: det rapamycinsensitive mTORC1 og det rapamycin-ufølsomme mTORC2. MTORC1 består av fem proteiner inkludert Raptor som positivt regulerer mTOR -aktivitet. MTORC2 består av seks proteiner inkludert mTOR og Rictor , som definerer aktiveringsnivået til mTORC2 og modulerer sammensetningen av aktin -cytoskjelettet gjennom Rho GTPases, og Rac1 er nødvendig for mTOR -aktivering. I TSC2-null og humane LAM-celler er Rho GTPase-aktivitet nødvendig for celleadhesjon, motilitet, spredning og overlevelse. Tap av TSC1/TSC2 i LAM induserer ukontrollert LAM -cellevekst og øker LAM -cellens levedyktighet. Oppregulering av STAT1 og STAT3 og autofagi er kjente mediatorer for LAM -cellers levedyktighet og overlevelse.
LAM -celler oppfører seg på mange måter som metastatiske tumorceller. LAM -celler ser ut til å oppstå fra en ekstrapulmonal kilde og migrere til lungen. Økt LAM-cellemigrasjon og invasivitet reddes av TSC2-re-uttrykk. De cellulære og molekylære mekanismene for neoplastisk transformasjon og lungeparenchymal ødeleggelse av LAM -celler forblir ukjente. Lungemodellering kan formidles av en ubalanse mellom matriksnedbrytende metalloproteinaser (MMP) og deres endogene hemmere TIMP. Den invasive cellefenotypen i LAM er assosiert med TIMP-3 nedregulering og TSC2-avhengig oppregulering av MMP.
Klinisk og histopatologisk bevis demonstrerer lymfatisk involvering i LAM. Den rådende hypotesen er at LAM -lesjoner utskiller den lymfangiogene faktoren VEGF -D, rekrutterer lymfatiske endotelceller (LEC) som danner lymfekar og induserer lungecyster. VEGF-D serumnivåer øker i LAM sammenlignet med andre cystiske lungesykdommer, inkludert Langerhans cellehistiocytose i lungene , emfysem, Sjögrens syndrom eller Birt – Hogg – Dubé syndrom . VEGF-D-nivåer korrelerer med alvorlighetsgraden av LAM, evaluert som et mål på CT-klasse (overflod av chylous effusjoner og lymfatisk involvering). VEGF-D er et utskilt homodimert glykoprotein og medlem av VEGF-familien av vekstfaktorer, er kjent for sin rolle i kreftlymfangiogenese og metastase . Proteolytisk behandling av VEGF-D påvirker den kognitive bindingen til VEGFR3. Histopatologisk er LAM lesjoner omgitt av celler som flekken for VEGFR 3, lymfekarene endotel hyaluronan receptor 1 (LYVE-1) og podoplanin . VEGF-D binder seg til reseptorproteinet tyrosinkinaser VEGFR-2 og VEGFR-349 hos mennesker og til VEGFR3 hos mus. Overraskende nok har knock-out av VEGF-D hos mus liten effekt på lymfesystemets utvikling. Likevel fremmer VEGF-D under tumorigenese dannelse av tumorlymfatiske kar og letter metastatisk spredning av kreftceller. Imidlertid er lite kjent om en rolle av unormale lymfatiske og VEGF-D i LAM- patogenese .
Diagnose
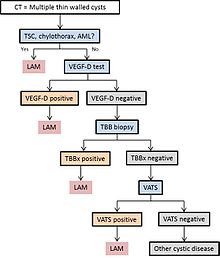
LAM kan komme til legehjelp på flere måter, hvorav de fleste utløser en bryst CT. Tynnvegget cystisk endring i lungene kan for øvrig bli funnet på CT-skanning av hjerte, bryst eller mage (på kuttene som inkluderer lungebaser) oppnådd til andre formål. HRCT hos TSC -pasienter avslører at om lag 20% av kvinnene har cystisk endring etter 20 år og om lag 80% av kvinnene har cystiske endringer etter 40 år. LAM blir noen ganger avslørt av bryst -CT hos pasienter som opplever en tilsynelatende primær spontan pneumothorax, men mer ofte bestilles ikke CT -skanning (i USA) før gjentakelser oppstår. Progressiv dyspné ved anstrengelse uten forverringer og remisjoner som er karakteristiske for astma eller KOL, forårsaker noen ganger CT på brystet. En gjennomgang av CT av en ekspert som er kjent med LAM kan øke diagnostisk nøyaktighet. Chylothorax kan også gjøre LAM oppmerksom.
I noen tilfeller kan en LAM-diagnose stilles med tillit på klinisk grunn (uten biopsi ) hos pasienter med typiske cystiske endringer ved høyoppløselig CT-skanning av lungen og funn av tuberøs sklerose, angiomyolipom , lymfangioleiomyom , chylothorax eller serum VEGF-D> 800 pg/ml.
Hvis ingen av disse kliniske trekkene er tilstede, kan det være nødvendig med en biopsi for å stille diagnosen. Videoassistert thorakoskopisk lungebiopsi er den mest definitive teknikken, men transbronchial biopsi har et utbytte på over 50% og kan også være effektivt. Sikkerheten til sistnevnte prosedyre hos pasienter med diffus cystisk sykdom og mengden av cystisk endring som forutsier en informativ biopsi, er imidlertid ufullstendig forstått. Cytologi av chylousvæsker, aspirerte mageknuter eller lymfatiske masser kan også være diagnostisk.
Diagram 1 skisserer en foreslått algoritme for diagnose av LAM.
Brystradiograf
Den brystet røntgenbilde kan virke relativt normal, selv sent i sykdomsforløpet, eller kan foreslå hyperinflasjon bare. Etter hvert som sykdommen utvikler seg, viser røntgenbildet av brystet ofte diffuse, bilaterale og symmetriske retikulonodulære uklarheter, cyster, bullae eller et "honningkake" (dvs. pseudofibrotisk) utseende. Pleural effusjon og pneumothorax kan være tydelig. Bevaring av lungemengder i nærvær av økte interstitielle markeringer er et radiografisk kjennetegn på LAM som hjelper til med å skille det fra de fleste andre interstitielle lungesykdommer, der alveolær septal og interstitial ekspansjon har en tendens til å øke lungens elastiske rekylegenskaper og reduserte lungemengder.
Computertomografi
Den høyoppløselige computertomografi (HRCT) brystskanning er bedre enn brystrøntgenbilde for å detektere cystisk parenchymal sykdom, og er nesten alltid unormal ved tidspunktet for diagnose, selv når brystrøntgenbilde og lungefunksjons vurderingene er normal. Den typiske CT viser diffuse runde, bilaterale, tynnveggede cyster av varierende størrelse fra 1 til 45 mm i diameter. Antall cyster varierer i LAM fra noen få til nesten fullstendig utskifting av normalt lungevev. Overflaten av cyster har en tendens til å være mildere hos pasienter med TSC-LAM enn S-LAM, kanskje forklart delvis fordi TSC-LAM-pasienter vanligvis får tidligere screening. Pleural effusjoner ses på CT hos 12% av pasientene med S-LAM og 6% av pasientene med TSC-LAM. Andre CT -funksjoner inkluderer lineære tettheter (29%), hilar eller mediastinal lymfadenopati (9%), pneumothorax, lymphangiomyoma og utvidelse av thoraxkanalen. Ugjennomsiktighet av slipt glass (12%) antyder tilstedeværelse av interstitielt ødem på grunn av lymfatisk overbelastning. Hos pasienter med TSC, kan nodulær tettheter på HRCT representere multifokal mikronodulær pneumocytt hyperplasi (MMPH) bestående av klynger av hyperplastisk type II pneumocytes. MMPH kan være tilstede hos menn eller kvinner med TSC i nærvær eller fravær av LAM, men ikke hos pasienter med S-LAM. MMPH er vanligvis ikke forbundet med fysiologiske eller prognostiske konsekvenser, men ett tilfelle av respirasjonssvikt på grunn av MMPH er rapportert.
Ventilasjon-perfusjon skanner
I en studie var ventilasjons-perfusjonsskanninger unormale hos 34 av 35 LAM-pasienter. Den vanligste abnormiteten var uspesifikk diffus heterogenitet , vanligvis grovt matchet. Disse forfatterne beskrev også et "uvanlig", "flekkemønster" på perfusjonsbildene hos 74% av pasientene, bestående av "små, ofte perifere samlinger av radioisotoper."
Positronemisjonstomografi
LAM- og AML-lesjoner viser vanligvis ikke økt opptak av 18F-fluorodeoksyglukose ved positronemisjonstomografi (PET) skanning. Andre neoplasmer (eller kilder til betennelse) bør derfor vurderes i kjente eller mistenkte LAM-tilfeller der FDG-PET-resultater er positive.
Abdominal avbildning
Unormaliteter ved abdominal avbildning, for eksempel renal AML og forstørrede lymfatiske strukturer, er også vanlige ved LAM. Fat tetthet innenfor en nyre masse er for sykdommen av AMLS. AML er mer utbredt og oftere bilateral og stor hos pasienter med TSC-LAM enn hos pasienter med S-LAM. AML -størrelse korrelerer med forekomsten av lungecyster hos pasienter med TSC. En studie CT avbildet 256 pasienter med S-LAM og 67 med TSC-LAM. Renal AML var til stede hos 32% av pasientene med S-LAM og 93% av pasientene med TSC-LAM. Lever AML var tilstede hos 2% av pasientene med S-LAM og 33% av pasientene med TSC-LAM. Ascites var uvanlig, sett hos færre enn 10% av pasientene med LAM. Abdominal lymfangiomatose, ofte inneholdende både cystiske og faste komponenter, ble sett hos 29% av pasientene med S-LAM og 9% av pasientene med TSC-LAM.
Avbildning av sentralnervesystemet
Sentralnervesystemet abnormiteter, for eksempel kortikale eller subependymale knoller og astrocytomer , er vanlige hos pasienter med TSC, inkludert de med TSC-LAM, men finnes ikke hos kvinner med S-LAM. Moss og medarbeidere rapporterte at kvinner med S-LAM og TSC-LAM kan ha en økt forekomst av meningiom , men betydningen av dette funnet har blitt utfordret.
Studier av lungefunksjon
Lungefunksjonstesting hos pasienter med LAM kan være normal eller kan avsløre obstruktive, restriktive eller blandede mønstre. Obstruktiv fysiologi er den vanligste abnormiteten. Kvalitetsstyrte lungefunksjonsdata ble samlet inn prospektivt av NHLBI Registry, en 5-årig studie av pasienter med LAM i sentre rundt om i USA. Spirometri avslørte obstruktive endringer hos omtrent 57% av pasientene og normale resultater hos 34%. Restriksjon, definert som en total lungekapasitet mindre enn den nedre grensen for det normale, ble sett hos 11%. Hyperinflasjon var tilstede hos omtrent 6%. Gjennomsnittlig gjenværende volum var 125% av forutsagt ved måling ved pletysmografi, men var bare 103% av forventet bestemt med gassfortynningsmetoder, noe som tyder på betydelig luftfangst i ikke -kommuniserende luftrom. Omtrent 25% av pasientene med obstruktiv fysiologi kan demonstrere respons på bronkodilatatoren, men kan være mindre ved mer alvorlig obstruksjon. Den obstruktive fysiologiske defekten i LAM skyldes først og fremst luftstrømobstruksjon. Den tidligste endringen i den første lungefunksjonstesten i forskjellige case -serier var unormal gassoverføring, vurdert av diffusjonskapasiteten for karbonmonoksid (DLCO), beskrevet hos 82% til 97% av pasientene. Det er ikke uvanlig at DLCO reduseres utenfor proporsjon til tvunget ekspirasjonsvolum på 1 sekund (FEV1). Reduksjon i DLCO og økning i gjenværende volum anses generelt for å være LAMs tidligste fysiologiske manifestasjoner.
Kardiopulmonal treningstest i en mye større kohort av pasienter med LAM avslørte et redusert maksimal oksygenforbruk ( VO 2 max ) og anaerob terskel hos 217 pasienter. Treningsindusert hypoksemi ble funnet selv hos pasienter som ikke hadde hvileavvik i FEV1 og DLCO. Hos de fleste pasienter ble trening antatt å være begrenset med ventilasjon, på grunn av hindring av luftstrøm og økt ventilasjon i død plass.
Sykdomsutvikling er vanligvis ledsaget av en progressiv obstruktiv ventilasjonsdefekt. Nedgang i FEV1 er den mest brukte parameteren for å overvåke sykdomsprogresjon. Selv om hvilende pulmonal hypertensjon ser ut til å være uvanlig ved LAM, stiger pulmonal arterielt trykk ofte med lave treningsnivåer, delvis relatert til hypoksemi. En studie rapporterte en økning i intraparenchymale shunts hos dyspneiske pasienter med LAM, noe som kan bidra til å hvile og trene hypoksemi.
Patologi
Grovt sett er LAM -lunger forstørret og diffust cystisk, med utvidede luftrom så store som flere centimeter i diameter. Mikroskopisk undersøkelse av lungen avslører foci av glatt muskellignende celleinfiltrasjon av lunge-parenkymet, luftveiene, lymfene og blodårene forbundet med områder med tynnvegget cystisk forandring. LAM-lesjoner inneholder ofte en overflod av lymfatiske kanaler og danner et anastomoserende nettverk av spaltlignende mellomrom foret av endotelceller . LAM -celler utvider vanligvis mellomrom uten å krenke vevsplan, men har blitt observert for å invadere luftveiene, lungearterien, membranen, aorta og retroperitonealfett , for å ødelegge bronkialbrusk og arteriolære vegger, og for å stenge lumen i lungearterioler.
Det er to store cellemorfologier i LAM-lesjonen: små spindelformede celler og kuboidale epitelceller. LAM-celler farger positivt for glatt muskel aktin , vimentin , desmin , og, ofte, østrogen og progesteronreseptorer. De kuboidale cellene i LAM-lesjoner reagerer også med et monoklonalt antistoff kalt HMB-45, utviklet mot det premelanosomale proteinet gp100, et enzym i melanogenesebanen. Denne immunhistokjemiske markøren er veldig nyttig diagnostisk, fordi andre glattmuskel -dominerende lesjoner i lungen ikke reagerer med antistoffet. De spindelformede cellene i LAM-lesjonen prolifererer hyppigere cellekjerneantigen-positive enn de kuboidale cellene, i samsvar med en proliferativ fenotype. Sammenlignet med sigarformede normale glatte muskelceller, inneholder spindelformede LAM-celler mindre cytoplasma og er mindre eosinofile. Østrogen- og progesteronreseptorer er også tilstede i LAM -lesjoner, men ikke i tilstøtende normalt lungevev. LAM-lesjoner uttrykker lymfatiske markører LYVE-1, PROX1, podoplanin og VEGFR-3. De glatte muskellignende cellene til AML er morfologisk og immunhistokjemisk lik LAM-celler, inkludert reaktivitet med antistoffer rettet mot aktin, desmin, vimentin og HMB-45 samt østrogen- og progesteronreseptorer. I motsetning til de utvidede luftrommene i emfysem, kan de cystiske mellomrommene som finnes i LAM være delvis foret med hyperplastiske type II -celler.
Behandling
Et FDA-godkjent legemiddel for behandling av LAM, mTOR- hemmeren sirolimus , er tilgjengelig for stabilisering av nedsatt lungefunksjon. Lungetransplantasjon er fortsatt den siste utveien for pasienter med avansert sykdom.
Pneumothorax
Pneumothoraces hos LAM -pasienter har en tendens til å gjenta seg, spesielt etter konservativ behandling som observasjon, aspirasjon eller enkel tube thoracostomy. Over 65% av LAM -pasientene utvikler pneumothorax i løpet av sykdommen, i gjennomsnitt 3,5 pneumothoraces hos de som har minst en pneumothorax. LAM Foundation Pleural Consensus Group tok til orde for bruk av pleural symfyseprosedyre med den første pneumothorax, gitt større sjanse for tilbakefall enn 70%. Kjemisk sklerose, mekanisk slitasje, talkum og pleurektomi har vært effektive hos pasienter med LAM, men mekanisk slitasje foretrekkes for de som kan trenge lungetransplantasjon i fremtiden. Omtrent halvparten av LAM -pasientene som har gjennomgått transplantasjon har hatt en tidligere pleurodesisprosedyre , og mer enn 75% av dem hadde tidligere bilateral pleurodesis . Selv om pleurodesis ikke er en kontraindikasjon for transplantasjon, kan det resultere i økt perioperativ blødning.
Chylothorax
Chyle forårsaker vanligvis ikke pleural betennelse eller fibrose. Små stabile chylous -effusjoner krever sjelden inngrep når LAM -diagnosen er stilt. Kortpustethet kan føre til mulig gjentatt drenering. Sirolimus er effektivt for chylouseffusjoner, og de fleste eksperter mener at det bør brukes som den første behandlingslinjen. Avbildning av kilden til lekkasjen med tung T2-vektet MR eller kontrastlymfangiografi er anbefalt for ildfaste effusjoner. Noen lekkasjer kan utsettes for embolisering gjennom katetre som tres fra lyske lymfeknuter inn i thoraxkanalen . Thoraxkanal ligering kan vurderes, men siden thorax effusjoner noen ganger stammer fra ascites som siphones inn i brystet ved belgvirkning av thorax, er det viktig å utelukke en magekilde før du vurderer dette alternativet. Pleural symfyse kan være nødvendig for å forhindre ernæringsmessige og lymfocyttmangel som kan skyldes gjentatte kraner eller vedvarende drenering. Kjemisk pleurodese er generelt en effektiv behandling for chylothorax, det samme er mekanisk slitasje og talkum.
Angiomyolipom
Nyre angiomyolipomer (AML) kan kreve embolisering eller cauterisering for kontroll av blødning, en komplikasjon som antas å være mer vanlig når tumordiameter overstiger 4 cm. Omfanget av aneurysmal endring kan avgjøre blødningsrisiko. Seriell abdominal avbildning bør utføres for å vurdere AML-størrelse med 6- til 12 måneders intervaller, i hvert fall til trender i vekst er klare. Nephron som sparer delvise reseksjoner kan vurderes for svært store svulster. Nefrektomi er noen ganger nødvendig for svulster med intravaskulær forlengelse eller andre årsaker, men er sjelden valgfri metode for AML -er som kan administreres med mindre invasive midler. Everolimus er godkjent av US Food and Drug Administration (FDA) for AML -behandling.
Lymphangioleiomyoma
Lymphangioleiomyomatoses er væskefylte hypodense strukturer som finnes i de retroperitoneale områdene i magen og bekkenet hos omtrent 30% av LAM-pasientene. De krever vanligvis ikke inngrep. Biopsi eller reseksjon kan føre til langvarig lekkasje. mTOR -hemmere er effektive til å krympe størrelsen på lymfangioleiomyomatose, og kan føre til total oppløsning.
Ledelse-annet
Østrogenholdige medisiner kan forverre LAM og er kontraindisert. Midler som motvirker effekten av østrogen har ikke vist seg å være effektive for behandling, men det er ikke gjort riktige forsøk. En forsøk på bronkodilatatorer bør vurderes hos LAM -pasienter, fordi opptil 17% til 25% har bronkodilatatorresponsiv luftstrømobstruksjon. Oksygen bør administreres for å opprettholde oksyhemoglobinmetninger på mer enn 90% med hvile, trening og søvn. Bondensitometri bør vurderes hos alle pasienter som er immobilisert og/eller på antiøstrogenbehandlinger, og passende behandling innført for osteoporotiske pasienter. Riktig oppmerksomhet bør rettes mot kardiovaskulær helse etter naturlig eller indusert overgangsalder . Vaksinasjoner mot pneumokokker og influensa bør holdes oppdatert. Lungerehabilitering ser ut til å være spesielt givende hos unge, motiverte pasienter med obstruktiv lungesykdom, men studier for å vurdere denne intervensjonens effekt på treningstoleranse, kondisjonering og livskvalitet er ikke gjort.
Medisinering
Sirolimus er en mTOR -hemmer som stabiliserer lungefunksjonen og forbedrer noen livstiltak hos LAM -pasienter. Den er godkjent av FDA for bruk i LAM, basert på resultatene fra Multicenter International LAM Efficacy and Safety of Sirolimus (MILES) -prøven. MILES -data støtter bruk av sirolimus hos pasienter som har unormal lungefunksjon (dvs. FEV1 <70% forutsagt). Om fordelene ved behandling oppveier risikoen for asymptomatiske LAM -pasienter med normal lungefunksjon er ikke klart, men noen leger vurderer behandling for fallende pasienter som nærmer seg det unormale området for FEV1. Sirolimus ser også ut til å være effektiv for behandling av chylous effusjoner og lymfangioleiomyomatose. Fordelene med sirolimus vedvarer bare mens behandlingen fortsetter. Sikkerheten ved langtidsbehandling er ikke undersøkt.
Potensielle bivirkninger fra mTOR -hemmere inkluderer hevelse i anklene, akne, munnsår, dyspepsi , diaré, forhøyelse av kolesterol og triglyserider , hypertensjon og hodepine. Sirolimus pneumonitt og latent malignitet er mer alvorlige bekymringer, men forekommer sjelden. Sirolimus hemmer sårheling. Det er viktig å stoppe behandlingen med stoffet i 1-2 uker før og etter valgfrie prosedyrer som krever optimal sårheling. Forholdsregler må tas for å unngå langvarig sollys på grunn av økt risiko for hudkreft .
Behandling med en annen mTOR-hemmer, everolimus , ble rapportert i en liten, åpen studie for å være assosiert med forbedring i FEV1 og seks minutters gangavstand. Serumnivåer av VEGF-D og kollagen IV ble redusert ved behandling. Bivirkninger var generelt konsistente med de som er kjent for å være assosiert med mTOR -hemmere, selv om noen var alvorlige og inkluderte perifert ødem , lungebetennelse, hjertesvikt og Pneumocystis jirovecii -infeksjon. Eskalerende doser av everolimus ble brukt, opptil 10 mg per dag; høyere enn det som vanligvis brukes klinisk for LAM.
Serum VEGF-D konsentrasjon er nyttig, prediktiv og prognostisk biomarkør. Høyere VEGF-D-nivåer ved utgangspunktet forutsier raskere sykdomsprogresjon og en mer robust behandlingsrespons.
Hormonelle tilnærminger til behandling har aldri blitt testet i riktige forsøk. I mangel av bevist fordel anbefales behandling med progesteron , GnRh -agonister (f.eks. Leuprorelin , goserelin ) og tamoxifen ikke rutinemessig. Doxycyklin hadde ingen effekt på hastigheten på nedgang i lungefunksjonen i en dobbeltblind studie.
Sirolimus er ofte effektivt som førstelinjebehandling for chylothorax. Hvis chylous lekkasje eller akkumuleringer vedvarer til tross for behandling, kan det vurderes avbildning med tung T2 -vektet MR, MR -lymfangiografi eller thoraxkanallymfangiografi. Pleural fusjonsprosedyrer kan vurderes i ildfaste tilfeller.
Prognose
Overlevelsesestimater varierer, avhengig av presentasjonsmåte eller konstatering, og har generelt gått oppover, sannsynligvis på grunn av tidligere gjenkjenning gjennom mer utbredt bruk av CT -skanning. I en nylig populasjonsbasert kohortundersøkelse ble medianoverlevelse funnet å være 29 år. Data fra tidligere store case -serier indikerte at 38% til 78% av pasientene var i live 8,5 år fra sykdomsdebut.
Pasienter utvikler vanligvis progressiv luftstrømobstruksjon. I en pasientkull i Storbritannia, 10 år etter symptomdebut, var 55% av 77 pasienter andpustne på flat mark og 10% var hjemmebundet. Den gjennomsnittlige årlige nedgangshastigheten for FEV1 og DLCO hos 275 pasienter studert i et enkelt lungefunksjonslaboratorium ved NHLBI var henholdsvis 75 ± 9 ml og 0,69 ± 0,07 ml/min/mm Hg. I andre serier fra Europa var nedgangen i FEV1 betydelig høyere, anslått til omtrent 100 til 120 ml/år. I MILES -studien mistet pasienter i placebogruppen 134 cc/år. Det var noen bevis i disse studiene på at nedgang i lungefunksjon korrelerer med første DLCO, med overgangsalderstatus og høyt VEGF-D ved baseline.
Estimater av median overlevelse varierer fra 10 til 30 år, avhengig av om sykehusbaserte eller populasjonsbaserte kohorter studeres.
Epidemiologi
LAM er nesten helt begrenset til kvinner. Mens lungecyster som er forenlig med LAM er rapportert hos noen menn med tuberøs sklerose, utvikler svært få av disse mennene symptomer. Prevalensen av LAM er estimert ved hjelp av data fra registre og pasientgrupper og er mellom 3,4 og 7,8/million kvinner. Antall nye tilfeller hvert år er mellom 0,23 og 0,31/million kvinner/år i USA, Storbritannia og Sveits. Variasjonen mellom land og mellom tilstøtende stater i USA antyder at et betydelig antall kvinner med LAM forblir udiagnostisert eller at symptomene deres tilskrives andre sykdommer. Voksne kvinner med tuberøs sklerose er mer sannsynlig å utvikle LAM enn kvinner uten tuberøs sklerose. Kohorter av pasienter med tuberøs sklerose har blitt screenet for LAM ved hjelp av CT -skanning. I en retrospektiv studie av voksne med tuberøs sklerose viste CT lungecyster hos 42% av 95 kvinner og 13% av 91 menn. Generelt var lungecyster større og flere hos kvinner enn hos menn. I en ytterligere retrospektiv studie av kvinner med TSC som gjennomgikk CT -skanning for å oppdage LAM, hadde 25% av de i 20 -årene lungecyster, mens 80% av kvinnene i 40 -årene ble påvirket, noe som tyder på at utviklingen av LAM er aldersavhengig minst i tuberøs sklerose-relatert LAM. Selv om forekomsten av tuberøs sklerose ved 1 av 6000 fødsler er mye større enn for LAM, ser de fleste lungeklinikker flere tilfeller av sporadisk enn tuberøs sklerose-LAM: sannsynligvis på grunn av en kombinasjon av lave nivåer av screening for LAM ved tuberøs sklerose og i mange, fravær av symptomer.
Kvinnekjønn og tuberøs sklerose er de eneste kjente risikofaktorene. Selv om bruk av supplerende østrogen ikke er assosiert med utvikling av LAM, antydet en studie at bruk av østrogenholdige p-piller var forbundet med tidligere utbrudd.
Det forekommer hos mer enn 30% av kvinnene med tuberøs sklerose-kompleks (TSC-LAM), et arvelig syndrom som er assosiert med anfall , kognitiv svekkelse og godartede svulster i flere vev. De fleste LAM-pasienter som presenterer for medisinsk evaluering har imidlertid den sporadiske sykdomsformen (S-LAM), som imidlertid ikke er forbundet med andre manifestasjoner av tuberøs sklerose-kompleks.
Mild cystisk endring i samsvar med LAM er beskrevet hos 10–15% av menn med TSC, men symptomatisk LAM hos menn er sjelden. Sporadisk LAM forekommer utelukkende hos kvinner, med et publisert unntak til dags dato. Både TSC-LAM og S-LAM er assosiert med mutasjoner i tuberøs sklerosegener.
Svangerskap
Det er rapportert at graviditet forverrer LAM i noen tilfeller. Risikoen er imidlertid ikke grundig undersøkt. I en undersøkelse blant 318 pasienter som indikerte at de hadde hatt minst ett svangerskap, svarte 163 på en andre undersøkelse med fokus på lungekollaps. Totalt 38 pasienter rapporterte pneumothorax med graviditet, i samsvar med en forekomst av pneumothorax under graviditet på minst 10% (38 av 318). Hos en tredjedel av pasientene førte pneumothorax under graviditet til LAM -diagnosen. Pneumothoraces var nesten dobbelt så hyppige til høyre som til venstre, og fire kvinner fikk bilateral spontan pneumothorax. De fleste pneumothoraces fant sted i andre og tredje trimester. Denne studien og andre antyder at graviditet er forbundet med pleurale komplikasjoner hos LAM -pasienter. Få kvinner med kjent LAM -diagnose velger å bli gravide, og pasienter der LAM diagnostiseres under graviditet, har sjelden tilgjengelige lungefunksjonstester tilgjengelig, noe som kompliserer dette spørsmålet.
Samfunn
LAM -stiftelsen ble grunnlagt i 1995 som en grasrotorganisasjon for å gi pasientoppfordring og forskningsmidler. I dag gir LAM Foundation støtte og utdanning for kvinner med LAM og deres familier, engasjerer leger og forskere til å fortsette å lære mer om sykdommen, og samler inn midler til fortsatt studie av LAM. Den søker trygge og effektive behandlinger, og til syvende og sist en kur, for lymfangioleiomyomatose. Det har hovedkontor i Cincinnati, Ohio.
I populærkulturen
I " Lucky Thirteen ", den femte episoden av den femte sesongen av House , ble Spencer (Angela Gots) diagnostisert med LAM, selv om det senere ble funnet å være et tilfelle av Sjögrens syndrom .
Se også
Referanser
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |