Metallisk binding - Metallic bonding
| Typer radier |
|---|
Metallisk binding er en type kjemisk binding som oppstår fra den elektrostatiske tiltrekningskraft mellom lednings elektroner (i form av en elektron sky av delokaliserte elektroner ) og positivt ladede metallioner . Det kan beskrives som deling av frie elektroner mellom en struktur av positivt ladede ioner ( kationer ). Metallbinding utgjør mange fysiske egenskaper til metaller, for eksempel styrke , duktilitet , termisk og elektrisk motstand og ledningsevne , opasitet og glans .
Metallbinding er ikke den eneste typen kjemisk binding som et metall kan utvise, selv som et rent stoff. For eksempel består elementært gallium av kovalentbundne par av atomer i både flytende og fast tilstand - disse parene danner en krystallstruktur med metallbinding mellom seg. Et annet eksempel på en metall-metall kovalent binding er det kvikksølve ionet ( Hg2+
2).
Historie
Da kjemi utviklet seg til en vitenskap, ble det klart at metaller utgjorde størstedelen av elementets periodiske system , og det ble gjort store fremskritt i beskrivelsen av saltene som kan dannes i reaksjoner med syrer . Med fremkomsten av elektrokjemi ble det klart at metaller generelt går i løsning som positivt ladede ioner, og oksidasjonsreaksjonene til metallene ble godt forstått i deres elektrokjemiske serie. Et bilde dukket opp av metaller som positive ioner holdt sammen av et hav av negative elektroner.
Med fremkomsten av kvantemekanikken fikk dette bildet en mer formell tolkning i form av den frie elektronmodellen og dens videre utvidelse, den nesten gratis elektronmodellen . I begge modeller blir elektronene sett på som en gass som beveger seg gjennom strukturen til det faste stoffet med en energi som i det vesentlige er isotrop, ved at den avhenger av kvadratet av størrelsen , ikke retningen til momentvektoren k . I tredimensjonalt k-rom, bør settet med punkter med de høyest fylte nivåene ( Fermi-overflaten ) derfor være en sfære. I den nesten gratis modellen blir bokslignende Brillouin-soner lagt til k-space av det periodiske potensialet som oppleves fra den (ioniske) strukturen, og dermed ødelegger isotropien mildt.
Fremkomsten av røntgendiffraksjon og termisk analyse gjorde det mulig å studere strukturen til krystallinske faste stoffer, inkludert metaller og deres legeringer; og fasediagrammer ble utviklet. Til tross for all denne fremgangen forble naturen til intermetalliske forbindelser og legeringer stort sett et mysterium, og studien deres var ofte bare empirisk. Kjemikere styrte generelt bort fra alt som ikke så ut til å følge Daltons lover med flere proporsjoner ; og problemet ble ansett som domenet til en annen vitenskap, metallurgi.
Den nesten gratis elektronmodellen ble ivrig tatt opp av noen forskere innen dette feltet, særlig Hume-Rothery , i et forsøk på å forklare hvorfor visse intermetalliske legeringer med visse sammensetninger ville dannes og andre ikke ville. Opprinnelig var Hume-Rotherys forsøk ganske vellykkede. Hans idé var å legge til elektroner for å blåse opp den sfæriske Fermi-ballongen inne i serien Brillouin-bokser og bestemme når en bestemt boks ville være full. Dette forutsa et ganske stort antall legeringskomposisjoner som senere ble observert. Så snart cyklotronresonans ble tilgjengelig og ballongens form kunne bestemmes, ble det funnet at antagelsen om at ballongen var sfærisk ikke holdt, bortsett fra kanskje i tilfelle av cesium . Dette funnet reduserte mange av konklusjonene til eksempler på hvordan en modell noen ganger kan gi en hel rekke riktige spådommer, men likevel være feil.
Det nesten gratis elektrondebakket viste forskere at enhver modell som antok at ioner var i et hav av frie elektroner trengte modifisering. Så det ble utviklet en rekke kvantemekaniske modeller - som beregninger av båndstruktur basert på molekylære orbitaler eller tetthetsfunksjonsteorien . I disse modellene avgår man enten fra atomorbitalene til nøytrale atomer som deler deres elektroner, eller (når det gjelder tetthetsfunksjonell teori) avgår fra den totale elektrontettheten. Det frie elektronbildet har likevel vært et dominerende bilde i utdanningen.
Den elektroniske båndstrukturmodellen ble et stort fokus ikke bare for studier av metaller, men enda mer for studiet av halvledere . Sammen med de elektroniske tilstandene ble vibrasjonstilstandene også vist å danne bånd. Rudolf Peierls viste at i tilfelle en endimensjonal rad med metallatomer - for eksempel hydrogen - måtte det oppstå ustabilitet som ville føre til at en slik kjede brytes ned i individuelle molekyler. Dette vakte interesse for det generelle spørsmålet: når er kollektiv metallbinding stabil, og når vil en mer lokalisert form for binding ta plass? Mye forskning gikk i studien av klynging av metallatomer.
Så kraftig som konseptet med båndstrukturmodellen viste seg å være i beskrivelsen av metallbinding, har den ulempen å forbli en en-elektron-tilnærming til et mangekroppsproblem. Med andre ord er energitilstandene til hvert elektron beskrevet som om alle de andre elektronene ganske enkelt danner en homogen bakgrunn. Forskere som Mott og Hubbard innså at dette kanskje var passende for sterkt avlokaliserte s - og p- elektroner ; men for d- elektroner, og enda mer for f- elektroner, kan interaksjonen med elektroner (og atomforskyvninger) i lokalmiljøet bli sterkere enn delokaliseringen som fører til bredbånd. Dermed ble overgangen fra lokaliserte uparrede elektroner til omreisende som deltar i metallbinding mer forståelig.
Naturen til metallisk binding
Kombinasjonen av to fenomener gir opphav til metallbinding: delokalisering av elektroner og tilgjengeligheten av et langt større antall delokaliserte energitilstander enn av avlokaliserte elektroner. Sistnevnte kan kalles elektronmangel .
I 2D
Grafen er et eksempel på todimensjonal metallbinding. Dens metallbindinger ligner aromatisk binding i benzen , naftalen , antracen , ovalen , etc.
I 3D
Metallaromaticitet i metallklynger er et annet eksempel på delokalisering, denne gangen ofte i tredimensjonale arrangementer. Metaller tar delokaliseringsprinsippet til det ytterste, og man kan si at en krystall av et metall representerer et enkelt molekyl over hvilket alle ledningselektroner blir avlokalisert i alle tre dimensjoner. Dette betyr at inne i metallet kan man generelt ikke skille mellom molekyler, slik at metallbindingen verken er intra- eller intermolekylær. 'Ikke-molekylær' ville kanskje være et bedre begrep. Metallbinding er stort sett ikke-polær, for selv i legeringer er det liten forskjell mellom elektronegativitetene til atomene som deltar i bindingsinteraksjonen (og i rene grunnmetaller ingen i det hele tatt). Dermed er metallbinding en ekstremt delokalisert felles form for kovalent binding. På en måte er metallbinding i det hele tatt ikke en 'ny' type binding. Den beskriver bindingen bare som til stede i en del kondensert materie: det være seg krystallinsk fast stoff, væske eller til og med glass. Metalliske damper, i motsetning, er ofte atom ( Hg ) eller til tider inneholde molekyler, så som Na 2 , som holdes sammen av en mer konvensjonell kovalent binding. Dette er grunnen til at det ikke er riktig å snakke om en enkelt 'metallbinding'.
Delokalisering er mest uttalt for s - og p- elektroner. Delokalisering i cesium er så sterk at elektronene praktisk talt frigjøres fra cesiumatomer for å danne en gass som bare er begrenset av metallets overflate. For cesium er derfor ikke bildet av Cs + -ioner holdt sammen av en negativt ladet elektrongass unøyaktig. For andre elementer er elektronene mindre frie ved at de fremdeles opplever potensialet til metallatomer, noen ganger ganske sterkt. De krever en mer intrikat kvantemekanisk behandling (f.eks. Tett binding ) der atomene blir sett på som nøytrale, omtrent som karbonatomer i benzen. For d - og spesielt f - elektroner er delokaliseringen ikke sterk i det hele tatt, og dette forklarer hvorfor disse elektronene er i stand til å fortsette å oppføre seg som uparede elektroner som beholder sin spinn, og tilfører interessante magnetiske egenskaper til disse metallene.
Elektronmangel og mobilitet
Metallatomer inneholder få elektroner i deres valens skjell i forhold til sine perioder eller energinivå . De er elektronmangel, og felles deling endrer ikke det. Det er langt flere tilgjengelige energitilstander enn det er delte elektroner. Begge kravene til ledningsevne er derfor oppfylt: sterk delokalisering og delvis fylte energibånd. Slike elektroner kan derfor lett skifte fra en energitilstand til en litt annen. Dermed blir de ikke bare avlokalisert og danner et hav av elektroner som gjennomsyrer strukturen, men de er også i stand til å migrere gjennom strukturen når et eksternt elektrisk felt påføres, noe som fører til elektrisk ledningsevne. Uten feltet er det elektroner som beveger seg likt i alle retninger. Innenfor et slikt felt vil noen elektroner justere tilstanden litt og vedta en annen bølgevektor . Følgelig vil det være flere bevegelige veier enn en annen, og netto strøm vil resultere.
Elektroners frihet til å migrere gir også metallatomer, eller lag av dem, kapasiteten til å gli forbi hverandre. Lokalt kan obligasjoner lett brytes og erstattes av nye etter en deformasjon. Denne prosessen påvirker ikke felles metallbinding veldig mye, noe som gir metallers karakteristiske smidighet og duktilitet . Dette gjelder spesielt for rene elementer. I nærvær av oppløste urenheter kan de normalt lett dannede spaltinger blokkeres og materialet blir hardere. Gull er for eksempel veldig mykt i ren form (24 karat ), og det er derfor legeringer foretrekkes i smykker.
Metaller er vanligvis også gode varmeledere, men ledningselektronene bidrar bare delvis til dette fenomenet. Kollektive (dvs. avlokaliserte) vibrasjoner fra atomene, kjent som fononer som beveger seg gjennom det faste stoffet som en bølge, er større bidragsytere.
Et stoff som diamant , som leder varme ganske bra, er imidlertid ikke en elektrisk leder. Dette er ikke en konsekvens av at delokalisering er fraværende i diamant, men ganske enkelt at karbon ikke er elektronmangel.
Elektronmangel er viktig for å skille metallisk fra mer konvensjonell kovalent binding. Dermed bør vi endre uttrykket gitt til: Metallbinding er en ekstremt delokalisert felles form for elektronmangel kovalent binding .
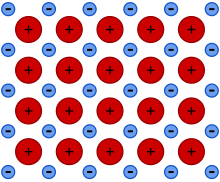
Metallisk radius
Metallradien er definert som halvparten av avstanden mellom de to tilstøtende metallionene i metallstrukturen. Denne radiusen avhenger av atomets natur så vel som omgivelsene - spesielt av koordinasjonsnummeret (CN), som igjen avhenger av temperaturen og det påførte trykket.
Når man sammenligner periodiske trender i størrelsen på atomer, er det ofte ønskelig å anvende den såkalte Goldschmidt-korreksjonen, som konverterer atomradier til verdiene atomene ville ha hvis de var 12-koordinerte. Siden metalliske radier er størst for det høyeste koordinasjonstallet, innebærer korreksjon for mindre tette koordinasjoner å multiplisere med x, hvor 0 <x <1. Spesielt for CN = 4, x = 0,88; for CN = 6, x = 0,96, og for CN = 8, x = 0,97. Rettelsen er oppkalt etter Victor Goldschmidt som fikk de numeriske verdiene som er sitert ovenfor.
Radiene følger generelle periodiske trender : de avtar over hele perioden på grunn av økningen i den effektive kjernefysiske ladningen , som ikke blir oppveid av det økte antallet valenselektroner ; men radiene øker nedover i gruppen på grunn av en økning i hovedkvantetallet . Mellom 4 d og 5 d elementene observeres lantanidkontraksjonen - det er veldig liten økning av radien nedover i gruppen på grunn av tilstedeværelsen av dårlig skjermende f orbitaler .
Styrken på båndet
Atomene i metaller har en sterk tiltrekningskraft mellom seg. Det kreves mye energi for å overvinne den. Derfor har metaller ofte høye kokepunkter, med wolfram (5828 K) som er ekstremt høy. Et bemerkelsesverdig unntak er elementene i sinkgruppen : Zn, Cd og Hg. Deres elektronkonfigurasjon ende i ... n s 2 , som ligner en edelgasskonfigurasjon, som det av helium , mer og mer når det går ned i det periodiske system, fordi energien differensial til de tomme n p orbitaler blir større. Disse metallene er derfor relativt flyktige og unngås i ultrahøyvakuumsystemer .
Ellers kan metallbinding være veldig sterk, selv i smeltede metaller, som gallium . Selv om gallium vil smelte fra håndvarmen like over romtemperatur, er kokepunktet ikke langt fra kobberens. Smeltet gallium er derfor en veldig ikke-flyktig væske takket være sin sterke metallbinding.
Den sterke bindingen av metaller i flytende form viser at energien til en metallbinding ikke er sterkt avhengig av bindingsretningen; denne mangelen på bindingsretning er en direkte konsekvens av elektrondelokalisering, og forstås best i motsetning til retningsbinding av kovalente bindinger. Energien til en metallbinding er således for det meste en funksjon av antall elektroner som omgir metallatomet, som eksemplifisert av den innebygde atommodellen . Dette resulterer vanligvis i at metaller antar relativt enkle, tettpakede krystallstrukturer, slik som FCC, BCC og HCP.
Gitt høy nok kjølehastigheter og passende legeringssammensetning, kan metallbinding forekomme selv i glass som har amorfe strukturer.
Mye biokjemi medieres av den svake interaksjonen mellom metallioner og biomolekyler. Slike interaksjoner, og deres tilknyttede konformasjonsendringer , har blitt målt ved bruk av dobbel polarisasjonsinterferometri .
Løselighet og dannelse av forbindelser
Metaller er uoppløselige i vann eller organiske løsningsmidler, med mindre de gjennomgår en reaksjon med dem. Vanligvis er dette en oksidasjonsreaksjon som frarøver metallatomer av deres omreisende elektroner, og ødelegger metallbindingen. Imidlertid er metaller ofte lett oppløselige i hverandre mens de beholder metallkarakteren til deres binding. Gull, for eksempel, oppløses lett i kvikksølv, selv ved romtemperatur. Selv i faste metaller kan løseligheten være omfattende. Hvis strukturene til de to metallene er de samme, kan det til og med være fullstendig fastløselighet , som i tilfellet med electrum , en legering av sølv og gull. Noen ganger vil imidlertid to metaller danne legeringer med forskjellige strukturer enn noen av de to foreldrene. Man kan kalle disse materialene metallforbindelser . Men fordi materialer med metallbinding vanligvis ikke er molekylære, er Daltons lov om integrerte proporsjoner ikke gyldig; og ofte kan en rekke støkiometriske forhold oppnås. Det er bedre å forlate begreper som 'ren substans' eller 'løsemiddel' i slike tilfeller og snakke om faser i stedet. Studiet av slike faser har tradisjonelt vært mer metallurgi enn kjemi , selv om de to feltene overlapper betydelig.
Lokalisering og gruppering: fra binding til obligasjoner
Metallbinding i komplekse forbindelser involverer ikke nødvendigvis alle bestanddeler likt. Det er fullt mulig å ha ett eller flere elementer som ikke deltar i det hele tatt. Man kan forestille seg ledningselektronene som flyter rundt dem som en elv rundt en øy eller en stor stein. Det er mulig å observere hvilke elementer som deltar: f.eks. Ved å se på kjernnivåene i et røntgenfotoelektronspektroskopi (XPS) spektrum. Hvis et element deltar, har toppene en tendens til å være skjev.
Noen intermetalliske materialer, for eksempel, viser metallklynger som minner om molekyler; og disse forbindelsene er mer et tema for kjemi enn for metallurgi. Dannelsen av klyngene kan sees på som en måte å 'kondensere ut' (lokalisere) den elektronmangelbindingen til bindinger av mer lokalisert natur. Hydrogen er et ekstremt eksempel på denne formen for kondens. Ved høyt trykk er det metall . Kjernen til planeten Jupiter kan sies å holdes sammen av en kombinasjon av metallbinding og høyt trykk indusert av tyngdekraften. Ved lavere trykk blir imidlertid bindingen fullstendig lokalisert til en vanlig kovalent binding. Til lokalisering er så fullstendig at (den mer kjente) H 2 gass resultater. Et lignende argument gjelder for et element som bor. Selv om det er elektronmangel sammenlignet med karbon, danner det ikke et metall. I stedet har den en rekke komplekse strukturer der icosahedral B 12 klynger dominerer. Ladetetthetsbølger er et beslektet fenomen.
Ettersom disse fenomenene involverer atomenes bevegelse mot eller bort fra hverandre, kan de tolkes som koblingen mellom materialets elektroniske og vibrasjonstilstander (dvs. fononene). En annen slik elektron-fonon-interaksjon antas å føre til et helt annet resultat ved lave temperaturer, det av superledningsevne . I stedet for å blokkere mobiliteten til ladebærerne ved å danne elektronpar i lokaliserte bindinger, dannes Cooper-par som ikke lenger opplever noen motstand mot deres mobilitet.
Optiske egenskaper
Tilstedeværelsen av et hav av mobile ladningsbærere har store effekter på de optiske egenskapene til metaller, som bare kan forstås ved å betrakte elektronene som et kollektivt , snarere enn å vurdere tilstandene til individuelle elektroner som er involvert i mer konvensjonelle kovalente bindinger.
Lys består av en kombinasjon av et elektrisk og et magnetfelt. Det elektriske feltet er vanligvis i stand til å opphisse en elastisk respons fra elektronene som er involvert i metallbinding. Resultatet er at fotoner ikke kan trenge veldig langt inn i metallet og reflekteres vanligvis, selv om noen også kan absorberes. Dette gjelder like for alle fotoner i det synlige spekteret, og det er derfor metaller ofte er sølvhvite eller gråaktige med den karakteristiske speilrefleksjonen av metallisk glans . Balansen mellom refleksjon og absorpsjon bestemmer hvor hvitt eller hvor grått et metall er, selv om overflateplekk kan tilsløre glansen. Sølv, et metall med høy ledningsevne, er en av de hviteste.
Merkbare unntak er rødlig kobber og gulaktig gull. Årsaken til fargen er at det er en øvre grense for lysfrekvensen som metallelektroner lett kan svare på: plasmonfrekvensen . Ved plasmonfrekvensen går den frekvensavhengige dielektriske funksjonen til den frie elektrongassen fra negativ (reflekterende) til positiv (overføring); høyfrekvente fotoner reflekteres ikke på overflaten, og bidrar ikke til metallfargen. Det er noen materialer, som indiumtinnoksid (ITO), som er metalliske ledere (faktisk degenererte halvledere ) som denne terskelen ligger i infrarødt , og derfor er de gjennomsiktige i de synlige, men gode reflektorene i infrarødt.
For sølv er begrensningsfrekvensen i langt ultrafiolett, men for kobber og gull er den nærmere det synlige. Dette forklarer fargene på disse to metallene. På overflaten av et metall kan det oppstå resonanseffekter kjent som overflateplasmoner . De er kollektive svingninger av ledningselektronene, som en krusning i det elektroniske hav. Imidlertid, selv om fotoner har nok energi, har de vanligvis ikke nok fart til å sette krusningen i bevegelse. Derfor er det vanskelig å stimulere plasmoner på et bulkmetall. Dette er grunnen til at gull og kobber ser ut som glansfulle metaller, om enn med en dash av farger. Imidlertid er metallbindingen i kolloidalt gull begrenset til en liten metallisk partikkel, som forhindrer at plasmons oscillasjonsbølge "løper bort". Regelen for momentumvalg er derfor brutt, og plasmonresonansen forårsaker en ekstremt intens absorpsjon i det grønne, med en resulterende lilla-rød farge. Slike farger er størrelsesordener mer intense enn vanlige absorpsjoner sett i fargestoffer og lignende, som involverer individuelle elektroner og deres energitilstander.
