Nanoshell - Nanoshell
| Del av en serie artikler om |
| Nanomedisin |
|---|
| Se også |
En nanoshell , eller rettere en nanoshell plasmon , er en type sfærisk nanopartikkel som består av en dielektrisk kjerne som er dekket av et tynt metallskall (vanligvis gull ). Disse nanoskjellene involverer en kvasepartikkel kalt plasmon, som er en kollektiv eksitasjon eller kvanteplasmasvingning der elektronene samtidig svinger med hensyn til alle ioner.
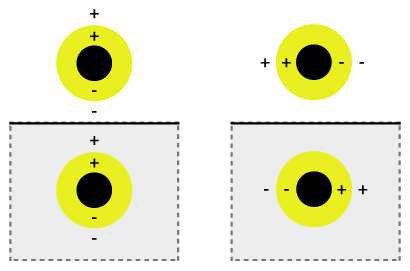
Den samtidige svingningen kan kalles plasmon-hybridisering der avstemmingen til svingningen er assosiert med blanding av det indre og ytre skallet der de hybridiserer for å gi lavere energi eller høyere energi. Denne lavere energien kobles sterkt til innfallende lys, mens den høyere energien er en anti-binding og svakt kombineres med innfallende lys. Hybridiseringsinteraksjonen er sterkere for tynnere skalllag, derfor bestemmer tykkelsen på skallet og den totale partikkelradius hvilken bølgelengde på lyset det kobles sammen med. Nanoshells kan varieres over et bredt spekter av lysspekteret som spenner over de synlige og nær infrarøde områdene. Samspillet mellom lys og nanopartikler påvirker plasseringen av ladninger som påvirker koblingsstyrken. Hendelseslys polarisert parallelt med underlaget gir en s-polarisering (figur 1b), derfor er ladningene lenger fra underlagsoverflaten, noe som gir en sterkere interaksjon mellom skallet og kjernen. Ellers dannes en p-polarisering som gir en sterkere forskjøvet plasmonenergi som forårsaker en svakere interaksjon og kobling.
Oppdagelse
Oppdagelsen av nanoshell ble gjort av professor Naomi J. Halas og hennes team ved Rice University i 2003. Da hun og hennes team oppdaget nanoshells, var de ikke i utgangspunktet sikre på hvilket potensial slike nanoshells inneholdt. "Vi sa:" Gee, hva kan det være bra for? ", Sa Halas til CNN. Etter mange forslag kom kreftterapi ut av pågående samarbeid med bioteknikere på jakt etter forskjellige typer biomedisinske applikasjoner. "En av våre visjoner", uttalte Halas, "ikke mindre enn en enkelt diagnose og behandling av kreft". I 2003 ble Halas tildelt for beste oppdagelse i 2003 av Nanotechnology Now .
Produksjon
En toppmoderne metode for syntetisering av nanoshell av gull er bruken av mikrofluidkomposittskum. Denne metoden har potensial til å erstatte den standard litografiske metoden for å syntetisere plasmoniske nanoshell. Produksjonsprosessen beskrevet nedenfor var et eksperiment utført av Suhanya Duraiswamy og Saif A. Khan fra Department of Chemical and Biomolecular Engineering i Singapore. Selv om denne metoden var et eksperiment, representerer den fremtiden for nanoshells-syntese.
Materialene som kreves for produksjon av nanoshellene er følgende; Tetraetylortosilikat, ammoniumhydroksid, hydroksylaminhydroklorid, 3-aminopropyltris, hydrogentetrakloroaurat (III) trihydrat, tetrakis (hydroksymetyl) fosfoniumklorid, natriumhydroksid, kaliumkarbonat, etanol, ultrarent vann og glassvarer vasket i vann og skyllet grundig i vann.
Det første trinnet i å syntetisere nanoshells i denne metoden er ved å lage enheten for at reaksjonen skal finne sted innenfor. Mikrofluidiske enhetsmønstre ble produsert på silisiumplater ved standard fotolitografi ved bruk av negativ fotoresist SU-8 2050. Enheter ble deretter støpt i poly (dimetylsiloksan) (PDMS) ved bruk av den myke litografiteknikken. (40) Kort fortalt ble PDMS støpt på SU- 8 mestere ved 70 ° C i 4 timer, skrelt, kuttet og rengjort. Innløps- og utløpshull (1/16-in. Od) ble stanset i enheten. Mikrokanalene ble irreversibelt bundet til et glassrute som var belagt med et tynt lag av PDMS etter en kort 35 s luftplasma-behandling. Mikrokanalene har rektangulært tverrsnitt og er 300 μm brede, 155 μm dype og 0,45 m lange.
Den faktiske produksjonen av nanopartiklene innebærer å pumpe "silikonolje, en blanding av gullfrøte silisiumdioksydpartikler og gullbeleggoppløsning og reduksjonsmiddeloppløsning til mikrofluidanordningen mens nitrogengass ble levert fra en sylinder." Pletteringsløsningen ble deretter forlatt å eldes i et kontrollert miljø i mer enn 24 timer. Etter aldringsprosessen samles væsken fra mikrofluidanordningen og plasseres i en sentrifuge. Den resulterende væsken har et lag med olje på overflaten med en løsning nedenfor som inneholder nanoshellene.
Årsaken til at denne metoden er revolusjonerende er at størrelsen og den relative tykkelsen på nanoskallet i gull kan kontrolleres ved å endre hvor lang tid reaksjonen får finne sted, samt konsentrasjonen av pletteringsløsningen. Dermed lar forskere skreddersy partiklene for å dekke deres gitte behov. Riktignok for optikk eller kreftbehandling.
Kreftbehandling
Gullskallede nanopartikler, som er sfæriske nanopartikler med silisiumdioksyd og / eller liposomkjerner og gullskall, brukes i kreftterapi og forbedring av biobildebehandling. Theranostiske prober - som er i stand til å oppdage og behandle kreft i en enkelt behandling - er nanopartikler som har bindingssteder på skallet som gjør at de kan feste seg til et ønsket sted (typisk kreftceller), og kan deretter avbildes gjennom dobbeltmodalitetsbilder (en bildestrategi som bruker røntgenstråler og radionuklide avbildning ) og gjennom nær-infrarød fluorescens. Årsaken til at nanopartikler i gull brukes på grunn av deres livlige optiske egenskaper som styres av deres størrelse, geometri og overflateplasmoner. Gullnanopartikler (som AuNPs) har fordelen av å være biokompatible og fleksibiliteten til å ha flere forskjellige molekyler, og grunnleggende materialer, festet til skallet (nesten alt som normalt kan festes til gull kan festes til gullnano-skallet, som kan brukes til å identifisere og behandle kreft). Behandling av kreft er bare mulig på grunn av spredning og absorpsjon som oppstår for plasmonics . Under spredning blir de gullbelagte nano-partiklene synlige for bildeprosesser som er innstilt på riktig bølgelengde, som er avhengig av størrelsen og geometrien til partiklene. Under absorpsjon forekommer fototermisk ablasjon , som varmer nanopartiklene og deres umiddelbare omgivelser til temperaturer som kan drepe kreftcellene. Dette oppnås med minimal skade på celler i kroppen på grunn av bruken av "vannvinduet" (spektralområdet mellom 800 og 1300 nm). Ettersom menneskekroppen for det meste er vann, optimaliserer dette lyset som brukes mot effekten som blir gitt.
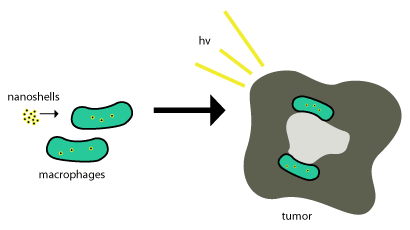
Disse nanoshellene i gull skyves inn i svulster ved bruk av fagocytose , der fagocytter oppsluk nanoshellene gjennom cellemembranen for å danne et indre fagosom eller makrofag . Etter dette blir den sendt inn i en celle, og enzymer brukes vanligvis til å metabolisere den og skyve den ut av cellen. Disse nanoshellene metaboliseres ikke, så for at de skal være effektive, trenger de bare å være i tumorcellene, og fotoindusert celledød (som beskrevet ovenfor) brukes til å avslutte tumorcellene. Denne ordningen er vist i figur 2.
Nanopartikkelbaserte terapier har blitt levert med suksess i svulster ved å utnytte den forbedrede permeabiliteten og retensjonseffekten, en egenskap som gjør at nanoskala strukturer kan tas opp passivt i svulster uten hjelp av antistoffer. [4] Levering av nanoshells til viktige regioner av svulster kan være veldig vanskelig. Det er her de fleste nanoskjell prøver å utnytte svulstens naturlige rekruttering av monocytter for levering som vist i figuren ovenfor. Dette leveringssystemet kalles en "trojansk hest".
Denne prosessen fungerer så bra siden svulster handler om ¾ makrofager, og når monocytter er ført inn i svulsten, skiller den seg ut i makrofager som også vil være behov for å opprettholde nanopartiklene . Når nanoshellene er i det nekrotiske sentrum, brukes nær-infrarød belysning for å ødelegge de svulstrelaterte makrofagene.
I tillegg kan disse nanopartiklene lages for å frigjøre antisense DNA-oligonukleotider når de er under fotoaktivering. Disse oligonukleotidene brukes i forbindelse med foto-termisk ablasjonsbehandlinger for å utføre genterapi. Dette oppnås fordi nanopartikkelkomplekser leveres inne i cellene og deretter gjennomgår lett indusert frigjøring av DNA fra overflaten. Dette vil tillate intern manipulering av en celle og gi et middel for å overvåke en gruppeceller tilbake til likevekt.
Et annet eksempel på nanoshell plasmonics i kreftbehandling innebærer å plassere legemidler inne i nanopartikkelen og bruke den som et middel for å levere giftige stoffer bare til kreftsteder. Dette oppnås ved å belegge utsiden av en nanopartikkel med jernoksid (muliggjør enkel sporing med en MR-maskin ), så når området av svulsten er belagt med legemiddelfylte nanopartikler, kan nanopartiklene aktiveres ved hjelp av resonante lysbølger for å frigjør stoffet.