Nucleus accumbens - Nucleus accumbens
| Nucleus accumbens | |
|---|---|
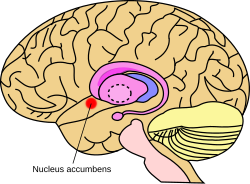 Omtrentlig plassering av kjernen accumbens i hjernen
| |
 Nucleus accumbens i musens hjerne
| |
| Detaljer | |
| Del av |
Mesolimbisk vei Basal ganglia ( Ventral striatum ) |
| Deler | Nucleus accumbens skall Nucleus accumbens kjerne |
| Identifikatorer | |
| Latin | nucleus accumbens septi |
| Akronym (er) | NAc eller NAcc |
| MeSH | D009714 |
| NeuroNames | 277 |
| NeuroLex ID | birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| Anatomiske termer for neuroanatomi | |
Den nucleus accumbens ( NAc eller NAcc , også kjent som accumbens kjernen , eller tidligere som nucleus accumbens Septi , latin for " kjernen ved siden av septum ") er en region i den basale forhjerne rostralt til preoptic område av hypothalamus . Nucleus accumbens og olfactory tubercle danner samlet det ventrale striatum . Det ventrale striatum og dorsale striatum danner samlet striatum , som er hovedkomponenten i basalganglier . De dopaminerge nevronene i den mesolimbiske banen prosjekterer på GABAergic medium piggne nevroner i nucleus accumbens og olfactory tubercle. Hver cerebral halvkule har sin egen nucleus accumbens, som kan deles inn i to strukturer: nucleus accumbens core og nucleus accumbens shell. Disse understrukturene har forskjellig morfologi og funksjoner.
Ulike NAcc-underregioner (kjerne vs skall) og nevron subpopulasjoner i hver region ( D1-type vs D2-type medium spiny neurons) er ansvarlige for forskjellige kognitive funksjoner . Som helhet har nucleus accumbens en vesentlig rolle i den kognitive behandlingen av motivasjon , aversjon , belønning (dvs. insentiv salience , nytelse og positiv forsterkning ) og forsterkningslæring (f.eks. Pavlovian-instrumental overføring ); Derfor har den en viktig rolle i avhengighet . I tillegg er en del av nucleus accumbens-kjernen sentralt involvert i induksjon av langsom bølgesøvn . Nucleus accumbens spiller en mindre rolle i behandlingen av frykt (en form for aversjon), impulsivitet og placebo -effekten . Det er også involvert i kodingen av nye motorprogrammer .
Struktur
Nucleus accumbens er et aggregat av nevroner som beskrives som å ha et ytre skall og en indre kjerne.
Inngang
Store glutamaterge innganger til nucleus accumbens omfatter den prefrontale cortex (spesielt prelimbic cortex og infralimbic cortex ), basolaterale amygdala , ventral hippocampus , thalamiske atomkjerner (spesielt midtlinjen thalamiske kjerner og intralaminar kjerner av thalamus ), og glutamaterge fremspring fra den ventrale tegmentale område (VTA). Nucleus accumbens mottar dopaminerge innganger fra det ventrale tegmentale området, som kobles til via den mesolimbiske banen . Nucleus accumbens beskrives ofte som en del av en kortico-basal ganglia-thalamo-cortical loop .
Dopaminerge innganger fra VTA modulerer aktiviteten til GABAergiske nevroner i nucleus accumbens. Disse nevronene aktiveres direkte eller indirekte av euforiserende medisiner (f.eks. Amfetamin , opiater , etc.) og ved å delta i givende opplevelser (f.eks. Sex, musikk, trening, etc.).
En annen viktig kilde til innspill kommer fra CA1 og det ventrale subikulumet til hippocampus til dorsomedialområdet til nucleus accumbens. Lette depolarisasjoner av celler i nucleus accumbens korrelerer med positiviteten til nevronene i hippocampus, noe som gjør dem mer spennende. De korrelerte cellene i disse eksiterte tilstandene til de medium spiny neuronene i nucleus accumbens deles likt mellom subiculum og CA1. Subiculum -nevronene er funnet å hyperpolarisere (øke negativiteten) mens CA1 -nevronene "krusninger" (brann> 50 Hz) for å oppnå denne primingen.
Nucleus accumbens er en av få regioner som mottar histaminergiske anslag fra tuberomammillærkjernen (den eneste kilden til histamin -nevroner i hjernen).
Produksjon
Utgangsneuronene til nucleus accumbens sender aksonale projeksjoner til de basale ganglier og den ventrale analogen til globus pallidus , kjent som ventral pallidum (VP). VP, på sin side, projiserer til den mediale dorsale kjernen i dorsal thalamus , som projiserer til prefrontal cortex, så vel som tilbake til ventralen og til dorsal striatum . Andre efferenter fra nucleus accumbens inkluderer forbindelser med halen til det ventrale tegmentale området , substantia nigra og retikulær dannelse av ponsene .
Skall
Den nucleus accumbens skallet ( NAcc skall ) er en underkonstruksjon av nucleus accumbens. Skallet og kjernen danner sammen hele nucleus accumbens.
Plassering: Skallet er det ytre området av nucleus accumbens, og anses - i motsetning til kjernen - å være en del av den utvidede amygdala , som ligger ved rostralpolen.
Celletyper: Neuroner i nucleus accumbens er for det meste middels spiny neuroner (MSN) som hovedsakelig inneholder D1-type (dvs. DRD1 og DRD5 ) eller D2-type (dvs. DRD2 , DRD3 og DRD4 ) dopaminreseptorer . En delpopulasjon av MSN inneholder både D1-type og D2-type reseptorer, med omtrent 40% av striatal MSN som uttrykker både DRD1 og DRD2 mRNA. Disse NAcc MSN av blandet type med både D1-type og D2-type reseptorer er stort sett begrenset til NAcc-skallet. Nevronene i skallet, sammenlignet med kjernen, har en lavere tetthet av dendritiske pigger , færre terminalsegmenter og færre grensegmenter enn de i kjernen. Skallneuronene projiserer til den underkommunale delen av det ventrale pallidum samt det ventrale tegmentale området og til omfattende områder i hypothalamus og utvidet amygdala.
Funksjon: Skallet til nucleus accumbens er involvert i den kognitive behandlingen av belønning , inkludert subjektive "likende" reaksjoner på visse behagelige stimuli , motivasjonsfremgang og positiv forsterkning . Det NAcc-skallet har også vist seg å formidle spesifikk Pavlovian-instrumental overføring , et fenomen der en klassisk betinget stimulus modifiserer operant atferd . Et "hedonisk hotspot" eller nytelsessenter som er ansvarlig for den behagelige eller "likende" komponenten i noen iboende belønninger, er også plassert i et lite rom i det mediale NAcc -skallet. Vanedannende legemidler har en større effekt på dopaminfrigivelse i skallet enn i kjernen.
Kjerne
Den nucleus accumbens kjerne ( NAcc kjerne ) er den indre underkonstruksjon av nucleus accumbens.
Plassering: Nucleus accumbens -kjernen er en del av det ventrale striatum , som ligger innenfor basalganglier. Celletyper: Kjernen i NAcc består hovedsakelig av middels spiny neuroner som hovedsakelig inneholder dopaminreseptorer av D1-type eller D2-type. D1-typen medium spiny neuroner medierer belønningsrelaterte kognitive prosesser, mens D2-type medium spiny neurons medierer aversjonsrelatert kognisjon. Nevronene i kjernen, sammenlignet med nevronene i skallet, har en økt tetthet av dendritiske pigger, grensegmenter og terminalsegmenter. Fra kjernen projiserer nevronene til andre subkortikale områder som globus pallidus og substantia nigra. GABA er en av de viktigste nevrotransmitterne i NAcc, og GABA -reseptorer er også rikelig.
Funksjon: Coreus accumbens-kjernen er involvert i den kognitive behandlingen av motorfunksjon knyttet til belønning og forsterkning og regulering av langsom bølgesøvn . Spesielt koder kjernen nye motorprogrammer som letter anskaffelsen av en gitt belønning i fremtiden. De indirekte banen (dvs. D2-type) nevroner i NAcc-kjernen som co-uttrykker adenosin A 2A- reseptorers aktiveringsavhengige fremme søvn med langsom bølge. NAcc-kjernen har også vist seg å formidle generell Pavlovian-instrumental overføring , et fenomen der en klassisk betinget stimulus modifiserer operant atferd.
Celletyper
Omtrent 95% av nevronene i NAcc er GABAergic medium spiny neurons (MSNs) som primært uttrykker enten D1-type eller D2-type reseptorer; om lag 1-2% av de gjenværende nevronatypene er store aspiny kolinerge interneuroner og ytterligere 1-2% er GABAergic interneuroner. Sammenlignet med GABAergic MSN -er i skallet, har de i kjernen en økt tetthet av dendritiske pigger, grensegmenter og terminalsegmenter. Fra kjernen projiserer nevronene til andre subkortikale områder som globus pallidus og substantia nigra. GABA er en av de viktigste nevrotransmitterne i NAcc, og GABA -reseptorer er også rikelig. Disse nevronene er også hovedprojeksjonen eller utgangsneuronene til nucleus accumbens.
Nevrokjemi
Noen av nevrotransmitterne, nevromodulatorene og hormonene som signaliserer gjennom reseptorer i nucleus accumbens inkluderer:
Dopamin : Dopamin frigjøres til nucleus accumbens etter eksponering for givende stimuli , inkludert rekreasjonsmedisiner som substituerte amfetamin , kokain , nikotin og morfin .
Fenetylamin og tyramin : Fenetylamin og tyramin er sporaminer som syntetiseres i nevroner som uttrykker det aromatiske aminosyrehydroksylase (AADC) enzymet , som inkluderer alle dopaminerge nevroner. Begge forbindelsene fungerer som dopaminerge nevromodulatorer som regulerer gjenopptak og frigjøring av dopamin til Nacc via interaksjoner med VMAT2 og TAAR1 iaksonterminalentil mesolimbiske dopaminneuroner.
Glukokortikoider og dopamin: Glukokortikoidreseptorer er de eneste kortikosteroidreseptorene i nucleus accumbens -skallet. L-DOPA , steroider og spesifikt glukokortikoider er for øyeblikket kjent for å være de eneste kjente endogene forbindelsene som kan forårsake psykotiske problemer, så å forstå den hormonelle kontrollen over dopaminerge fremskrivninger med hensyn til glukokortikoidreseptorer kan føre til nye behandlinger for psykotiske symptomer. En nylig studie viste at undertrykkelse av glukokortikoidreseptorene førte til en reduksjon i frigivelsen av dopamin, noe som kan føre til fremtidig forskning som involverer antiglukokortikoide legemidler for potensielt å lindre psykotiske symptomer.
GABA: En nylig studie på rotter som brukte GABA -agonister og antagonister indikerte at GABA A -reseptorer i NAcc -skallet har hemmende kontroll på svingadferd påvirket av dopamin, og GABA B -reseptorer har hemmende kontroll over snuatferd som er mediert av acetylkolin .
Glutamat : Studier har vist at lokal blokkering av glutamatergiske NMDA -reseptorer i NAcc -kjernen svekket romlig læring. En annen studie viste at både NMDA og AMPA (begge glutamatreseptorer ) spiller viktige roller for å regulere instrumental læring.
Serotonin (5-HT): Totalt sett er 5-HT-synapser mer utbredt og har et større antall synaptiske kontakter i NAcc-skallet enn i kjernen. De er også større og tykkere, og inneholder flere store tette kjernevesikler enn sine kolleger i kjernen.
Funksjon
Belønning og forsterkning
Nucleus accumbens, som er en del av belønningssystemet, spiller en viktig rolle i behandlingen av givende stimuli, forsterkende stimuli (f.eks. Mat og vann), og de som er både givende og forsterkende (vanedannende rusmidler, sex og trening). Den dominerende responsen til nevroner i nucleus accumbens til belønningen sukrose er inhibering; det motsatte er sant som svar på administrering av aversivt kinin . Vesentlige bevis fra farmakologisk manipulasjon antyder også at det er givende å redusere opphisselsen til nevroner i nucleus accumbens, som for eksempel ville være sant når det gjelder μ-opioidreseptorstimulering . Den avhengige signal blodet oksygennivået (BOLD) i nucleus accumbens selektivt økt i oppfatningen av hyggelige, følelsesmessig vekke bildene og under mentale bilder av hyggelige, emosjonelle scener. Ettersom BOLD antas å være et indirekte mål på regional netto eksitasjon til inhibering, er imidlertid ukjennelsen i hvilken grad BOLD måler valensavhengig behandling. På grunn av overflod av NAcc -innganger fra limbiske regioner og sterke NAcc -utganger til motorregioner, har nucleus accumbens blitt beskrevet av Gordon Mogensen som grensesnittet mellom det limbiske og motoriske systemet.

Nucleus accumbens er årsakssammenhengende med opplevelsen av nytelse. Mikroinjeksjoner av μ-opioidagonister, δ-opioidagonister eller κ-opioidagonister i rostrodorsal kvadrant i det mediale skallet forsterker "liking", mens flere kaudale injeksjoner kan hemme avskyreaksjoner, liker reaksjoner eller begge deler. Regionene i nucleus accumbens som kan tilskrives en kausal rolle i produksjon av nytelse er begrenset både anatomisk og kjemisk, ettersom opioidagonister bare er endokannabinoider kan øke smak. I nucleus accumbens som helhet endrer dopamin, GABA -reseptoragonist eller AMPA -antagonister utelukkende motivasjonen, mens det samme gjelder for opioider og endocannabinoider utenfor hotspot i medialskallet. Det finnes en rostro-kaudal gradient for forbedring av appetittfulle versus fryktelige svar, hvor sistnevnte tradisjonelt antas å kreve bare D1-reseptorfunksjon, og den første krever både D1- og D2-funksjon. En tolkning av dette funnet, disinhiberingshypotesen, antyder at hemming av accumbens MSN (som er GABAergic) hemmer nedstrøms strukturer, noe som muliggjør uttrykk for appetittfull eller fullstendig atferd. De motiverende effektene av AMPA -antagonister, og i mindre grad GABA -agonister, er anatomisk fleksible. Stressende forhold kan utvide fryktfremkallende regioner, mens et kjent miljø kan redusere størrelsen på fryktfremkallende region. Videre forstyrrer kortikal innspill fra orbitofrontal cortex (OFC) responsen mot appetittoppførsel , og infralimbisk input, tilsvarende den menneskelige subgenuelle cingulate cortex, undertrykker responsen uavhengig av valens.
Nucleus accumbens er verken nødvendig eller tilstrekkelig for instrumental læring, selv om manipulasjoner kan påvirke ytelsen på instrumentelle læringsoppgaver. En oppgave der effekten av NAcc-lesjoner er tydelig, er Pavlovian-instrumental transfer (PIT), hvor et signal parret med en spesifikk eller generell belønning kan forbedre instrumentell respons. Lesjoner i kjernen av NAcc svekker ytelsen etter devaluering og hemmer effekten av generell PIT. På den annen side svekker lesjoner i skallet bare effekten av spesifikk PIT. Dette skillet antas å gjenspeile fullstendige og appetittvekkende betingede responser i henholdsvis NAcc -skallet og NAcc -kjernen.
I dorsal striatum har det blitt observert en dikotomi mellom D1-MSN og D2-MSN, hvor førstnevnte er forsterkende og forbedrende bevegelse, og sistnevnte er aversiv og reduserer bevegelse. Et slikt skille har tradisjonelt blitt antatt å gjelde også for nucleus accumbens, men bevis fra farmakologiske og optogenetiske studier er motstridende. Videre uttrykker en delmengde av NAcc MSN både D1 og D2 MSN, og farmakologisk aktivering av D1 versus D2 reseptorer trenger ikke nødvendigvis å aktivere nevrale populasjoner nøyaktig. Selv om de fleste studier ikke viser noen effekt av selektiv optogenetisk stimulering av D1 eller D2 MSN på bevegelsesaktivitet, har en studie rapportert en nedgang i basal bevegelse med D2-MSN stimulering. Mens to studier har rapportert reduserte forsterkende effekter av kokain med D2-MSN-aktivering, har en studie rapportert ingen effekt. NAcc D2-MSN-aktivering har også blitt rapportert for å øke motivasjonen, vurdert av PIT, og D2-reseptoraktivitet er nødvendig for de forsterkende effektene av VTA-stimulering. En studie fra 2018 rapporterte at D2 MSN -aktivering økte motivasjonen ved å hemme det ventrale pallidum og derved hemme VTA.
Moderens oppførsel
En fMRI -studie utført i 2005 fant at når morrotter var i nærvær av valpene, var regionene i hjernen som var involvert i forsterkning, inkludert nucleus accumbens, svært aktive. Nivåer av dopamin øker i nucleus accumbens under mors oppførsel, mens lesjoner i dette området forstyrrer moderens oppførsel. Når kvinner blir presentert bilder av ikke -beslektede spedbarn, viser fMRI -er økt hjerneaktivitet i nucleus accumbens og tilstøtende caudatkjerne, proporsjonalt med i hvilken grad kvinnene synes disse spedbarnene er "søte".
Aversjon
Aktivering av D1-type MSN i nucleus accumbens er involvert i belønning, mens aktivering av D2-type MSN i nucleus accumbens fremmer aversjon .
Langsom bølgesøvn
På slutten av 2017 fant studier på gnagere som benyttet optogenetiske og kjemogenetiske metoder at de indirekte bane (dvs. D2-type) middels spiny neuroner i nucleus accumbens-kjernen som co-uttrykker adenosin A 2A- reseptorer og projiserer til det ventrale pallidum er involvert i regulering av langsom bølgesøvn . Spesielt induserer optogenetisk aktivering av disse indirekte banen Ncc-kjerne-nevroner søvn med langsom bølge og kjemogenetisk aktivering av de samme nevronene øker antallet og varigheten av saktebølgesøvnepisoder. Kjemogenetisk hemming av disse NAcc -kjerne -nevronene undertrykker søvn. I kontrast har D2-typen mellomstore nerveceller i NAcc-skallet som uttrykker adenosin A 2A- reseptorer ingen rolle i å regulere langsom bølgesøvn .
Klinisk signifikans
Avhengighet
Nåværende modeller for avhengighet fra kronisk narkotikabruk innebærer endringer i genuttrykk i mesokortikolimbisk projeksjon . De viktigste transkripsjonsfaktorene som forårsaker disse endringene er ΔFosB , syklisk adenosinmonofosfat ( cAMP ) responselementbindende protein ( CREB ) og kjernefaktor kappa B ( NFκB ). ΔFosB er den mest signifikante gentranskripsjonsfaktoren i avhengighet siden dens virale eller genetiske overuttrykk i nucleus accumbens er nødvendig og tilstrekkelig for mange av de nevrale tilpasningene og atferdseffektene (f.eks. Ekspresjonsavhengige økninger i selvadministrasjon og belønningssensibilisering ) sett i rusavhengighet. ΔFosB -overuttrykk har vært implisert i avhengighet av blant annet alkohol (etanol) , cannabinoider , kokain , metylfenidat , nikotin , opioider , fencyklidin , propofol og substituerte amfetaminer . Økninger i nucleus accumbens ΔJunD -uttrykk kan redusere eller, med en stor økning, til og med blokkere de fleste nevrale endringene som ses ved kronisk stoffmisbruk (dvs. endringene formidlet av ΔFosB).
ΔFosB spiller også en viktig rolle i reguleringen av atferdsresponser på naturlige belønninger, for eksempel velsmakende mat, sex og trening. Naturlige belønninger, som misbruk, induserer ΔFosB i nucleus accumbens, og kronisk oppkjøp av disse belønningene kan resultere i en lignende patologisk vanedannende tilstand gjennom ΔFosB overuttrykk. Følgelig er ΔFosB også den viktigste transkripsjonsfaktoren som er involvert i avhengighet av naturlige belønninger. spesielt ΔFosB i nucleus accumbens er kritisk for de forsterkende effektene av seksuell belønning. Forskning på samspillet mellom naturlige og medikamentbelønninger antyder at psykostimulanter og seksuell atferd virker på lignende biomolekylære mekanismer for å indusere ΔFosB i nucleus accumbens og ha kryssensibiliseringseffekter som medieres gjennom ΔFosB.
I likhet med medikamentbelønninger, øker ikke-medikamentbelønninger også nivået av ekstracellulær dopamin i NAcc-skallet. Legemiddelindusert frigjøring av dopamin i NAcc-skallet og NAcc-kjernen er vanligvis ikke utsatt for tilvenning (dvs. utvikling av legemiddeltoleranse : en reduksjon i dopaminfrigivelse fra fremtidig legemiddeleksponering som følge av gjentatt legemiddeleksponering); tvert imot resulterer gjentatt eksponering for legemidler som induserer dopaminfrigivelse i NAcc -skallet og kjernen vanligvis i sensibilisering (dvs. mengden dopamin som frigjøres i NAcc fra fremtidig legemiddeleksponering øker som følge av gjentatt eksponering av legemidler). Sensibilisering av dopaminfrigivelse i NAcc-skallet etter gjentatt legemiddeleksponering tjener til å styrke stimulus-medikamentforeninger (dvs. klassisk kondisjonering som oppstår når stoffbruk gjentatte ganger er parret med miljøstimuli) og disse assosiasjonene blir mindre utsatt for utryddelse (dvs. "avlæring" disse klassisk betingede sammenhengene mellom stoffbruk og miljøstimuli blir vanskeligere). Etter gjentatt sammenkobling blir disse klassisk betingede miljøstimuliene (f.eks. Kontekster og objekter som ofte er parret med bruk av narkotika) ofte legemiddeltegn som fungerer som sekundære forsterkere av stoffbruk (dvs. når disse foreningene er etablert, blir eksponering for en sammenkoblet miljøstimulering utløser et ønske eller ønske om å bruke stoffet de har blitt assosiert med ).
I motsetning til legemidler, frigjøres dopamin i NAcc-skallet av mange typer givende ikke-medikamentelle stimuli vanligvis tilvenning etter gjentatt eksponering (det vil si at mengden dopamin som frigjøres fra fremtidig eksponering for en givende ikke-medisinsk stimulans normalt reduseres som et resultat av gjentatt eksponering for den stimulansen).
| Form for nevroplastisitet eller atferdsmessig plastisitet |
Type forsterkning | Kilder | |||||
|---|---|---|---|---|---|---|---|
| Opiater | Psykostimulerende midler | Mat med høyt fett eller sukker | Seksuell omgang |
Fysisk trening (aerob) |
Miljø berikelse |
||
|
ΔFosB- uttrykk i nucleus accumbens D1-type MSN |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Atferdsmessig plastisitet | |||||||
| Eskalering av inntak | Ja | Ja | Ja | ||||
| Psykostimulerende kryssensibilisering |
Ja | Ikke aktuelt | Ja | Ja | Dempet | Dempet | |
| Psykostimulerende selvadministrasjon |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Psykostimulerende betinget stedspreferanse |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| Gjenopprettelse av narkotikasøkende atferd | ↑ | ↑ | ↓ | ↓ | |||
| Nevrokjemisk plastisitet | |||||||
|
CREB -fosforylering i nucleus accumbens |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Sensitivisert dopamin respons i nucleus accumbens |
Nei | Ja | Nei | Ja | |||
| Endret striatal dopaminsignalering | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | ||
| Endret striatal opioidsignalering | Ingen endring eller ↑ μ-opioidreseptorer |
↑ μ-opioidreseptorer ↑ κ-opioidreseptorer |
^ Μ-opioidreseptorer | ^ Μ-opioidreseptorer | Ingen endring | Ingen endring | |
| Endringer i striatal opioidpeptider | ^ Dynorphin Ingen endring: enkefalin |
↑ dynorfin | ↓ enkefalin | ↑ dynorfin | ↑ dynorfin | ||
| Mesokortikolimbisk synaptisk plastisitet | |||||||
| Antall dendritter i nucleus accumbens | ↓ | ↑ | ↑ | ||||
|
Dendrittiske ryggraden tettheten i de nucleus accumbens |
↓ | ↑ | ↑ | ||||
Depresjon
I april 2007 rapporterte to forskerteam om å ha satt inn elektroder i nucleus accumbens for å bruke dyp hjernestimulering for å behandle alvorlig depresjon . I 2010 rapporterte eksperimenter at dyp hjernestimulering av nucleus accumbens var vellykket for å redusere depresjonssymptomer hos 50% av pasientene som ikke reagerte på andre behandlinger som elektrokonvulsiv terapi . Nucleus accumbens har også blitt brukt som mål for å behandle små grupper av pasienter med terapi-refraktær obsessiv-kompulsiv lidelse.
Ablasjon
For å behandle avhengighet og i et forsøk på å behandle psykiske lidelser har radiofrekvensablasjon av nucleus accumbens blitt utført. Resultatene er usikre og kontroversielle.
Placebo effekt
Aktivering av NAcc har vist seg å forekomme i påvente av effektivitet av et legemiddel når en bruker får placebo , noe som indikerer en medvirkende rolle for nucleus accumbens i placebo -effekten .
Flere bilder
Se også
Referanser
Eksterne linker
- Kjernen sin rolle i belønningskretsen. En del av "Hjernen fra topp til bunn." på thebrain.mcgill.ca
- Nucleus Accumbens - cellesentrert database
- Fargede hjerneskivebilder som inkluderer "kjernen%20accumbens" ved BrainMaps -prosjektet






