Osteoblast - Osteoblast
| Osteoblast | |
|---|---|

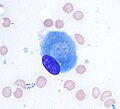
Osteoblaster (lilla) rimer en benaktig spicule (rosa - på diagonal av bildet). I dette rutinemessig fikserte og avkalkede (benmineralt fjernede) vevet har osteoblastene trukket seg tilbake og er atskilt fra hverandre og fra den underliggende matrisen. I levende bein er cellene forbundet med tette veikryss og gapekryss , og integrert med underliggende osteocytter og matrise H & E -flekk . | |
 Illustrasjon som viser en enkelt osteoblast
| |
| Detaljer | |
| plassering | Bein |
| Funksjon | Dannelse av beinvev |
| Identifikatorer | |
| gresk | osteoblast |
| MeSH | D010006 |
| TH | H2.00.03.7.00002 |
| FMA | 66780 |
|
Anatomiske termer for mikroanatomi | |
Osteoblaster (fra gresk som kombinerer former for " bein ", ὀστέο-, osteo- og βλαστάνω, blastanō "spirer") er celler med en enkelt kjerne som syntetiserer bein . Imidlertid fungerer osteoblaster i prosessen med beindannelse i grupper av tilkoblede celler. Individuelle celler kan ikke lage bein. En gruppe organiserte osteoblaster sammen med beinet laget av en enhet av celler kalles vanligvis osteonet .
Osteoblaster er spesialiserte, terminalt differensierte produkter av mesenkymale stamceller . De syntetiserer tett, tverrbundet kollagen og spesialiserte proteiner i mye mindre mengder, inkludert osteocalcin og osteopontin , som utgjør den organiske matrisen av bein.
I organiserte grupper av tilkoblede celler produserer osteoblaster hydroksylapatitt - beinmineralet , som deponeres på en meget regulert måte, i den organiske matrisen og danner et sterkt og tett mineralisert vev - den mineraliserte matrisen. Det mineraliserte skjelettet er hovedstøtten for kroppene til luftpustende virveldyr . Det er et viktig lager av mineraler for fysiologisk homeostase inkludert både syre-base balanse og kalsium eller fosfat vedlikehold.
Bein struktur
Den skjelettet er en stor organ som er dannet og degraderes gjennom hele livet i luftpustende virveldyr. Skjelettet, ofte referert til som skjelettsystemet, er viktig både som en bærende struktur og for vedlikehold av kalsium, fosfat og syre-basestatus i hele organismen. Den funksjonelle delen av beinet, beinmatrisen , er helt ekstracellulær. Benmatrisen består av protein og mineral . Proteinet danner den organiske matrisen. Det syntetiseres og deretter tilsettes mineralet. De aller fleste av den organiske matrisen er kollagen , som gir strekkfasthet . Matrisen mineraliseres ved avsetning av hydroksyapatitt (alternativt navn, hydroksylapatitt). Dette mineralet er hardt, og gir trykkfasthet . Dermed er kollagen og mineral sammen et komposittmateriale med utmerket strekk- og trykkfasthet, som kan bøye seg under en belastning og gjenopprette formen uten skade. Dette kalles elastisk deformasjon . Krefter som overskrider benets evne til å oppføre seg elastisk, kan forårsake svikt, vanligvis beinbrudd .
Ombygging av bein
Ben er et dynamisk vev som stadig omformes av osteoblaster , som produserer og utskiller matriseproteiner og transporterer mineral inn i matrisen, og osteoklaster , som bryter ned vevet.
Osteoblaster
Osteoblaster er den viktigste cellulære komponenten i bein. Osteoblaster oppstår fra mesenkymale stamceller (MSC). MSC gir opphav til osteoblaster, adipocytter og myocytter blant andre celletyper. Osteoblastmengde forstås å være omvendt proporsjonal med mengden av adipocytter i margen som består av fettvev i margen (MAT) . Osteoblaster finnes i store mengder i periosteum , det tynne bindevevslaget på utsiden av bein og i endosteum .
Normalt mineraliseres nesten hele beinmatrisen i luftpustende virveldyr av osteoblastene. Før den organiske matrisen blir mineralisert, kalles det osteoid . Osteoblaster begravet i matrisen kalles osteocytter . Under beindannelse består overflatelaget av osteoblaster av kuboidale celler, kalt aktive osteoblaster . Når den beindannende enheten ikke aktivt syntetiserer bein, blir overflate-osteoblaster flatet og kalles inaktive osteoblaster . Osteocytter forblir i live og er forbundet med celleprosesser til et overflatelag av osteoblaster. Osteocytter har viktige funksjoner i skjelettvedlikehold.
Osteoklaster
Osteoklaster er flerkjernede celler som stammer fra hematopoietiske forfedre i benmargen som også gir opphav til monocytter i perifert blod. Osteoklaster bryter ned beinvev, og danner sammen med osteoblaster og osteocytter de strukturelle komponentene i bein. I det hule i beinene er det mange andre celletyper i benmargen . Komponenter som er viktige for osteoblastbeindannelse inkluderer mesenkymale stamceller (osteoblastforløper) og blodkar som leverer oksygen og næringsstoffer for beindannelse. Ben er et svært vaskulært vev, og aktiv dannelse av blodkarceller, også fra mesenkymale stamceller, er avgjørende for å støtte metabolsk aktivitet av bein. Balansen mellom beindannelse og benresorpsjon har en tendens til å være negativ med alderen, spesielt hos postmenopausale kvinner, noe som ofte fører til tap av bein som er alvorlig nok til å forårsake brudd, som kalles osteoporose .
Osteogenese
Ben dannes ved en av to prosesser: endokondral ossifikasjon eller intramembranøs ossifikasjon . Endokondral ossifikasjon er prosessen med å danne bein fra brusk, og dette er den vanlige metoden. Denne formen for beinutvikling er den mer komplekse formen: den følger dannelsen av et første skjelett av brusk laget av kondrocytter , som deretter fjernes og erstattes av bein, laget av osteoblaster. Intramembranøs ossifikasjon er den direkte ossifikasjonen av mesenkym som skjer under dannelsen av membranbenene i skallen og andre.
Under osteoblastdifferensierings , u-forløperceller uttrykker regulatoriske transkripsjonsfaktor Cbfa1 / Runx2 . En annen nødvendig transkripsjonsfaktor er Tr7 -transkripsjonsfaktor . Osteokondroprogenitorceller differensieres under påvirkning av vekstfaktorer , selv om isolerte mesenkymale stamceller i vevskultur også kan danne osteoblaster under tillatte forhold som inkluderer vitamin C og substrater for alkalisk fosfatase , et sentralt enzym som gir høye konsentrasjoner av fosfat på mineralavsetningsstedet.
Benmorfogenetiske proteiner
Viktige vekstfaktorer i endokondral skjelettdifferensiering inkluderer benmorfogenetiske proteiner (BMP) som i stor grad bestemmer hvor kondrocyttdifferensiering oppstår og hvor mellomrom er igjen mellom bein. Systemet med bruskbytte med bein har et komplekst reguleringssystem. BMP2 regulerer også tidlig skjelettmønster. transformerende vekstfaktor beta (TGF-β), er en del av en superfamilie av proteiner som inkluderer BMP, som har vanlige signalelementer i TGF beta-signalveien . TGF-β er spesielt viktig ved bruskdifferensiering , som vanligvis går forut for beindannelse for endokondral ossifikasjon. En ekstra familie av viktige regulatoriske faktorer er fibroblastvekstfaktorene (FGF) som bestemmer hvor skjelettelementer forekommer i forhold til huden
Steroid- og proteinhormoner
Mange andre reguleringssystemer er involvert i overgangen av brusk til bein og vedlikehold av bein. En spesielt viktig beinmålrettet hormonregulator er parathyroidhormon (PTH). Parathyroidhormon er et protein laget av biskjoldbruskkjertelen under kontroll av serumkalsiumaktivitet. PTH har også viktige systemiske funksjoner, inkludert å holde serumkalsiumkonsentrasjoner nesten konstant uavhengig av kalsiuminntak. Økt diettkalsium resulterer i mindre økninger i kalsium i blodet. Imidlertid er dette ikke en signifikant mekanisme som støtter dannelse av osteoblastben, bortsett fra i tilstanden med lite kalsium i kosten; Videre øker unormalt høyt diettkalsium risikoen for alvorlige helsekonsekvenser som ikke er direkte knyttet til beinmasse, inkludert hjerteinfarkt og hjerneslag . Intermitterende PTH -stimulering øker osteoblastaktiviteten, selv om PTH er bifunksjonell og medierer nedbrytning av beinmatrise ved høyere konsentrasjoner.
Skjelettet er også modifisert for gjengivelse og i respons til ernæringsmessige og andre hormon påkjenninger; den reagerer på steroider , inkludert østrogen og glukokortikoider , som er viktige for reproduksjon og energimetabolisme. Benomsetning innebærer store energiforbruk for syntese og nedbrytning, som involverer mange flere signaler, inkludert hypofysehormoner . To av disse er adrenokortikotropt hormon (ACTH) og follikelstimulerende hormon . Den fysiologiske rollen for responsene på disse, og flere andre glykoproteinhormoner , er ikke fullt ut forstått, selv om det er sannsynlig at ACTH er bifunksjonell, som PTH, støtter beindannelse med periodiske pigger av ACTH, men forårsaker beinødeleggelse i store konsentrasjoner. Hos mus forårsaker mutasjoner som reduserer effektiviteten av ACTH-indusert glukokortikoidproduksjon i binyrene at skjelettet blir tett ( osteosklerotisk bein).
Organisering og ultrastruktur
I godt bevart bein studert ved høy forstørrelse via elektronmikroskopi , er det vist at individuelle osteoblaster er forbundet med tette veikryss , som forhindrer ekstracellulær væskepassasje og dermed skaper et beinrom separat fra den generelle ekstracellulære væsken. Osteoblastene er også forbundet med gapekryss , små porer som forbinder osteoblaster, slik at cellene i en kohort kan fungere som en enhet. Gapekryssene forbinder også dypere lag med celler til overflatelaget ( osteocytter når de er omgitt av bein). Dette ble demonstrert direkte ved å injisere fluorescerende fargestoffer med lav molekylvekt i osteoblaster og vise at fargestoffet diffunderte til omkringliggende og dypere celler i den bendannende enheten. Ben består av mange av disse enhetene, som er adskilt av ugjennomtrengelige soner uten mobilforbindelser, kalt sementlinjer.
Kollagen og tilbehørsproteiner
Nesten hele den organiske (ikke-mineraliske) komponenten av bein er tett kollagen type I, som danner tette tverrbundne tau som gir beinets strekkfasthet. Ved mekanismer som fremdeles er uklare, skiller osteoblaster ut lag av orientert kollagen, med lagene parallelle med beinets lange akse vekslende med lag i rette vinkler til beinets lange akse med noen få mikrometer . Defekter i kollagen type I forårsaker den vanligste arvelige lidelsen i bein, kalt osteogenesis imperfecta .
Mindre, men viktige, mengder små proteiner, inkludert osteocalcin og osteopontin , skilles ut i beinets organiske matrise. Osteocalcin uttrykkes ikke ved signifikante konsentrasjoner, bortsett fra i bein, og dermed er osteocalcin en spesifikk markør for benmatrisesyntese. Disse proteinene knytter organisk og mineralsk komponent i beinmatrisen. Proteinene er nødvendige for maksimal matrisestyrke på grunn av deres mellomliggende lokalisering mellom mineral og kollagen.
Hos mus der ekspresjon av osteocalcin eller osteopontin ble eliminert ved målrettet forstyrrelse av de respektive genene ( knockoutmus ), ble imidlertid ikke akkumulering av mineral særlig påvirket, noe som indikerer at organisering av matrise ikke er signifikant relatert til mineraltransport.
Ben mot brusk
Det primitive skjelettet er brusk , et fast avaskulært (uten blodkar) vev der individuelle brusk-matrise-utskillende celler eller kondrocytter forekommer. Kondrocytter har ikke intercellulære forbindelser og er ikke koordinert i enheter. Brusk består av et nettverk av kollagen type II holdt i spenning av vannabsorberende proteiner, hydrofile proteoglykaner . Dette er det voksne skjelettet i bruskfisk som haier . Det utvikler seg som det første skjelettet i mer avanserte klasser av dyr.
Hos luftpustende virveldyr erstattes brusk med mobilbein. Et overgangsvev er mineralisert brusk . Brusk mineraliserer ved massiv ekspresjon av fosfatproduserende enzymer, som forårsaker høye lokale konsentrasjoner av kalsium og fosfat som faller ut. Denne mineraliserte brusk er ikke tett eller sterk. I luftpustende virveldyr brukes det som et stillas for dannelse av mobilbein laget av osteoblaster, og deretter fjernes det av osteoklaster , som spesialiserer seg på nedbrytning av mineralisert vev.
Osteoblaster produserer en avansert type beinmatrise som består av tette, uregelmessige krystaller av hydroksyapatitt , pakket rundt kollagentauene. Dette er et sterkt komposittmateriale som gjør at skjelettet hovedsakelig kan formes som hule rør. Å redusere de lange beinene til rør reduserer vekten samtidig som du beholder styrken.
Mineralisering av bein
Mineraliseringsmekanismer er ikke fullt ut forstått. Fluorescerende, lavmolekylære forbindelser som tetracyklin eller calcein binder sterkt til beinmineral når de administreres i korte perioder. De akkumuleres deretter i smale bånd i det nye beinet. Disse båndene går på tvers av den sammenhengende gruppen av beindannende osteoblaster. De forekommer på en smal (sub- mikrometer ) mineraliseringsfront. De fleste beinoverflater uttrykker ingen ny beindannelse, ingen tetracyklinopptak og ingen mineraldannelse. Dette antyder sterkt at tilrettelagt eller aktiv transport , koordinert på tvers av den beindannende gruppen, er involvert i beindannelse, og at det bare oppstår celleformidlet mineraldannelse. Det vil si at kalsium i kosten ikke lager mineral ved massevirkning.
Mekanismen for mineraldannelse i bein er tydelig forskjellig fra den fylogenetisk eldre prosessen der brusk mineraliseres: tetracyklin merker ikke mineralisert brusk på smale bånd eller på bestemte steder, men diffust, i tråd med en passiv mineraliseringsmekanisme.
Osteoblaster skiller bein fra ekstracellulær væske ved tette veikryss ved regulert transport. I motsetning til brusk kan ikke fosfat og kalsium bevege seg inn eller ut av passiv diffusjon, fordi de tette osteoblastforbindelsene isolerer beindannelsesrommet. Kalsium transporteres over osteoblaster ved lettere transport (det vil si av passive transportører, som ikke pumper kalsium mot en gradient). I motsetning dannes fosfat aktivt ved en kombinasjon av utskillelse av fosfatholdige forbindelser, inkludert ATP , og av fosfataser som klyver fosfat for å skape en høy fosfatkonsentrasjon ved mineraliseringsfronten. Alkalisk fosfatase er et membranforankret protein som er en karakteristisk markør uttrykt i store mengder på det apikale (sekretoriske) ansiktet til aktive osteoblaster.
Minst en regulert transportprosess er involvert. Den støkiometri av benmineral utgangspunktet er det av hydroksyapatitt utfellende fra fosfat, kalsium, og vann ved en svakt alkalisk pH-verdi :
6 HPO42− + 2 H2O + 10 Ca2+ ⇌ Ca10(PO4)6(OH)2 + 8 H+
I et lukket system som mineralutfelling, akkumuleres syre, senker pH raskt og stopper ytterligere nedbør. Brusk presenterer ingen hindring for diffusjon og syre diffunderer derfor bort, slik at nedbøren kan fortsette. I osteonet, hvor matrisen skilles fra ekstracellulær væske ved tette kryss, kan dette ikke skje. I det kontrollerte, forseglede rommet fjerner H + nedbør under en rekke ekstracellulære forhold, så lenge kalsium og fosfat er tilgjengelig i matriksrommet. Mekanismen for hvordan syre passerer barrieresjiktet er fortsatt usikker. Osteoblaster har kapasitet for Na + /H + -utveksling via de redundante Na /H -vekslerne, NHE1 og NHE6. Denne H + -utvekslingen er et viktig element i syrefjerning, selv om mekanismen som H + transporteres fra matriksrommet til barriere -osteoblasten ikke er kjent.
Ved fjerning av bein bruker en omvendt transportmekanisme syre levert til den mineraliserte matrisen for å drive hydroksyapatitt til løsning.
Osteocytt -tilbakemelding
Tilbakemelding fra fysisk aktivitet opprettholder benmasse, mens tilbakemelding fra osteocytter begrenser størrelsen på den bendannende enheten. En viktig tilleggsmekanisme er sekresjon av osteocytter, begravet i matrisen, av sklerostin , et protein som hemmer en vei som opprettholder osteoblastaktivitet. Når osteonen når en begrensende størrelse, deaktiverer den således bensyntesen.
Morfologi og histologisk farging
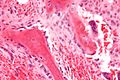
Hematoksylin og eosinfarging (H&E) viser at cytoplasmaet til aktive osteoblaster er litt basofilt på grunn av den betydelige tilstedeværelsen av grovt endoplasmatisk retikulum . Den aktive osteoblasten produserer betydelig kollagen type I. Omtrent 10% av beinmatrisen er kollagen med balansemineral. Osteoblastens kjerne er sfærisk og stor. En aktiv osteoblast karakteriseres morfologisk av et fremtredende Golgi -apparat som fremstår histologisk som en klar sone ved siden av kjernen. Cellens produkter er hovedsakelig for transport inn i osteoiden, den ikke-mineraliserte matrisen. Aktive osteoblaster kan merkes ved hjelp av antistoffer mot type-I kollagen , eller ved hjelp av naftol fosfat og diazonium- fargestoff hurtig blå for å demonstrere alkalisk fosfatase enzymaktiviteten direkte.
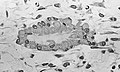
Lysmikrograf av avkalket kanselløst bein som viser osteoblaster som syntetiserer aktivt osteoid, inneholdende to osteocytter.
Lysmikrografi av udekalsifisert vev vise osteoblasts aktivt syntetisere osteoid (sentrum).
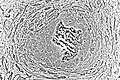
Lysmikrografi av udekalsifisert vev viser osteoblaster aktivt syntetiserer rudimentær benvev (i midten).
Isolering av osteoblaster
- Den første isolasjonsteknikken ved mikrodisseksjonsmetode ble opprinnelig beskrevet av Fell et al. ved bruk av kyllingben som ble separert i periosteum og resterende deler. Hun skaffet celler som hadde osteogene egenskaper fra dyrket vev ved å bruke bein til kyllinger som ble separert i periosteum og gjenværende deler. Hun skaffet celler som hadde osteogene egenskaper fra dyrket vev.
- Enzymatisk fordøyelse er en av de mest avanserte teknikkene for å isolere populasjoner av beinceller og få osteoblaster. Peck et al. (1964) beskrev den opprinnelige metoden som nå ofte brukes av mange forskere.
- I 1974 Jones et al. fant ut at osteoblaster beveget seg lateralt in vivo og in vitro under forskjellige eksperimentelle forhold og beskrev migrasjonsmetoden i detalj. Osteoblastene var imidlertid kontaminert av celler som vandret fra de vaskulære åpningene, som kan inkludere endotelceller og fibroblaster.
Se også
Referanser
Videre lesning
- William F. Neuman og Margaret W. Neuman. (1958). The Chemical Dynamics of Bone Mineral. Chicago: University of Chicago Press. ISBN 0-226-57512-8 .
- Netter, Frank H. (1987). Muskel -skjelettsystemet: anatomi, fysiologi og metabolske lidelser . Summit, New Jersey: Ciba-Geigy Corporation ISBN 0-914168-88-6 .