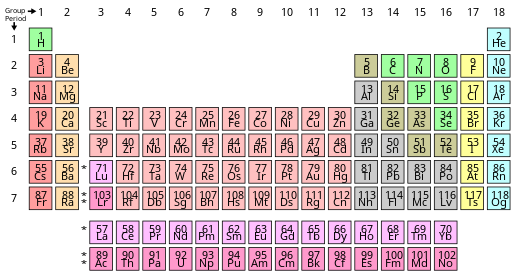
Periodiske tabell -Periodic table
Det periodiske systemet , også kjent som det periodiske systemet for ( de ) ( kjemiske ) elementene , er en tabellvisning av de kjemiske elementene . Det er mye brukt i kjemi , fysikk og andre vitenskaper, og blir generelt sett på som et ikon for kjemi. Det er en grafisk formulering av den periodiske loven, som sier at egenskapene til de kjemiske elementene viser en periodisk avhengighet av deres atomnummer .
Tabellen er delt inn i fire omtrent rektangulære områder kalt blokker . Radene i tabellen kalles perioder , og kolonnene kalles grupper . Grunnstoffer fra samme kolonnegruppe i det periodiske systemet viser lignende kjemiske egenskaper. Trender går gjennom det periodiske systemet, med ikke- metallisk karakter (beholder sine egne elektroner) økende fra venstre til høyre over en periode, og fra ned til opp over en gruppe, og metallisk karakter (overgi elektroner til andre atomer) øker i motsatt retning. Den underliggende årsaken til disse trendene er elektronkonfigurasjoner av atomer.
Det første periodiske systemet som ble generelt akseptert var det til den russiske kjemikeren Dmitri Mendeleev i 1869: han formulerte den periodiske loven som en avhengighet av kjemiske egenskaper på atommasse. Fordi ikke alle grunnstoffene da var kjent, var det hull i det periodiske systemet hans, og Mendeleev brukte den periodiske loven til å forutsi egenskapene til noen av de manglende elementene . Den periodiske loven ble anerkjent som en grunnleggende oppdagelse på slutten av 1800-tallet, og den ble forklart med oppdagelsen av atomnummeret og banebrytende arbeid innen kvantemekanikk på begynnelsen av 1900-tallet som belyste den indre strukturen til atomet. Med Glenn T. Seaborgs oppdagelse fra 1945 om at aktinidene faktisk var f-blokker i stedet for d-blokkelementer, ble en gjenkjennelig moderne form av bordet nådd. Det periodiske system og loven er nå en sentral og uunnværlig del av moderne kjemi.
Det periodiske systemet fortsetter å utvikle seg med vitenskapens fremgang. I naturen eksisterer bare grunnstoffer opp til atomnummer 94; for å gå videre var det nødvendig å syntetisere nye elementer i laboratoriet. I dag er alle de første 118 elementene kjent, og fullfører de første syv radene i tabellen, men kjemisk karakterisering er fortsatt nødvendig for at de tyngste elementene skal bekrefte at egenskapene deres samsvarer med posisjonene deres. Det er ennå ikke kjent hvor langt tabellen vil strekke seg utover disse syv radene og om mønstrene til den kjente delen av tabellen vil fortsette inn i denne ukjente regionen. Det fortsetter også en del vitenskapelig diskusjon om hvorvidt noen elementer er riktig plassert i dagens tabell. Mange alternative representasjoner av den periodiske loven eksisterer, og det er en viss diskusjon om hvorvidt det er en optimal form for det periodiske system.
| Del av en serie om |
| Periodiske tabell |
|---|
Oversikt
Atomstruktur

De minste bestanddelene av all normal materie er kjent som atomer . Atomer er ekstremt små, og er omtrent en ti milliarddels meter i diameter; dermed deres indre struktur er styrt av kvantemekanikk . Atomer består av en liten positivt ladet kjerne , laget av positivt ladede protoner og uladede nøytroner , omgitt av en sky av negativt ladede elektroner; ladningene opphever seg, så atomer er nøytrale. Elektroner deltar i kjemiske reaksjoner , men det gjør ikke kjernen. Når atomer deltar i kjemiske reaksjoner, kan de få eller miste elektroner for å danne positivt eller negativt ladede ioner ; eller de kan dele elektroner med hverandre i stedet.
Atomer kan deles inn i ulike typer basert på antall protoner (og dermed også elektroner) de har. Dette kalles atomnummeret , ofte symbolisert Z som tysk for tall er Zahl . Hvert distinkt atomnummer tilsvarer derfor en klasse atomer: disse klassene kalles de kjemiske grunnstoffene . De kjemiske grunnstoffene er det det periodiske systemet klassifiserer og organiserer. Hydrogen er grunnstoffet med atomnummer 1; helium , atomnummer 2; litium , atomnummer 3; og så videre. Hvert av disse navnene kan forkortes ytterligere med et kjemisk symbol på én eller to bokstaver ; de for hydrogen, helium og litium er henholdsvis H, He og Li. Nøytroner påvirker ikke atomets kjemiske identitet, men påvirker dets vekt. Atomer med samme antall protoner, men forskjellig antall nøytroner kalles isotoper av samme kjemiske element. Naturlig forekommende grunnstoffer forekommer vanligvis som blandinger av forskjellige isotoper; siden hver isotop vanligvis forekommer med en karakteristisk overflod, har naturlig forekommende elementer veldefinerte atomvekter , definert som gjennomsnittlig masse av et naturlig forekommende atom i det elementet.
I dag er 118 grunnstoffer kjent, hvorav de første 94 er kjent for å forekomme naturlig på jorden for tiden. Av de 94 naturlige grunnstoffene har åtti en stabil isotop; tre til ( vismut , thorium og uran ) gjennomgår radioaktivt forfall , men så sakte at store mengder overlever fra dannelsen av jorden; og elleve flere forfaller raskt nok til at deres fortsatte sporforekomst først og fremst hviler på å konstant regenereres som mellomprodukter av nedbrytningen av thorium og uran. De 83 grunnstoffene som har overlevd fra dannelsen av jorden kalles primordiale . Alle de 24 kjente kunstige grunnstoffene er radioaktive.
Elektronkonfigurasjon
Det periodiske system er en grafisk beskrivelse av den periodiske loven, som sier at egenskapene og atomstrukturene til de kjemiske elementene er en periodisk funksjon av deres atomnummer . Elementer er plassert i det periodiske systemet etter deres elektronkonfigurasjoner , som viser periodiske gjentakelser som forklarer trendene til egenskaper over det periodiske systemet.
Et elektron kan betraktes som å bo i en atomorbital , noe som karakteriserer sannsynligheten for at det kan finnes i et bestemt område av atomet. Energiene deres er kvantisert , det vil si at de bare kan ta diskrete verdier. Videre adlyder elektroner Pauli-eksklusjonsprinsippet : forskjellige elektroner må alltid være i forskjellige tilstander. Dette tillater klassifisering av de mulige tilstandene et elektron kan ta i forskjellige energinivåer kjent som skjell, delt inn i individuelle underskall, som hver inneholder en viss type orbital. Hver orbital kan inneholde opptil to elektroner: de kjennetegnes av en mengde kjent som spinn , som kan være opp eller ned. Elektroner ordner seg i atomet på en slik måte at den totale energien de har minimeres, så de opptar de orbitalene med lavest energi som er tilgjengelig med mindre energi er tilført. Bare de ytterste elektronene (såkalte valenselektroner ) har nok energi til å bryte seg løs fra kjernen og delta i kjemiske reaksjoner med andre atomer. De andre kalles kjerneelektroner .
|
ℓ → n ↓ |
0 | 1 | 2 | 3 | 4 | 5 | 6 | |
|---|---|---|---|---|---|---|---|---|
| Orbital | s | s | d | f | g | h | Jeg | Kapasitet til skallet ( 2n 2 ) |
| 1 | 1s | 2 | ||||||
| 2 | 2s | 2p | 8 | |||||
| 3 | 3s | 3 s | 3d | 18 | ||||
| 4 | 4s | 4 s | 4d | 4f | 32 | |||
| 5 | 5s | 5 s | 5d | 5f | 5g | 50 | ||
| 6 | 6s | 6p | 6d | 6f | 6g | 6t | 72 | |
| 7 | 7s | 7p | 7d | 7f | 7g | 7t | 7i | 98 |
| Kapasitet til underskall | 2 | 6 | 10 | 14 | 18 | 22 | 26 |
Elementer er kjent med opptil de syv første skjellene okkupert. Det første skallet inneholder bare én orbital, en sfærisk orbital. Som det er i det første skallet, kalles dette 1s orbital. Denne kan inneholde opptil to elektroner. Det andre skallet inneholder på samme måte en 2s-orbital, men det inneholder også tre hantelformede p-orbitaler, og kan dermed fylle opp til åtte elektroner (2×1 + 2×3 = 8). Det tredje skallet inneholder en 3s orbitaler, tre 3p orbitaler og fem 3d orbitaler, og har dermed en kapasitet på 2×1 + 2×3 + 2×5 = 18. Det fjerde skallet inneholder en 4s orbitaler, tre 4p orbitaler, fem 4d orbitaler, og syv 4f orbitaler, og fører dermed til en kapasitet på 2×1 + 2×3 + 2×5 + 2×7 = 32. Høyere skjell inneholder flere typer orbitaler som fortsetter mønsteret, men slike typer orbitaler er ikke fylt ut de kjente elementene. Subshelltypene er preget av kvantetallene . Fire tall beskriver et elektron i et atom fullstendig: det viktigste kvantetallet n (skallet), det asimutale kvantetallet ℓ (orbitaltypen), det magnetiske kvantetallet m ℓ (hvilken av orbitalene av en bestemt type det er i) , og spinnkvantetallet s .
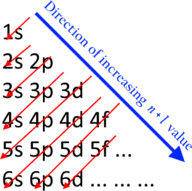
Rekkefølgen på skallfyllingen
Rekkefølgen som orbitalene er fylt i er gitt av Aufbau-prinsippet , også kjent som Madelung- eller Klechkovsky-regelen. Skjellene overlapper hverandre i energier, og skaper en sekvens som går omtrent som følger:
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪
Her betyr tegnet ≪ "mye mindre enn" i motsetning til < som bare betyr "mindre enn". Uttrykt annerledes går elektroner inn i orbitaler i rekkefølge med økende n + ℓ , og hvis to orbitaler er tilgjengelige med samme verdi på n + ℓ , blir den med lavere n okkupert først.
Overlappingene kommer ganske tett på punktet der d-orbitalene kommer inn i bildet, og rekkefølgen kan skifte litt med atomnummer og atomladning.
Med utgangspunkt i det enkleste atomet, lar dette oss bygge opp det periodiske systemet ett om gangen i rekkefølge etter atomnummer, ved å vurdere tilfellene med enkeltatomer. I hydrogen er det bare ett elektron, som må gå i orbital 1s med lavest energi. Denne konfigurasjonen er dermed skrevet 1s 1 . Helium legger til et andre elektron, som også går inn i 1s og fyller det første skallet helt.
Det tredje elementet, litium , har ikke mer plass i det første skallet. Det tredje elektronet må dermed gå inn i 2s-underskallet, og gi en 1s 2 2s 1 - konfigurasjon. 2s-elektronet er litiums eneste valenselektron, ettersom 1s-orbitalen nå er for nær kjernen til å delta kjemisk. 2s-underskallet kompletteres av det neste elementet beryllium (1s 2 2s 2 ). Følgende elementer fortsetter deretter med å fylle opp p-orbitalene. Bor (1s 2 2s 2 2p 1 ) setter sitt nye elektron i en 2p orbital; karbon (1s 2 2s 2 2p 2 ) fyller en andre 2p orbital; og med nitrogen (1s 2 2s 2 2p 3 ) blir alle tre 2p-orbitalene enkelt okkupert. Dette er i samsvar med Hunds regel , som sier at atomer vil foretrekke å okkupere hver orbital av samme type enkeltvis før de fyller dem med det andre elektronet. Oksygen (1s 2 2s 2 2p 4 ), fluor (1s 2 2s 2 2p 5 ), og neon (1s 2 2s 2 2p 6 ) fullfører deretter de allerede enkeltfylte 2p-orbitalene; den siste av disse fyller det andre skallet helt.
Med utgangspunkt i element 11, natrium , er det ikke mer plass i det andre skallet, som herfra er et kjerneskall akkurat som det første. Dermed går det ellevte elektronet inn i 3s-orbitalen i stedet. 1s 2 2s 2 2p 6 -kjernen er forkortet [Ne], da den er identisk med elektronkonfigurasjonen til neon: dermed skrives natriums konfigurasjon [Ne] 3s 1 . Magnesium ([Ne] 3s 2 ) fullfører denne 3s orbitalen, og fra da av fyller de seks elementene aluminium , silisium , fosfor , svovel , klor og argon de tre 3p orbitalene ([Ne] 3s 2 3p 1 til [Ne] 3s 2 3p 6 ). Dette skaper en analog serie der de ytre skallstrukturene av natrium gjennom argon er nøyaktig analoge med de av litium gjennom neon, og er grunnlaget for kjemisk periodisitet som det periodiske systemet illustrerer: med jevne, men skiftende intervaller av atomnummer, egenskapene til de kjemiske elementene gjentar seg omtrent.
De første atten elementene kan dermed ordnes som starten på et periodisk system. Elementer i samme kolonne har samme antall ytre elektroner og analoge ytre elektronkonfigurasjoner: disse kolonnene kalles grupper. Det eneste unntaket er helium, som har to ytre elektroner som beryllium og magnesium, men er plassert med neon og argon for å understreke at det ytre skallet er fullt. Det er åtte kolonner i dette periodiske systemfragmentet, tilsvarende maksimalt åtte ytre elektroner. En rad begynner når et nytt skall begynner å fylles; disse radene kalles periodene. Til slutt illustrerer fargen blokkene : elementene i s-blokken (farget rød) er fyllende s-orbitaler, mens de i p-blokken (farget gul) er fyllende p-orbitaler.
| 1 H |
2 Han |
2×1 = 2 elementer 1s |
||||||
| 3 Li |
4 Vær |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 elementer 2s 2p |
| 11 Na |
12 mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 elementer 3s 3 s |
Starter neste rad, for kalium og kalsium er 4s orbital den laveste i energi, og derfor fyller de den. Kalium legger til ett elektron til 4s-skallet ([Ar] 4s 1 ), og kalsium fullfører det så ([Ar] 4s 2 ). Fra scandium blir imidlertid 3d-orbitalen den nest høyeste i energi. 4s- og 3d-orbitalene har omtrent samme energi og de konkurrerer om å fylle elektronene, og derfor fyller ikke 3d-orbitalene helt konsekvent én om gangen. Den nøyaktige energirekkefølgen til 3d og 4s endres langs raden, og endres også avhengig av hvor mange elektroner som fjernes fra atomet. For eksempel, på grunn av frastøtingen mellom 3d-elektronene og 4s-ene, ved krom blir 4s-energinivået litt høyere enn 3d, og derfor blir det mer lønnsomt å ha en [Ar] 3d 5 4s 1 - konfigurasjon enn en [Ar] 3d 4 4s 2 en. En lignende anomali oppstår ved kobber . Dette er brudd på Madelung-regelen. Slike anomalier har imidlertid ingen kjemisk betydning, ettersom de ulike konfigurasjonene er så nær hverandre i energi at nærværet av et nærliggende atom kan forskyve balansen. Det periodiske systemet ignorerer derfor disse og vurderer kun idealiserte konfigurasjoner.
Ved sink er 3d-orbitalene fullstendig fylt med totalt ti elektroner. Deretter kommer 4p-orbitalene som fullfører raden, som blir fylt progressivt av gallium gjennom krypton , på en måte som er helt analog med de tidligere p-blokkelementene. Fra gallium og utover utgjør 3d-orbitalene en del av den elektroniske kjernen, og deltar ikke lenger i kjemien. S- og p-blokkelementene, som fyller deres ytre skall, kalles hovedgruppeelementer ; d-blokkelementene (farget blå under), som fyller et indre skall, kalles overgangselementer (eller overgangsmetaller, siden de alle er metaller).
Ettersom 5s fyller før 4d, som fyller før 5p, har den femte raden nøyaktig samme struktur som den fjerde (selv om det igjen er noen anomalier når du fyller 4d-orbitalene).
| 1 H |
2 Han |
2×1 = 2 elementer 1s |
||||||||||||||||
| 3 Li |
4 Vær |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 elementer 2s 2p |
||||||||||
| 11 Na |
12 mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 elementer 3s 3 s |
||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 kr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18 elementer 4s 3d 4 s |
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 mnd |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 inn |
50 Sn |
51 Sb |
52 Te |
53 jeg |
54 Xe |
2×(1+3+5) = 18 elementer 5s 4d 5 s |
Den sjette raden i tabellen starter også med to s-blokkelementer: cesium og barium . Etter dette begynner de første f-blokkelementene (farget grønt under) å dukke opp, og starter med lantan . Disse kalles noen ganger indre overgangselementer. Siden det nå ikke bare er 4f, men også 5d og 6s subshell med lignende energier, oppstår konkurranse igjen med mange uregelmessige konfigurasjoner; dette har resultert i en del strid om hvor nøyaktig f-blokken skal begynne, men de fleste som studerer saken er enige om at den starter ved lantan i henhold til Aufbau-prinsippet. Selv om lantan ikke selv fyller 4f-orbitalen på grunn av frastøting mellom elektroner, har 4f-orbitalene lav nok energi til å delta i kjemi. Ved ytterbium er de syv 4f-orbitalene fullstendig fylt med fjorten elektroner; deretter følger en serie på ti overgangselementer ( lutetium gjennom kvikksølv ), og til slutt fullfører seks hovedgruppeelementer ( thallium gjennom radon ) perioden.
Den syvende raden er likeledes analog med den sjette raden: 7s fyller, deretter 5f, deretter 6d, og til slutt 7p, med noen få anomalier underveis. I svært lang tid var den syvende raden ufullstendig da de fleste av elementene ikke forekommer i naturen. De manglende elementene utover uran begynte å bli syntetisert i laboratoriet i 1940, da neptunium ble laget. Raden ble fullført med syntesen av tennessine i 2010 (det siste elementet oganesson var allerede laget i 2002), og de siste elementene i denne syvende raden ble validert og gitt navn i 2016.
| 1 H |
2 Han |
2×1 = 2 elementer 1s |
||||||||||||||||||||||||||||||
| 3 Li |
4 Vær |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 elementer 2s 2p |
||||||||||||||||||||||||
| 11 Na |
12 mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 elementer 3s 3 s |
||||||||||||||||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 kr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18 elementer 4s 3d 4 s |
||||||||||||||
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 mnd |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 inn |
50 Sn |
51 Sb |
52 Te |
53 jeg |
54 Xe |
2×(1+3+5) = 18 elementer 5s 4d 5 s |
||||||||||||||
| 55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61.00 _ |
62 Sm |
63 Eu |
64 Gd |
65 TB |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 kl |
86 Rn |
2×(1+3+5+7) = 32 elementer 6s 4f 5d 6p |
| 87 Fr |
88 Ra |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 am |
96 cm |
97 Bk |
98 Jf |
99 Es |
100 Fm |
101 Md |
102 nr |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
2×(1+3+5+7) = 32 elementer 7s 5f 6d 7p |
Dette fullfører det moderne periodiske systemet, med alle syv rader helt fylt til siste plass.
Følgende tabell viser elektronkonfigurasjonen til et nøytralt gassfaseatom i hvert element. Ulike konfigurasjoner kan favoriseres i forskjellige kjemiske miljøer. Hovedgruppeelementene har helt vanlige elektronkonfigurasjoner; overgangs- og indre overgangselementer viser tjue uregelmessigheter på grunn av den nevnte konkurransen mellom subshells nær energinivå. For de siste ti elementene (109–118) mangler eksperimentelle data og derfor er det vist beregnede konfigurasjoner i stedet. Helt fylte underskall har blitt nedtonet.
| Gruppe : | 1 | 2 | ? | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 1. 3 | 14 | 15 | 16 | 17 | 18 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s: | 1 H 1 |
2 han 2 |
||||||||||||||||||||||||||||||
|
[Han] 2s: 2p: |
3 Li 1 - |
4 Vær 2 - |
5 B 2 1 |
6 C 2 2 |
7 N 2 3 |
8 O 2 4 |
9 F 2 5 |
10 Ne 2 6 |
||||||||||||||||||||||||
|
[Ne] 3s: 3p: |
11 Na 1 - |
12 mg 2 - |
13 Al 2 1 |
14 Si 2 2 |
15 P 2 3 |
16 S 2 4 |
17 Cl 2 5 |
18 Ar 2 6 |
||||||||||||||||||||||||
|
[Ar] 4s: 3d: 4p: |
19 K 1 - - |
20 Ca 2 - - |
21 Sc 2 1 - |
22 Ti 2 2 - |
23 V 2 3 - |
24 Cr 1 5 - |
25 Mn 2 5 - |
26 Fe 2 6 - |
27 Co 2 7 - |
28 Ni 2 8 - |
29 Cu 1 10 - |
30 Zn 2 10 - |
31 Ga 2 10 1 |
32 Ge 2 10 2 |
33 Som 2 10 3 |
34 Se 2 10 4 |
35 Br 2 10 5 |
36 Kr 2 10 6 |
||||||||||||||
|
[Kr] 5s: 4d: 5p: |
37 Rb 1 - - |
38 Sr 2 - - |
39 Y 2 1 - |
40 Zr 2 2 - |
41 Nb 1 4 - |
42 ma 1 5 - |
43 Tc 2 5 - |
44 Ru 1 7 - |
45 Rh 1 8 - |
46 Pd - 10 - |
47 Ag 1 10 - |
48 Cd 2 10 - |
49 I 2 10 1 |
50 Sn 2 10 2 |
51 Sb 2 10 3 |
52 Te 2 10 4 |
53 I 2 10 5 |
54 Xe 2 10 6 |
||||||||||||||
|
[Xe] 6s: 4f: 5d: 6p: |
55 Cs 1 - - - |
56 Ba 2 - - - |
57 La 2 - 1 - |
58 Ce 2 1 1 - |
59 Pr 2 3 - - |
60 Nd 2 4 - - |
61.00 2 5 - -
_ |
62 Sm 2 6 - - |
63 Eu 2 7 - - |
64 Gd 2 7 1 - |
65 Tb 2 9 - - |
66 Dy 2 10 - - |
67 Ho 2 11 - - |
68 Er 2 12 - - |
69 Tm 2 13 - - |
70 Yb 2 14 - - |
71 Lu 2 14 1 - |
72 Hf 2 14 2 - |
73 Ta 2 14 3 - |
74 W 2 14 4 - |
75 Re 2 14 5 - |
76 Os 2 14 6 - |
77 Ir 2 14 7 - |
78 Pt 1 14 9 - |
79 Au 1 14 10 - |
80 Hg 2 14 10 - |
81 Tl 2 14 10 1 |
82 Pb 2 14 10 2 |
83 Bi 2 14 10 3 |
84 Po 2 14 10 4 |
85 på 2 14 10 5 |
86 Rn 2 14 10 6 |
|
[Rn] 7s: 5f: 6d: 7p: |
87 fr 1 - - - |
88 Ra 2 - - - |
89 Ac 2 - 1 - |
90 Th 2 - 2 - |
91 Pa 2 2 1 - |
92 U 2 3 1 - |
93 Np 2 4 1 - |
94 Pu 2 6 - - |
95 am 2 7 - - |
96 cm 2 7 1 - |
97 Bk 2 9 - - |
98 Jf . 2 10 - - |
99 Es 2 11 - - |
100 Fm 2 12 - - |
101 Md 2 13 - - |
102 No 2 14 - - |
103 Lr 2 14 - 1 |
104 Rf 2 14 2 - |
105 Db 2 14 3 - |
106 Sg 2 14 4 - |
107 Bh 2 14 5 - |
108 Hs 2 14 6 - |
109 Mt 2 14 7 - |
110 Ds 2 14 8 - |
111 Rg 2 14 9 - |
112 Cn 2 14 10 - |
113 Nh 2 14 10 1 |
114 Fl 2 14 10 2 |
115 Mc 2 14 10 3 |
116 Lv 2 14 10 4 |
117 Ts 2 14 10 5 |
118 Og 2 14 10 6 |
|
|
||||||||||||||||||||||||||||||||
Presentasjonsskjemaer
Av plasshensyn er det periodiske systemet vanligvis presentert med f-blokkelementene skåret ut og plassert som en fotnote under hoveddelen av tabellen, som nedenfor.
Begge former representerer det samme periodiske systemet. Skjemaet med f-blokken inkludert i hoveddelen kalles noen ganger 32-kolonnen eller lang form; skjemaet med f-blokken utskåret kalles noen ganger 18-kolonnen eller middels lang form. Formen med 32 kolonner har fordelen av å vise alle elementene i riktig rekkefølge, men den har den ulempen at den krever mer plass.
Alle periodiske tabeller viser grunnstoffenes symboler; mange gir også utfyllende informasjon om elementene, enten via fargekoding eller som data i cellene. Tabellen ovenfor viser navn og atomnummer til elementene, og også deres blokker, naturlige forekomster og standard atomvekter . For de kortlivede grunnstoffene uten standard atomvekter brukes i stedet massetallet til den mest stabile kjente isotopen. Andre tabeller kan inkludere egenskaper som materietilstand, smelte- og kokepunkter, tettheter, samt gi ulike klassifiseringer av elementene.
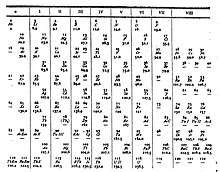
Under en internasjonal navnekonvensjon er gruppene nummerert numerisk fra 1 til 18 fra kolonnen lengst til venstre (alkalimetallene) til kolonnen lengst til høyre (edelgassene). F-blokkgruppene ignoreres i denne nummereringen. Grupper kan også navngis etter deres første element, f.eks. "skandiumgruppen" for gruppe 3. Tidligere var grupper kjent med romertall . I Amerika ble romertall etterfulgt av enten en "A" hvis gruppen var i s- eller p-blokken , eller en "B" hvis gruppen var i d-blokken . Romertallene som ble brukt tilsvarer det siste sifferet i dagens navnekonvensjon (f.eks. gruppe 4-elementene var gruppe IVB, og gruppe 14-elementene var gruppe IVA). I Europa var bokstaven lik, bortsett fra at "A" ble brukt hvis gruppen var før gruppe 10 , og "B" ble brukt for grupper inkludert og etter gruppe 10. I tillegg ble gruppene 8, 9 og 10 behandlet som en tredobbelt stor gruppe, kjent samlet i begge notasjonene som gruppe VIII. I 1988 ble det nye IUPAC-navnesystemet tatt i bruk, og de gamle gruppenavnene ble avviklet.
| IUPAC-gruppen | 1 | 2 | n/a | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 1. 3 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Mendeleev (I–VIII) | Jeg | II | III | IV | V | VI | VII | VIII | Jeg | II | III | IV | V | VI | VII | ||||
| CAS (USA, ABA) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |||
| gamle IUPAC (Europa, AB) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIII | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | |||
| Trivielt navn | H og alkalimetaller | Alkaliske jordmetaller | Myntmetaller | Triels | Tetrels | Pnictogens | Kalkogener | Halogener | Edelgasser | ||||||||||
| Navn etter element | Litium gruppe | Beryllium gruppe | Scandium gruppe | Titanium gruppe | Vanadium gruppe | Krom gruppe | Mangan gruppe | Jerngruppe | Kobolt gruppe | Nikkel gruppe | Kobbergruppe | Sink gruppe | Borgruppe | Karbongruppe | Nitrogen gruppe | Oksygengruppe | Fluor gruppe | Helium eller Neon gruppe | |
| Periode 1 | H | Han | |||||||||||||||||
| Periode 2 | Li | Være | B | C | N | O | F | Ne | |||||||||||
| Periode 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| Periode 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | |
| Periode 5 | Rb | Sr | Y | Zr | NB | Mo | Tc | Ru | Rh | Pd | Ag | Cd | I | Sn | Sb | Te | Jeg | Xe | |
| Periode 6 | Cs | Ba | La–Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn |
| Periode 7 | Fr | Ra | Ac–No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
n/a Har ikke gruppenummer
b Sammensetningen av gruppe 3 er ikke avtalt mellom kildene: se Periodesystemet#Gruppe 3 og Gruppe 3 element#Tvist om sammensetning . Generelle uorganiske kjemitekster setter vanligvis skandium (Sc), yttrium (Y), lantan (La) og aktinium (Ac) i gruppe 3, slik at Ce–Lu og Th–Lr blir f-blokken mellom gruppe 3 og 4. Imidlertid legger kilder som studerer saken vanligvis scandium, yttrium, lutetium (Lu) og lawrencium (Lr) i gruppe 3, som vist her. Noen kilder, inkludert IUPAC, følger for tiden et kompromiss som setter La–Lu og Ac–Lr som f-blokkradene, og etterlater de tyngre medlemmene i gruppe 3 tvetydige. Ordningen med Sc, Y, Lu og Lr i gruppe 3 er anbefalt av en foreløpig IUPAC-rapport fra 2021 om dette spørsmålet.
c Gruppe 18, edelgassene, ble ikke oppdaget på tidspunktet for Mendeleevs opprinnelige tabell. Senere (1902) aksepterte Mendeleev bevisene for deres eksistens, og de kunne plasseres i en ny "gruppe 0", konsekvent og uten å bryte det periodiske system-prinsippet.
d Forfattere er uenige om hvorvidt røntgenium (Rg) regnes som et myntmetall. Det er i gruppe 11, som de andre myntmetallene, og forventes å være kjemisk lik gull. På den annen side, som er ekstremt radioaktiv og kortvarig, kan den faktisk ikke brukes til mynt som navnet antyder, og på den bakgrunn er den noen ganger utelukket.
r Gruppenavn som anbefalt av IUPAC.
Periodiske trender
Siden kjemiske reaksjoner involverer valenselektronene, kan det forventes at elementer med lignende ytre elektronkonfigurasjoner reagerer på samme måte og danner forbindelser med lignende andeler av elementer i dem. Slike elementer er plassert i samme gruppe, og det har derfor en tendens til å være klare likheter og trender i kjemisk atferd når man går nedover en gruppe. Ettersom analoge konfigurasjoner kommer tilbake med jevne mellomrom, viser egenskapene til elementene dermed periodiske gjentakelser, derav navnet på det periodiske systemet og den periodiske loven. Disse periodiske tilbakefallene ble lagt merke til i god tid før den underliggende teorien som forklarer dem ble utviklet.
For eksempel kan valensen til et element defineres enten som antall hydrogenatomer som kan kombineres med det for å danne et enkelt binært hydrid, eller som dobbelt så mange oksygenatomer som kan kombineres med det for å danne et enkelt binært oksid ( det vil si ikke et peroksid eller et superoksid ). Valensene til hovedgruppeelementene er direkte relatert til gruppenummeret: hydridene i hovedgruppene 1–2 og 13–17 følger formlene MH, MH 2 , MH 3 , MH 4 , MH 3 , MH 2 , og endelig MH. De høyeste oksidene øker i stedet i valens, etter formlene M 2 O, MO, M 2 O 3 , MO 2 , M 2 O 5 , MO 3 , M 2 O 7 . Elektronkonfigurasjonen antyder en enkel forklaring fra antall elektroner som er tilgjengelige for binding, selv om en fullstendig forklaring krever å vurdere energien som vil bli frigjort ved å danne forbindelser med forskjellige valenser i stedet for å bare vurdere elektronkonfigurasjoner alene. I dag har forestillingen om valens blitt utvidet med oksidasjonstilstanden , som er den formelle ladningen som er igjen på et grunnstoff når alle andre elementer i en forbindelse har blitt fjernet som deres ioner.
Siden elementer i samme gruppe deler samme valenskonfigurasjoner, viser de vanligvis lignende kjemisk oppførsel. For eksempel har alkalimetallene i den første gruppen alle ett valenselektron, og danner en veldig homogen klasse av elementer: de er alle myke og reaktive metaller. Det er imidlertid mange faktorer involvert, og grupper kan ofte være ganske heterogene. For eksempel omfatter de stabile elementene i gruppe 14 et ikke-metall ( karbon ), to halvledere ( silisium og germanium ) og to metaller ( tinn og bly ). De er likevel forent ved å ha fire valenselektroner.
Atomradius
Atomradius (størrelsen på atomer) reduseres generelt fra venstre til høyre langs hovedgruppeelementene, fordi kjerneladningen øker, men de ytre elektronene er fortsatt i samme skall. Men når man går nedover en kolonne, øker radiene generelt, fordi de ytterste elektronene er i høyere skall som dermed er lenger unna kjernen.
I overgangselementene fyller et indre skall, men størrelsen på atomet bestemmes fortsatt av de ytre elektronene. Den økende kjerneladningen over serien og det økte antallet indre elektroner for skjerming kompenserer noe for hverandre, så reduksjonen i radius er mindre. 4p- og 5d-atomene, som kommer umiddelbart etter at nye typer overgangsserier først ble introdusert, er mindre enn forventet.
Ioniseringsenergi
Den første ioniseringsenergien til et atom er energien som kreves for å fjerne et elektron fra det. Dette varierer med atomradius: ioniseringsenergien øker fra venstre til høyre og ned til opp, fordi elektroner som er nærmere kjernen holdes tettere og er vanskeligere å fjerne. Ioniseringsenergien minimeres dermed ved det første elementet i hver periode – hydrogen og alkalimetallene – og stiger deretter generelt til den når edelgassen i høyre kant av perioden. Det er noen unntak fra denne trenden, for eksempel oksygen, hvor elektronet som fjernes er sammenkoblet og dermed gjør interelektronisk frastøting det lettere å fjerne enn forventet.
I overgangsserien går de ytre elektronene fortrinnsvis tapt selv om de indre orbitalene fylles. For eksempel, i 3d-serien, går 4s-elektronene tapt først selv om 3d-orbitalene fylles. Skjermingseffekten ved å legge til et ekstra 3d-elektron kompenserer omtrentlig økningen i kjernefysisk ladning, og derfor forblir ioniseringsenergiene stort sett konstant, selv om det er en liten økning spesielt på slutten av hver overgangsserie.
Ettersom metallatomer har en tendens til å miste elektroner i kjemiske reaksjoner, er ioniseringsenergi generelt korrelert med kjemisk reaktivitet, selv om det også er andre faktorer involvert.
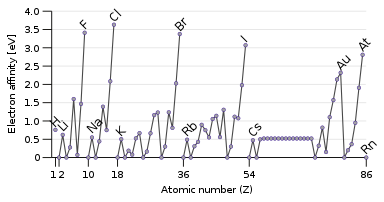
Elektron affinitet
Den motsatte egenskapen til ioniseringsenergi er elektronaffiniteten , som er energien som frigjøres når et elektron tilsettes atomet. Et passerende elektron vil lettere bli tiltrukket av et atom hvis det føler trekningen av kjernen sterkere, og spesielt hvis det er en tilgjengelig delvis fylt ytre orbital som kan romme det. Derfor har elektronaffinitet en tendens til å øke ned til opp og fra venstre til høyre. Unntaket er den siste kolonnen, edelgassene, som har fullt skall og ikke har plass til enda et elektron. Dette gir halogenene i den nest siste kolonnen de høyeste elektronaffinitetene.
Noen atomer, som edelgassene, har ingen elektronaffinitet: de kan ikke danne stabile gassfaseanioner. Edelgassene, som har høye ioniseringsenergier og ingen elektronaffinitet, har liten tilbøyelighet til å motta eller miste elektroner og er generelt ikke reaktive.
Noen unntak fra trendene forekommer: oksygen og fluor har lavere elektronaffiniteter enn deres tyngre homologer svovel og klor, fordi de er små atomer, og derfor vil det nylig tilførte elektronet oppleve betydelig frastøtning fra de allerede eksisterende. For de ikke-metalliske elementene korrelerer elektronaffinitet også noe med reaktivitet, men ikke perfekt siden andre faktorer er involvert. For eksempel har fluor lavere elektronaffinitet enn klor, men er mer reaktiv.
Elektronegativitet
En annen viktig egenskap ved elementer er deres elektronegativitet . Atomer kan danne kovalente bindinger til hverandre ved å dele elektroner i par, og skape en overlapping av valensorbitaler. I hvilken grad hvert atom tiltrekker seg det delte elektronparet avhenger av atomets elektronegativitet – tendensen til et atom til å få eller miste elektroner. Det mer elektronegative atomet vil ha en tendens til å tiltrekke seg elektronparet mer, og det mindre elektronegative (eller mer elektropositive) vil tiltrekke det mindre. I ekstreme tilfeller kan elektronet tenkes å ha blitt ført fullstendig fra det mer elektropositive atomet til det mer elektronegative, selv om dette er en forenkling. Bindingen binder deretter to ioner, ett positivt (etter å ha gitt opp elektronet) og ett negativt (etter å ha akseptert det), og kalles en ionisk binding .
Elektronegativitet avhenger av hvor sterkt kjernen kan tiltrekke seg et elektronpar, og derfor viser den en lignende variasjon som de andre egenskapene som allerede er diskutert: elektronegativitet har en tendens til å falle opp til ned, og stige fra venstre mot høyre. Alkali- og jordalkalimetallene er blant de mest elektropositive grunnstoffene, mens kalkogenene, halogenene og edelgassene er blant de mest elektronegative.
Elektronegativitet måles generelt på Pauling-skalaen, der det mest elektronegative reaktive atomet ( fluor ) er gitt elektronegativitet 4,0, og det minst elektronegative atomet ( cesium ) får elektronegativitet 0,79. (Teoretisk sett ville neon vært mer elektronegativt enn fluor, men Pauling-skalaen kan ikke måle elektronegativiteten fordi den ikke danner kovalente bindinger.)
Et grunnstoffs elektronegativitet varierer med identiteten og antallet av atomene det er bundet til, samt hvor mange elektroner det allerede har mistet: Et atom blir mer elektronegativt når det har mistet flere elektroner. Dette utgjør noen ganger en stor forskjell: bly i +2-oksidasjonstilstanden har elektronegativitet 1,87 på Pauling-skalaen, mens bly i +4-oksidasjonstilstanden har elektronegativitet 2,33.
Metallisitet
Et enkelt stoff er et stoff dannet av atomer av ett kjemisk grunnstoff. De enkle stoffene i de mer elektronegative atomene har en tendens til å dele elektroner (danner kovalente bindinger) med hverandre. De danner enten små molekyler (som hydrogen eller oksygen, hvis atomer bindes i par) eller gigantiske strukturer som strekker seg i det uendelige (som karbon eller silisium). Edelgassene forblir rett og slett som enkeltatomer, siden de allerede har et fullt skall. Stoffer som består av diskrete molekyler eller enkeltatomer holdes sammen av svakere tiltrekningskrefter mellom molekylene, slik som London-spredningskraften : når elektroner beveger seg i molekylene, skaper de øyeblikkelige ubalanser av elektrisk ladning, som induserer lignende ubalanser på nærliggende molekyler og skaper synkroniserte bevegelser av elektroner over mange nærliggende molekyler.
De mer elektropositive atomene har imidlertid en tendens til i stedet å miste elektroner, og skaper et "hav" av elektroner som oppsluker kationer. De ytre orbitalene til ett atom overlapper hverandre for å dele elektroner med alle naboene, og skaper en gigantisk struktur av molekylære orbitaler som strekker seg over hele strukturen. Dette negativt ladede "havet" trekker på alle ionene og holder dem sammen i en metallisk binding . Elementer som danner slike bindinger kalles ofte metaller ; de som ikke gjør det kalles ofte ikke-metaller . Noen grunnstoffer kan danne flere enkle stoffer med forskjellige strukturer: disse kalles allotroper . For eksempel er diamant og grafitt to allotroper av karbon.
Metallisiteten til et element kan forutsies ut fra elektroniske egenskaper. Når atomorbitaler overlapper under metallisk eller kovalent binding, skaper de både bindings- og antibindingsmolekylære orbitaler med samme kapasitet, med antibindings-orbitaler med høyere energi. Nettobindingskarakter oppstår når det er flere elektroner i bindingsorbitalene enn det er i antibindings-orbitalene. Metallisk binding er dermed mulig når antallet elektroner som delokaliseres av hvert atom er mindre enn det dobbelte av antallet orbitaler som bidrar til overlappingen. Dette er situasjonen for elementer i gruppe 1 til 13; de har også for få valenselektroner til å danne gigantiske kovalente strukturer der alle atomer tar likeverdige posisjoner, og så nesten alle metalliseres. Unntakene er hydrogen og bor, som har for høy ioniseringsenergi. Hydrogen danner dermed et kovalent H 2 molekyl, og bor danner en gigantisk kovalent struktur basert på ikosaedriske B 12 klynger. I et metall har bindings- og antibindings-orbitalene overlappende energier, og skaper et enkelt bånd som elektroner fritt kan strømme gjennom, og tillater elektrisk ledning.
I gruppe 14 blir både metallisk og kovalent binding mulig. I en diamantkrystall er kovalente bindinger mellom karbonatomer sterke, fordi de har en liten atomradius og dermed har kjernen mer grep om elektronene. Derfor er bindingsorbitalene som resulterer mye lavere i energi enn antibindings-orbitalene, og det er ingen overlapping, så elektrisk ledning blir umulig: karbon er et ikke-metall. Imidlertid blir kovalent binding svakere for større atomer, så silisium og germanium har mindre båndgap og er halvledere : elektroner kan krysse gapet når de eksiteres termisk. Til slutt forsvinner båndgapet i tinn, slik at tinn og bly blir til metaller.
Elementer i gruppe 15 til 17 har for mange elektroner til å danne gigantiske kovalente molekyler som strekker seg i alle tre dimensjoner. For de lettere grunnstoffene er bindingene i små diatomiske molekyler så sterke at en kondensert fase blir ugunstig: dermed nitrogen (N 2 ), oksygen (O 2 ), hvitt fosfor (P 4 ), svovel (S 8 ), og det stabile halogener (F 2 , Cl 2 , Br 2 og I 2 ) danner lett kovalente molekyler med få atomer. De tyngre har en tendens til å danne lange kjeder (f.eks. rødt fosfor, grått selen, tellur) eller lagdelte strukturer (f.eks. karbon som grafitt, svart fosfor, grå arsen, grå antimon, vismut) som bare strekker seg i én eller to i stedet for tre dimensjoner. Siden disse strukturene ikke bruker alle orbitalene for binding, ender de opp med bindings-, ikke-bindende og antibindingsbånd i rekkefølge med økende energi. I likhet med gruppe 14 krymper båndgapene for de tyngre elementene og fri bevegelse av elektroner mellom kjedene eller lagene blir mulig. Således er for eksempel svart fosfor, svart arsen, grått selen, tellur og jod halvledere; grå arsen, grå antimon og vismut er halvmetaller (som viser kvasi-metallisk ledning, med en veldig liten båndoverlapping); og polonium og sannsynligvis astatin er ekte metaller. Til slutt forblir den naturlige gruppe 18-elementene som individuelle atomer.
Skillelinjen mellom metaller og ikke-metaller er omtrent diagonal fra øverst til venstre til nederst til høyre, med overgangsserien som vises til venstre for denne diagonalen (da de har mange tilgjengelige orbitaler for overlapping). Dette er forventet, ettersom metallisitet har en tendens til å være korrelert med elektropositivitet og viljen til å miste elektroner, som øker fra høyre til venstre og opp til ned. Dermed er metallene i stor grad flere enn ikke-metallene. Elementer nær grensen er vanskelige å klassifisere: de har en tendens til å ha egenskaper som er mellomliggende mellom de til metaller og ikke-metaller, og kan ha noen egenskaper som er karakteristiske for begge. De kalles ofte halvmetaller eller metalloider . Begrepet "halvmetall" brukt i denne forstand bør ikke forveksles med dets strenge fysiske betydning som har å gjøre med båndstruktur: vismut er fysisk et halvmetall, men regnes generelt som et metall av kjemikere.
Følgende tabell vurderer de mest stabile allotropene ved standardforhold. De gulfargede elementene danner enkle stoffer som er godt kjennetegnet ved metallisk binding. Elementer farget lyseblått danner gigantiske kovalente strukturer, mens de fargede mørkeblå danner små kovalent bundne molekyler som holdes sammen av svakere van der Waals-krefter . Edelgassene er farget i fiolett: molekylene deres er enkeltatomer og ingen kovalent binding oppstår. Gråtonede celler er for grunnstoffer som ikke er tilberedt i tilstrekkelige mengder til at deres mest stabile allotroper har blitt karakterisert på denne måten. Teoretiske betraktninger antyder at alle (eller i det minste nesten alle) av disse elementene ville metallisere hvis de kunne danne kondenserte faser, selv om dette har blitt stilt spørsmål ved copernicium og oganesson.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 1. 3 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gruppe → | ||||||||||||||||||||||||||||||||
| ↓ Periode | ||||||||||||||||||||||||||||||||
| 1 | H | Han | ||||||||||||||||||||||||||||||
| 2 | Li | Være | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | NB | Mo | Tc | Ru | Rh | Pd | Ag | Cd | I | Sn | Sb | Te | Jeg | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Er | Cm | Bk | Jfr | Es | Fm | Md | Nei | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
|
|
||||||||||||||||||||||||||||||||
Metallisk Kjempe kovalent Molekylær kovalent Enkelte atomer Ukjent Bakgrunnsfarge viser binding av enkle stoffer i det periodiske systemet
Generelt er metaller skinnende og tette. De har vanligvis høye smelte- og kokepunkter på grunn av styrken til den metalliske bindingen, og er ofte formbare og formbare (lett strukket og formet) fordi atomene kan bevege seg i forhold til hverandre uten å bryte den metalliske bindingen. De leder elektrisitet fordi elektronene deres kan bevege seg fritt i alle tre dimensjoner. På samme måte leder de varme, som overføres av elektronene som ekstra kinetisk energi : de beveger seg raskere. Disse egenskapene vedvarer i flytende tilstand, som selv om krystallstrukturen blir ødelagt ved smelting, berører atomene fortsatt og den metalliske bindingen vedvarer, selv om den er svekket. Metaller har en tendens til å være reaktive overfor ikke-metaller. Noen unntak kan finnes fra disse generaliseringene: for eksempel er mangan, arsen, antimon og vismut sprø; krom er ekstremt hardt; gallium, rubidium, cesium og kvikksølv er flytende ved eller nær romtemperatur; og edle metaller som gull er kjemisk svært inerte.
Ikke-metaller viser forskjellige egenskaper. De som danner gigantiske kovalente krystaller viser høye smelte- og kokepunkter, da det krever betydelig energi å overvinne de sterke kovalente bindingene. De som danner adskilte molekyler holdes for det meste sammen av spredningskrefter, som er lettere å overvinne; dermed har de en tendens til å ha lavere smelte- og kokepunkter, og mange er væsker eller gasser ved romtemperatur. Ikke-metaller ser ofte kjedelig ut. De har en tendens til å være reaktive mot metaller, bortsett fra edelgassene, som er inerte mot de fleste stoffer. De er sprø når de er faste, da atomene deres holdes tett på plass. De er mindre tette og leder strøm dårlig, fordi det ikke er mobile elektroner. Nær grensen er båndgapene små, og derfor er mange elementer i den regionen halvledere. Igjen er det unntak; for eksempel har diamant den høyeste varmeledningsevnen av alle kjente materialer, større enn noe metall.
Det er vanlig å utpeke en klasse metalloider som strekker seg over grensen mellom metaller og ikke-metaller, ettersom elementer i den regionen er mellomliggende i både fysiske og kjemiske egenskaper. Det er imidlertid ingen konsensus i litteraturen for nøyaktig hvilke elementer som bør betegnes slik. Når en slik kategori brukes, er bor, silisium, germanium, arsen, antimon og tellur vanligvis inkludert; men de fleste kilder inkluderer også andre elementer, uten enighet om hvilke ekstra elementer som skal legges til, og noen andre trekker fra denne listen i stedet. For eksempel inkluderer det periodiske systemet brukt av American Chemical Society polonium som metalloid, men det som brukes av Royal Society of Chemistry gjør det ikke, og det som er inkludert i Encyclopædia Britannica refererer ikke til metalloider eller halvmetaller i det hele tatt.
Ytterligere manifestasjoner av periodisitet
Det er noen andre relasjoner gjennom det periodiske systemet mellom grunnstoffer som ikke er i samme gruppe, for eksempel de diagonale relasjonene mellom grunnstoffer som er diagonalt tilstøtende (f.eks. litium og magnesium). Noen likheter kan også finnes mellom hovedgruppene og overgangsmetallgruppene, eller mellom de tidlige aktinidene og tidlige overgangsmetallene, når grunnstoffene har samme antall valenselektroner. Dermed ligner uran noe på krom og wolfram i gruppe 6, da alle tre har seks valenselektroner.
Den første raden i hver blokk har en tendens til å vise ganske forskjellige egenskaper fra de andre radene, fordi den første orbitalen av hver type (1s, 2p, 3d, 4f, 5g, etc.) er betydelig mindre enn forventet. Graden av anomalien er høyest for s-blokken, er moderat for p-blokken, og er mindre uttalt for d- og f-blokken. Det er også en oddetallsforskjell mellom periodene (unntatt i s-blokken) som noen ganger er kjent som sekundær periodisitet: elementer i partallsperioder har mindre atomradius og foretrekker å miste færre elektroner, mens grunnstoffer i oddeperioder (unntatt først) skiller seg i motsatt retning. Dermed viser mange eiendommer i p-blokken en sikksakk snarere enn en jevn trend langs gruppen. For eksempel når fosfor og antimon i odde perioder i gruppe 15 lett oksidasjonstilstanden +5, mens nitrogen, arsen og vismut i jevne perioder foretrekker å holde seg på +3.
Når atomkjerner blir høyt ladet, er det nødvendig med spesiell relativitetsteori for å måle effekten av kjernen på elektronskyen. Disse relativistiske effektene resulterer i at tunge grunnstoffer i økende grad har forskjellige egenskaper sammenlignet med deres lettere homologer i det periodiske systemet. For eksempel forklarer relativistiske effekter hvorfor gull er gyllent og kvikksølv er en væske. Disse effektene forventes å bli veldig sterke i slutten av den syvende perioden, noe som potensielt kan føre til en kollaps av periodisitet. Elektronkonfigurasjoner og kjemiske egenskaper er bare klart kjent til element 108 ( hassium ), så den kjemiske karakteriseringen av de tyngste elementene forblir et tema for nåværende forskning.
Mange andre fysiske egenskaper til elementene viser periodisk variasjon i samsvar med den periodiske loven, for eksempel smeltepunkter , kokepunkter , fusjonsvarme , fordampningsvarme , forstøvningsenergi , og så videre. Lignende periodiske variasjoner vises for grunnstoffenes forbindelser, som kan observeres ved å sammenligne hydrider, oksider, sulfider, halogenider og så videre. Kjemiske egenskaper er vanskeligere å beskrive kvantitativt, men har også sine egne periodisiteter. Eksempler inkluderer hvordan oksidasjonstilstander har en tendens til å variere i trinn på 2 i hovedgruppeelementene, men i trinn på 1 for overgangselementene; variasjonen i de sure og basiske egenskapene til elementene og deres forbindelser; stabiliteten til forbindelser; og metoder for å isolere elementene. Periodisitet er og har blitt brukt veldig mye for å forutsi egenskapene til ukjente nye grunnstoffer og nye forbindelser, og er sentral i moderne kjemi.
Klassifisering av elementer
Mange begreper har blitt brukt i litteraturen for å beskrive sett med elementer som oppfører seg likt. Gruppenavnene alkalimetall , jordalkalimetall , pniktogen , kalkogen , halogen og edelgass er anerkjent av IUPAC; de andre gruppene kan refereres til ved deres nummer, eller ved deres første element (f.eks. gruppe 6 er kromgruppen). Noen deler p-blokkelementene fra gruppene 13 til 16 etter metallisitet, selv om det verken er en IUPAC-definisjon eller en presis konsensus om nøyaktig hvilke elementer som skal betraktes som metaller, ikke-metaller eller halvmetaller (noen ganger kalt metalloider). Det er heller ikke konsensus om hva metallene som etterfølger overgangsmetallene bør kalles, med post-transition metall og fattigmetall som blant mulighetene som har blitt brukt. Noen avanserte monografier ekskluderer elementene i gruppe 12 fra overgangsmetallene på grunn av deres noen ganger ganske forskjellige kjemiske egenskaper, men dette er ikke en universell praksis.
Lantanidene anses å være grunnstoffene La–Lu, som alle er veldig like hverandre: historisk sett inkluderte de bare Ce–Lu, men lantan ble inkludert ved vanlig bruk. De sjeldne jordartelementene (eller sjeldne jordmetaller) tilfører lantanidene skandium og yttrium. Analogt anses aktinidene for å være elementene Ac–Lr (historisk Th–Lr), selv om variasjonen av egenskaper i dette settet er mye større enn innenfor lantanidene. IUPAC anbefaler navnene lantanoider og aktinoider for å unngå tvetydighet, da -ide-suffikset typisk betegner et negativt ion; Imidlertid forblir lantanider og aktinider vanlige.
Mange flere kategoriseringer finnes og brukes i henhold til visse disipliner. I astrofysikk er et metall definert som ethvert grunnstoff med atomnummer større enn 2, altså alt unntatt hydrogen og helium. Begrepet "halvmetall" har en annen definisjon i fysikk enn det gjør i kjemi: vismut er et halvmetall etter fysiske definisjoner, men kjemikere anser det generelt som et metall. Noen få begreper er mye brukt, men uten noen veldig formell definisjon, for eksempel " tungmetall ", som har fått et så bredt spekter av definisjoner at det har blitt kritisert som "effektivt meningsløst".
Omfanget av begreper varierer betydelig mellom forfattere. For eksempel, ifølge IUPAC, utvider edelgassene seg til å omfatte hele gruppen, inkludert det svært radioaktive supertunge grunnstoffet oganesson. Imidlertid, blant de som spesialiserer seg på de supertunge elementene, gjøres dette ikke ofte: i dette tilfellet blir "edelgass" vanligvis tatt for å antyde den ureaktive oppførselen til de lettere elementene i gruppen. Siden beregninger generelt forutsier at oganesson ikke bør være spesielt inert på grunn av relativistiske effekter, og kanskje ikke engang er en gass ved romtemperatur hvis den kunne produseres i bulk, stilles det ofte spørsmål ved dens status som en edelgass i denne sammenhengen. Videre er det noen ganger påtruffet nasjonale variasjoner: i Japan inkluderer jordalkalimetaller ofte ikke beryllium og magnesium, da deres oppførsel er forskjellig fra de tyngre gruppe 2-metallene.
Historie
I 1817 begynte den tyske fysikeren Johann Wolfgang Döbereiner å formulere et av de tidligste forsøkene på å klassifisere grunnstoffene. I 1829 fant han ut at han kunne danne noen av elementene i grupper på tre, med medlemmene av hver gruppe som hadde beslektede egenskaper. Han kalte disse gruppene triader . Klor, brom og jod dannet en triade; det samme gjorde kalsium, strontium og barium; litium, natrium og kalium; og svovel, selen og tellur. I dag utgjør alle disse triadene en del av dagens grupper. Ulike kjemikere fortsatte arbeidet hans og var i stand til å identifisere flere og flere forhold mellom små grupper av grunnstoffer. Imidlertid kunne de ikke bygge ett opplegg som omfattet dem alle.
Den tyske kjemikeren Lothar Meyer bemerket sekvensene av lignende kjemiske og fysiske egenskaper gjentatt med jevne mellomrom. Iflg _ _ rekkefølgen av deres atomvekter. I 1864 ble en bok av ham utgitt; den inneholdt en tidlig versjon av det periodiske systemet som inneholdt 28 grunnstoffer, og klassifiserte grunnstoffene i seks familier etter deres valens - for første gang hadde elementene blitt gruppert i henhold til deres valens. Arbeid med å organisere grunnstoffene etter atomvekt hadde inntil da blitt hindret av unøyaktige målinger av atomvektene. I 1868 reviderte han tabellen, men denne revisjonen ble publisert som et utkast først etter hans død.
Det definitive gjennombruddet kom fra den russiske kjemikeren Dmitri Mendeleev . Selv om andre kjemikere (inkludert Meyer) hadde funnet noen andre versjoner av det periodiske systemet omtrent på samme tid, var Mendeleev den mest dedikerte til å utvikle og forsvare systemet sitt, og det var systemet hans som påvirket det vitenskapelige samfunnet mest. Den 17. februar 1869 (1. mars 1869 i den gregorianske kalenderen) begynte Mendeleev å ordne grunnstoffene og sammenligne dem etter deres atomvekter. Han begynte med noen få elementer, og i løpet av dagen vokste systemet hans til det omfattet de fleste kjente elementene. Etter å ha funnet en konsistent ordning, dukket hans trykte tabell opp i mai 1869 i tidsskriftet til Russian Chemical Society. I noen tilfeller så det ut til at det manglet et element i systemet, og han spådde dristig at det betydde at elementet ennå ikke hadde blitt oppdaget. I 1871 publiserte Mendeleev en lang artikkel, inkludert en oppdatert form for tabellen hans, som gjorde spådommene hans for ukjente elementer eksplisitte. Mendeleev forutså egenskapene til tre av disse ukjente elementene i detalj: ettersom de ville mangle tyngre homologer av bor, aluminium og silisium, kalte han dem eka-bor, eka-aluminium og eka-silisium ("eka" er sanskrit for "en").
I 1875 oppdaget den franske kjemikeren Paul-Émile Lecoq de Boisbaudran , uten kunnskap om Mendeleevs spådom, et nytt grunnstoff i en prøve av mineralet sfaleritt , og kalte det gallium. Han isolerte elementet og begynte å bestemme dets egenskaper. Mendeleev, som leste de Boisbaudrans publikasjon, sendte et brev der han hevdet at gallium var hans forutsagte eka-aluminium. Selv om Lecoq de Boisbaudran i utgangspunktet var skeptisk, og mistenkte at Mendeleev prøvde å ta æren for oppdagelsen hans, innrømmet han senere at Mendeleev hadde rett. I 1879 oppdaget den svenske kjemikeren Lars Fredrik Nilson et nytt grunnstoff, som han kalte scandium: det viste seg å være eka-bor. Eka-silisium ble funnet i 1886 av den tyske kjemikeren Clemens Winkler , som kalte det germanium. Egenskapene til gallium, scandium og germanium stemte overens med det Mendeleev hadde spådd. I 1889 bemerket Mendeleev på Faraday-forelesningen til Royal Institution i London at han ikke hadde forventet å leve lenge nok "til å nevne oppdagelsen deres for Chemical Society of Great Britain som en bekreftelse på nøyaktigheten og generaliteten til den periodiske loven". Selv oppdagelsen av edelgassene på slutten av 1800-tallet, som Mendeleev ikke hadde forutsagt, passet godt inn i opplegget hans som en åttende hovedgruppe. Imidlertid hadde Mendeleev noen problemer med å passe de kjente lantanidene inn i opplegget sitt, da de ikke viste den periodiske endringen i valens som de andre elementene gjorde. Etter mye etterforskning foreslo den tsjekkiske kjemikeren Bohuslav Brauner i 1902 at lantanidene alle kunne plasseres sammen i én gruppe på det periodiske system. Han kalte dette "asteroidehypotesen" som en astronomisk analogi: akkurat som det er et asteroidebelte i stedet for en enkelt planet mellom Mars og Jupiter, så ble plassen under yttrium okkupert av alle lantanidene i stedet for bare ett element.
Etter at den indre strukturen til atomet ble undersøkt, foreslo den nederlandske amatørfysiker Antonius van den Broek i 1913 at atomladningen bestemte plasseringen av grunnstoffer i det periodiske systemet. Den newzealandske fysikeren Ernest Rutherford laget ordet "atomnummer" for denne atomladningen. I van der Broeks publiserte artikkel illustrerte han det første elektroniske periodiske systemet som viser elementene ordnet etter antallet elektroner. Rutherford bekreftet i sin artikkel fra 1914 at Bohr hadde akseptert synet til van der Broek.
Samme år bekreftet den engelske fysikeren Henry Moseley ved bruk av røntgenspektroskopi van den Broeks forslag eksperimentelt. Moseley bestemte verdien av atomladningen til hvert element fra aluminium til gull og viste at Mendeleevs bestilling faktisk plasserer elementene i sekvensiell rekkefølge etter atomladning. Kjerneladning er identisk med protonantall og bestemmer verdien av atomnummeret ( Z ) til hvert grunnstoff. Å bruke atomnummer gir en definitiv, heltallsbasert sekvens for elementene. Moseleys forskning løste umiddelbart uoverensstemmelser mellom atomvekt og kjemiske egenskaper; disse var tilfeller som tellur og jod, hvor atomnummer øker, men atomvekt synker. Selv om Moseley snart ble drept i første verdenskrig, fortsatte den svenske fysikeren Manne Siegbahn arbeidet opp til uran , og slo fast at det var grunnstoffet med det høyeste atomnummeret som da var kjent (92). Basert på Moseley og Siegbahns forskning var det også kjent hvilke atomtall som tilsvarte manglende grunnstoffer som ennå ikke er funnet.
Den danske fysikeren Niels Bohr brukte Max Plancks idé om kvantisering på atomet. Han konkluderte med at energinivåene til elektroner ble kvantisert: bare et diskret sett med stabile energitilstander var tillatt. Bohr forsøkte deretter å forstå periodisitet gjennom elektronkonfigurasjoner, og antok i 1913 at de indre elektronene skulle være ansvarlige for de kjemiske egenskapene til elementet. I 1913 produserte han det første elektroniske periodiske systemet basert på et kvanteatom.
Bohr kalte elektronskjellene sine "ringer" i 1913: atomorbitaler i skjell eksisterte ikke på tidspunktet for hans planetmodell. Bohr forklarer i del 3 av sin berømte artikkel fra 1913 at de maksimale elektronene i et skall er åtte, og skriver: "Vi ser videre at en ring med n elektroner ikke kan rotere i en enkelt ring rundt en ladningskjerne ne med mindre n < 8 ." For mindre atomer vil elektronskallene bli fylt som følger: "ringer av elektroner vil bare slå seg sammen hvis de inneholder like mange elektroner; og følgelig vil antallet elektroner på indre ringer bare være 2, 4, 8." Men i større atomer ville det innerste skallet inneholde åtte elektroner: "på den annen side antyder det periodiske systemet til elementene sterkt at allerede i neon N = 10 vil det oppstå en indre ring på åtte elektroner." Hans foreslåtte elektronkonfigurasjoner for lette atomer (vist til høyre) stemmer ikke alltid overens med de som nå er kjent.
| Element | Elektroner per skall |
|---|---|
| 4 | 2,2 |
| 6 | 2,4 |
| 7 | 4,3 |
| 8 | 4,2,2 |
| 9 | 4,4,1 |
| 10 | 8,2 |
| 11 | 8,2,1 |
| 16 | 8,4,2,2 |
| 18 | 8,8,2 |
Den første som systematisk utvidet og korrigerte de kjemiske potensialene til Bohrs atomteori var Walther Kossel i 1914 og i 1916. Kossel forklarte at i det periodiske system ville nye grunnstoffer bli skapt etter hvert som elektroner ble lagt til det ytre skallet. I Kossels artikkel skriver han: "Dette fører til den konklusjon at elektronene, som tilsettes ytterligere, bør settes inn i konsentriske ringer eller skall, på hver av dem ... bare et visst antall elektroner - nemlig åtte i vår case—bør ordnes. Så snart en ring eller skall er fullført, må en ny startes for det neste elementet; antallet elektroner, som er lettest tilgjengelig, og som ligger i ytterste periferi, øker igjen fra elementet. til grunnstoff, og derfor gjentas den kjemiske periodisiteten i dannelsen av hvert nytt skall."
I en artikkel fra 1919 postulerte Irving Langmuir eksistensen av "celler" som vi nå kaller orbitaler, som hver bare kunne inneholde to elektroner hver, og disse ble arrangert i "ekvidistante lag" som vi nå kaller skjell. Han gjorde et unntak for at det første skallet bare inneholdt to elektroner. Kjemikeren Charles Rugeley Bury foreslo i 1921 at åtte og atten elektroner i et skall danner stabile konfigurasjoner. Bury foreslo at elektronkonfigurasjonene i overgangselementer var avhengig av valenselektronene i deres ytre skall. Han introduserte ordet overgang for å beskrive elementene som nå er kjent som overgangsmetaller eller overgangselementer. Kvanteteorien klargjorde overgangsmetallene og lantanidene til å danne sine egne separate grupper, overgangsmessige mellom hovedgruppene, selv om noen kjemikere allerede hadde foreslått tabeller som viser dem på denne måten før da: den engelske kjemikeren Henry Bassett gjorde det i 1892, den danske kjemikeren Julius Thomsen i 1895, og den sveitsiske kjemikeren Alfred Werner i 1905. Bohr brukte Thomsens form i sin Nobelforelesning fra 1922; Werners form er veldig lik den moderne 32-søyleformen.
Forespurt av Bohr tok Wolfgang Pauli opp problemet med elektronkonfigurasjoner i 1923. Pauli utvidet Bohrs skjema til å bruke fire kvantetall , og formulerte sitt eksklusjonsprinsipp som sa at ingen to elektroner kunne ha de samme fire kvantetallene. Dette forklarte lengden på periodene i det periodiske systemet (2, 8, 18 og 32), som tilsvarte antallet elektroner som hvert skall kunne okkupere. I 1925 ankom Friedrich Hund konfigurasjoner nær de moderne. Aufbau - prinsippet som beskriver elektronkonfigurasjonene til elementene ble først empirisk observert av Erwin Madelung i 1926 og publisert i 1936.
Da hadde mengden av manglende elementer fra hydrogen til uran krympet til fire: grunnstoffene 43, 61, 85 og 87 forble savnet. Grunnstoff 43 ble til slutt det første elementet som ble syntetisert kunstig via kjernefysiske reaksjoner i stedet for oppdaget i naturen. Det ble oppdaget i 1937 av de italienske kjemikerne Emilio Segrè og Carlo Perrier , som kalte oppdagelsen deres technetium , etter det greske ordet for "kunstig". Elementene 61 ( promethium ) og 85 ( astatin ) ble likeledes produsert kunstig; grunnstoff 87 ( francium ) ble det siste grunnstoffet som ble oppdaget i naturen, av den franske kjemikeren Marguerite Perey . Grunnstoffene utenfor uran ble også oppdaget kunstig, og startet med Edwin McMillan og Philip Abelsons oppdagelse av neptunium i 1940 (via bombardement av uran med nøytroner). Glenn T. Seaborg og teamet hans ved Lawrence Berkeley National Laboratory (LBNL) fortsatte å oppdage transuranelementer, med utgangspunkt i plutonium , og oppdaget at i motsetning til tidligere tankegang, var elementene fra aktinium og utover f-blokk-kongener av lantanidene i stedet for d- blokker overgangsmetaller. Bassett (1892), Werner (1905) og den franske ingeniøren Charles Janet (1928) hadde tidligere foreslått dette, men ideene deres fikk da ikke generell aksept. Seaborg kalte dem derfor aktinidene. Elementer opp til 101 ble syntetisert enten gjennom nøytron- eller alfa-partikkelbestråling, eller i kjernefysiske eksplosjoner i tilfellene 99 (einsteinium) og 100 (fermium).
En betydelig kontrovers oppsto med elementene 102 til 106 på 1960- og 1970-tallet, da det oppsto konkurranse mellom LBNL-teamet (nå ledet av Albert Ghiorso ) og et team av sovjetiske forskere ved Joint Institute for Nuclear Research (JINR) ledet av Georgy Flyorov . Hvert team hevdet funn, og i noen tilfeller foreslo hvert sitt eget navn for elementet, og skapte en navnekontrovers som varte i flere tiår. Disse elementene ble laget ved bombardement av aktinider med lette ioner. IUPAC vedtok først en hands-off tilnærming, og foretrakk å vente og se om en konsensus ville komme. Dessverre var det også høydepunktet av den kalde krigen , og det ble klart etter en tid at dette ikke ville skje. Som sådan opprettet IUPAC og International Union of Pure and Applied Physics (IUPAP) en Transfermium Working Group (TWG, fermium er element 100) i 1985 for å angi kriterier for oppdagelse. Etter litt ytterligere kontrovers, fikk disse elementene sine endelige navn i 1997, inkludert seaborgium (106) til ære for Seaborg.
TWGs kriterier ble brukt til å dømme senere krav om elementfunn fra forskningsinstitutter i Tyskland ( GSI ), Russland (JINR) og Japan ( Riken ). For øyeblikket utføres vurdering av funnkrav av en IUPAC/IUPAP Joint Working Party . Etter at prioritet ble tildelt, ble elementene offisielt lagt til det periodiske systemet, og oppdagerne ble invitert til å foreslå navnene deres. I 2016 hadde dette skjedd for alle elementer opp til 118, og fullførte derfor det periodiske systemets første syv rader. Oppdagelsene av elementer utover 106 ble muliggjort av teknikker utviklet av Yuri Oganessian ved JINR: kald fusjon (bombardement av bly og vismut av tunge ioner) muliggjorde funnene 1981–2004 av elementene 107 til 112 ved GSI og 113 ved Riken, og han ledet JINR-teamet (i samarbeid med amerikanske forskere) for å oppdage elementene 114 til 118 ved bruk av varm fusjon (bombardement av aktinider med kalsiumioner) i 1998–2010. Det tyngste kjente elementet, oganesson (118), er navngitt til hans ære. Element 114 heter flerovium til ære for sin forgjenger og mentor Flyorov.
For å feire det periodiske systemets 150-årsjubileum, erklærte FN året 2019 som det internasjonale året for det periodiske system, og feiret "en av de mest betydningsfulle prestasjonene innen vitenskap". I dag er det periodiske systemet blant de mest gjenkjennelige ikonene innen kjemi. IUPAC er i dag involvert i mange prosesser knyttet til det periodiske systemet: gjenkjennelse og navngivning av nye grunnstoffer, anbefale gruppenummer og samlenavn, bestemme hvilke grunnstoffer som tilhører gruppe 3, og oppdatering av atomvekter.
Aktuelle spørsmål
Selv om det moderne periodiske system er standard i dag, kan en viss variasjon finnes i periode 1 og gruppe 3. Det pågår diskusjon om plassering av de aktuelle elementene. Kontroversen har å gjøre med motstridende forståelser av hvorvidt kjemiske eller elektroniske egenskaper først og fremst skal avgjøre periodisk tabellplassering, og motstridende syn på hvordan bevisene skal brukes. Et lignende potensielt problem har blitt reist av teoretiske undersøkelser av de supertunge elementene, hvis kjemi kanskje ikke passer til deres nåværende posisjon på det periodiske systemet.
Periode 1
Vanligvis plasseres hydrogen i gruppe 1, og helium i gruppe 18: dette er plasseringen som finnes på IUPACs periodiske system. Noen variasjoner kan finnes på begge disse sakene.
I likhet med gruppe 1-metallene har hydrogen ett elektron i sitt ytterste skall og mister vanligvis sitt eneste elektron i kjemiske reaksjoner. Det har noen metalllignende kjemiske egenskaper, og er i stand til å fortrenge noen metaller fra deres salter . Men hydrogen danner en diatomisk ikke-metallisk gass ved standardforhold, i motsetning til alkalimetallene som er reaktive faste metaller. Dette og hydrogens dannelse av hydrider , der det får et elektron, bringer det nær egenskapene til halogenene som gjør det samme. Dessuten er de letteste to halogenene ( fluor og klor ) gassformige som hydrogen ved standardforhold. Hydrogen har altså egenskaper som tilsvarer både alkalimetallene og halogenene, men matcher ingen av gruppene perfekt, og er derfor vanskelig å plassere med sin kjemi. Derfor, mens den elektroniske plasseringen av hydrogen i gruppe 1 dominerer, viser noen sjeldnere arrangementer enten hydrogen i gruppe 17, dupliserer hydrogen i både gruppe 1 og 17, eller flyter det separat fra alle grupper.
Helium er en ureaktiv edelgass ved standardforhold, og har et fullt ytre skall: disse egenskapene er som edelgassene i gruppe 18, men slett ikke som de reaktive jordalkalimetallene i gruppe 2. Derfor er helium nesten universelt plassert i gruppe 18 som dens egenskaper matcher best. Helium har imidlertid bare to ytre elektroner i sitt ytre skall, mens de andre edelgassene har åtte; og det er et s-blokkelement, mens alle andre edelgasser er p-blokkelementer. Også fast helium krystalliserer i en sekskantet tettpakket struktur, som matcher beryllium og magnesium i gruppe 2, men ikke de andre edelgassene i gruppe 18. På disse måtene matcher helium bedre jordalkalimetallene. Derfor vil tabeller med både hydrogen og helium flytende utenfor alle grupper sjelden bli påtruffet. Noen få kjemikere har tatt til orde for at den elektroniske plasseringen i gruppe 2 tas i bruk for helium. Argumenter for dette hviler ofte på førsterads anomali-trenden, da helium som det første s 2 - elementet før jordalkalimetallene skiller seg ut som anomalt på en måte som helium som den første edelgassen ikke gjør.
Gruppe 3
Publiserte periodiske tabeller viser variasjon angående de tyngre medlemmene av gruppe 3, som begynner med skandium og yttrium. De er oftest lantan og aktinium, men det er mange fysiske og kjemiske argumenter for at de i stedet bør være lutetium og lawrencium. Noen ganger kan man også finne et kompromiss, der mellomrommene under yttrium er tomme. Dette gjør det tvetydig om gruppen bare inneholder skandium og yttrium, eller om den også strekker seg til å omfatte alle tretti lantanider og aktinider.
Lantan ble opprinnelig plassert som det første av 5d-elementene da konfigurasjonen ([Xe]5d 1 6s 2 ) la til et d-elektron til det foregående elementet, barium ([Xe]6s 2 ). Dette gjorde det til det tredje medlemmet av gruppe 3, med cerium til lutetium som deretter fulgte som f-blokken, som deretter delte d-blokken i to. I mellomtiden, basert på konfigurasjonene kjent på den tiden, ble det antatt at lutetium ([Xe]4f 14 5d 1 6s 2 ) la det endelige 4f-elektronet til ytterbiums konfigurasjon (da antatt å være [Xe]4f 13 5d 1 6s 2 ) . Dermed ble d-blokken delt i to: etter at lantan fylte det første d-elektronet, fulgte cerium til lutetium som f-blokken, før d-blokken gjenopptok med hafnium gjennom kvikksølv.
Men i 1937 ble det funnet at konfigurasjonen av ytterbium hadde blitt bestemt feilaktig, og faktisk var [Xe]4f 14 6s 2 . Det betydde at 4f-underskallet fullførte fyllingen ved ytterbium i stedet for ved lutetium, som tidligere antatt. Som sådan påpekte de sovjetiske fysikerne Lev Landau og Evgeny Lifshitz i 1948 i deres Course of Theoretical Physics at de nye konfigurasjonene antydet at det første 5d-elementet var lutetium og ikke lantan. Dette unngår d-blokkens splittelse ved å la f-blokken (nå lantan gjennom ytterbium) gå foran d-blokken (lutetium gjennom kvikksølv) i henhold til Aufbau-prinsippet. En slik plassering hadde tidligere blitt tatt i bruk av Werner i 1905 (selv om lutetium ennå ikke var oppdaget) og av Janet i 1928. Den tidlige opptredenen av et d-elektron i lantan kunne da ganske enkelt betraktes som et annet tilfelle av en unormal konfigurasjon; som støtter dette argumentet, har flertallet av lantanidene og aktinidene en f x s 2 - konfigurasjon i stedet for en f x −1 d 1 s 2 en i grunntilstanden, som man ville forvente hvis f-blokken begynte ved lantan og dens konfigurasjon var bare et unntak fra hovedregelen. Flere fysikere og kjemikere i de påfølgende tiårene støttet denne omfordelingen basert på andre fysiske og kjemiske egenskaper til de involverte elementene, selv om dette beviset på sin side har blitt kritisert for å ha blitt selektivt valgt. De fleste forfattere gjorde ikke endringen.
I 1988 ble det publisert en IUPAC-rapport som berørte saken. Mens den skrev at elektronkonfigurasjoner var for den nye tilordningen av gruppe 3 med lutetium og lawrencium, bestemte den seg i stedet for et kompromiss der de nedre flekkene i gruppe 3 i stedet ble stående tomme, fordi den tradisjonelle formen med lantan og aktinium forble populær. Dette ligner på Brauners asteroidehypotese fra 1902; den får f-blokken til å fremstå med 15 elementer til tross for at kvantemekanikken tilsier at den skal ha 14, og lar det være uklart om gruppe 3 bare inneholder skandium og yttrium, eller om den inneholder alle lantanider og aktinider i tillegg.
IUPAC-kompromisset stoppet ikke debatten. De fleste kilder som fokuserer på spørsmålet støttet omfordelingen, men noen forfattere argumenterte i stedet for den tradisjonelle formen med lantan som det første 5d-elementet, noe som noen ganger ga opphav til rasende debatt. Et mindretall av lærebøkene godtok omfordelingen, men de fleste viste enten den eldre formen eller IUPAC-kompromisset.
I 2015 startet IUPAC et prosjekt for å bestemme om lantan eller lutetium skulle gå i gruppe 3, ledet av Eric Scerri , en kjemiker og vitenskapsfilosof av maltesisk opprinnelse. Den anså spørsmålet for å være "av betydelig betydning" for kjemikere, fysikere og studenter, og la merke til at variasjonen i publiserte periodiske tabeller på dette punktet vanligvis forvirret studenter og instruktører. En foreløpig rapport dukket opp fra den i 2021, som gikk inn for lutetium som det første 5d-elementet. Årsakene som ble gitt var å vise alle elementene i rekkefølge etter økende atomnummer, unngå d-blokkdelingen, og å la blokkene følge breddene som kvantemekanikken krever av dem (2, 6, 10 og 14). Prosjektet ble avsluttet samme år. Foreløpig viser IUPACs nettsted på det periodiske systemet fortsatt kompromisset fra 1988, men nevner gruppe 3-problemet og prosjektet for å løse det, og skriver "Stay tune[d]".
Supertunge elementer
Selv om alle grunnstoffene opp til oganesson (element 118) er oppdaget, er ikke kjemien til elementene utover hassium (element 108) godt forstått. Av disse er bare copernicium (grunnstoff 112), nihonium (element 113) og flerovium (element 114) blitt eksperimentelt undersøkt; disse undersøkelsene har så langt ikke gitt avgjørende resultater.
Noen av elementene forbi hassium kan oppføre seg annerledes enn det som ville bli spådd ved ekstrapolering, på grunn av relativistiske effekter. For eksempel vil ekstrapolering antyde at copernicium og flerovium oppfører seg som metaller, som deres respektive lettere congener kvikksølv og bly. Noen spådommer som tar i betraktning relativistiske effekter stemmer overens, men andre slike spådommer forventer at de muligens vil vise noen edelgasslignende egenskaper, selv om ingen av dem er plassert i gruppe 18 med de andre edelgassene. De nåværende eksperimentelle bevisene lar fortsatt spørsmålet stå åpent. Oganesson (element 118) har blitt spådd å være en solid halvleder ved standardforhold, lik silisium i gruppe 14, til tross for at han er i gruppe 18; ingen eksperimenter har blitt gjort for å bekrefte eller avkrefte denne spådommen.
Noen forskere har hevdet at dersom disse supertunge elementene virkelig har andre egenskaper enn deres plassering på det periodiske systemet antyder, bør det periodiske systemet endres for å plassere dem med mer kjemisk like elementer. På den annen side har andre hevdet at det periodiske systemet bør reflektere atomstruktur i stedet for kjemiske egenskaper, og motsette seg en slik endring.
Fremtidig forlengelse utover den syvende perioden

De sist navngitte grunnstoffene - nihonium (113), moscovium (115), tennessine (117) og oganesson (118) - fullførte den syvende raden i det periodiske systemet. Fremtidige elementer må begynne på en åttende rad . Disse elementene kan refereres til enten ved deres atomnumre (f.eks. "element 119"), eller ved IUPACs systematiske elementnavn som er direkte relatert til atomnumrene (f.eks. "ununnium" for element 119, avledet fra latin unus "one", gresk ennea "ni", og det tradisjonelle -ium - suffikset for metalliske elementer). Alle forsøk på å syntetisere slike elementer har mislyktes så langt. Et forsøk på å lage element 119 har pågått siden 2018 ved forskningsinstituttet Riken i Japan. Joint Institute for Nuclear Research i Russland planlegger også å gjøre sine egne forsøk på å syntetisere de første periodene 8-elementene.
For øyeblikket fortsetter diskusjonen om denne fremtidige åttende perioden skal følge mønsteret satt av de tidligere periodene eller ikke, da beregninger forutsier at på dette tidspunktet skulle relativistiske effekter resultere i betydelige avvik fra Madelung-regelen. Ulike forskjellige modeller har blitt foreslått. Alle er enige om at den åttende perioden bør begynne som de forrige med to 8s-elementer, og at det deretter bør følge en ny serie g-blokkelementer som fyller opp 5g-orbitalene, men de nøyaktige konfigurasjonene beregnet for disse 5g-elementene varierer mye mellom kildene . Utover denne 5g-serien stemmer ikke beregningene over nøyaktig hva som skal følge. Fylling av 5g, 6f, 7d og 8p skjellene forventes å skje i omtrent den rekkefølgen, men de er sannsynligvis blandet med hverandre og med 9s og 9p subshellene, slik at det ikke er klart hvilke elementer som skal gå inn hvilke grupper lenger. Scerri har reist spørsmålet om et utvidet periodisk system bør ta hensyn til feilen i Madelung-regelen i denne regionen, eller om slike unntak bør ignoreres. Skallstrukturen kan også være ganske formell på dette tidspunktet: allerede elektronfordelingen i et oganesson-atom forventes å være ganske jevn, uten noen synlig skallstruktur.
Kjernefysisk stabilitet vil sannsynligvis vise seg å være en avgjørende faktor som begrenser antallet mulige elementer. Det avhenger av balansen mellom den elektriske frastøtingen mellom protoner og den sterke kraften som binder protoner og nøytroner sammen. Protoner og nøytroner er ordnet i skall , akkurat som elektroner, og derfor kan et lukket skall øke stabiliteten betydelig: de kjente supertunge kjernene eksisterer på grunn av en slik skalllukking. De er sannsynligvis nær en forutsagt øy av stabilitet , der supertunge nuklider bør ha betydelig lengre halveringstid: spådommer varierer fra minutter eller dager, til millioner eller milliarder av år. Imidlertid, ettersom antallet protoner øker utover omtrent 126, bør denne stabiliserende effekten forsvinne når et lukket skall passerer. Det er ikke klart om det eksisterer noen skallstenginger lenger ut, på grunn av en forventet utsmøring av distinkte kjernefysiske skjell (som allerede er forventet for elektronskjellene ved oganesson). Videre, selv om senere skjellstenginger eksisterer, er det ikke klart om de ville tillate slike tunge elementer å eksistere. Alternativt kan kvarkstoff bli stabilt ved høye massetall, der kjernen er sammensatt av fritt flytende opp og ned kvarker i stedet for å binde dem til protoner og nøytroner; dette ville skape et kontinent med stabilitet i stedet for en øy. Andre effekter kan spille inn: for eksempel i svært tunge grunnstoffer vil 1s-elektronene sannsynligvis tilbringe en betydelig mengde tid så nær kjernen at de faktisk er inne i den, noe som vil gjøre dem sårbare for elektronfangst .
Selv om elementer i åttende rad kan eksistere, vil det sannsynligvis være vanskelig å produsere dem, og det bør bli enda vanskeligere når atomnummeret stiger. Selv om 8s-elementene forventes å være tilgjengelige med nåværende midler, forventes de første 5g-elementene å kreve ny teknologi, hvis de i det hele tatt kan produseres. Eksperimentell karakterisering av disse elementene kjemisk ville også utgjøre en stor utfordring.
Alternative periodiske tabeller

Den periodiske loven kan representeres på flere måter, hvorav standard periodisk system bare er én. Innen 100 år etter at Mendeleevs bord dukket opp i 1869, hadde Edward G. Mazurs samlet anslagsvis 700 forskjellige publiserte versjoner av det periodiske systemet. Mange former beholder den rektangulære strukturen, inkludert Janets venstre-trinns periodiske system (bildet nedenfor), og den moderniserte formen til Mendeleevs originale 8-kolonne layout som fortsatt er vanlig i Russland. Andre periodiske tabellformater har blitt formet mye mer eksotisk, for eksempel spiraler ( Otto Theodor Benfeys avbildet til høyre), sirkler, trekanter og til og med elefanter.
Alternative periodiske tabeller er ofte utviklet for å fremheve eller fremheve kjemiske eller fysiske egenskaper ved elementene som ikke er like tydelige i tradisjonelle periodiske tabeller, med forskjellige skjev mer mot å vektlegge kjemi eller fysikk i hver ende. Standardformen, som fortsatt er den mest vanlige, er et sted i midten.
De mange forskjellige formene for det periodiske system har stilt spørsmålene om det finnes en optimal eller definitiv form for det periodiske system, og i så fall hva det kan være. Det er ingen nåværende konsensussvar på noen av spørsmålene, selv om flere former har blitt foreslått som optimale.
| f 1 | f 2 | f 3 | f 4 | f 5 | f 6 | f 7 | f 8 | f 9 | f 10 | f 11 | f 12 | f 13 | f 14 | d 1 | d 2 | d 3 | d 4 | d 5 | d 6 | d 7 | d 8 | d 9 | d 10 | s 1 | s 2 | s 3 | s 4 | s 5 | s 6 | s 1 | s 2 | |
| 1s | H | Han | ||||||||||||||||||||||||||||||
| 2s | Li | Være | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3 s 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4 s 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Som | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5 s 6s | Y | Zr | NB | Mo | Tc | Ru | Rh | Pd | Ag | Cd | I | Sn | Sb | Te | Jeg | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | På | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Er | Cm | Bk | Jfr | Es | Fm | Md | Nei | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | 119 | 120 |
| f-blokk | d-blokk | p-blokk | s-blokk | |||||||||||||||||||||||||||||
Notater
Referanser
Bibliografi
- Greenwood, Norman N. ; Earnshaw, Alan (1997). Kjemi av grunnstoffene (2. utgave). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Generell kjemi: prinsipper og moderne anvendelser (8. utgave). Upper Saddle River, NJ: Prentice Hall. ISBN 978-0-13-014329-7. LCCN 2001032331 . OCLC 46872308 .
- Eric Scerri . 2020, The Periodic Table, Its Story and Its Significance , 2. utgave, Oxford University Press, New York, ISBN 978-0190914363 .
Videre lesning
- Calvo, Miguel (2019). Construyendo la Tabla Periódica . Zaragoza, Spania: Prames. s. 407. ISBN 978-84-8321-908-9.
- Emsley, J. (2011). "Det periodiske system". Nature's Building Blocks: An A–Z Guide to the Elements (Ny utgave). Oxford: Oxford University Press. s. 634–651. ISBN 978-0-19-960563-7.
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia (2007). De tapte grunnstoffene: Det periodiske systems skyggeside . Oxford: Oxford University Press. s. 508. ISBN 978-0-19-938334-4.
- Mazurs, EG (1974). Grafiske representasjoner av det periodiske systemet i løpet av hundre år . Alabama: University of Alabama Press. ISBN 978-0-19-960563-7.
- Rouvray, DH; King, RB, red. (2004). Det periodiske system: Inn i det 21. århundre . Proceedings of the 2nd International Conference on the Periodic Table, del 1, Kananaskis Guest Ranch, Alberta, 14.–20. juli 2003. Baldock, Hertfordshire: Research Studies Press. ISBN 978-0-86380-292-8.
- Rouvray, DH; King, RB, red. (2006). Matematikken i det periodiske system . Proceedings of the 2nd International Conference on the Periodic Table, del 2, Kananaskis Guest Ranch, Alberta, 14.–20. juli 2003. New York: Nova Science. ISBN 978-1-59454-259-6.
- Scerri, E (nd). "Bøker om grunnstoffene og det periodiske system" (PDF) . Arkivert (PDF) fra originalen 11. august 2020 . Hentet 9. juli 2018 .
- Scerri, E.; Restrepo, G, red. (2018). Mendeleev til Oganesson: Et tverrfaglig perspektiv på det periodiske systemet . Proceedings of the 3rd International Conference on the Periodic Table, Cuzco, Peru 14.–16. august 2012. Oxford: Oxford University Press. ISBN 978-0-86380-292-8.
- van Spronsen, JW (1969). Det periodiske systemet av kjemiske elementer: en historie om de første hundre årene . Amsterdam: Elsevier. ISBN 978-0-444-40776-4.
- Verde, M., red. (1971). Atti del convegno Mendeleeviano: Periodicità e simmetrie nella struttura elementare della materia [ Proceedings of the Mendeleevian conference: Periodicity and symmetrie in the elementary structure of matter ]. 1. internasjonale konferanse om det periodiske system, Torino-Roma, 15.–21. september 1969. Torino: Accademia delle Scienze di Torino.
Eksterne linker
- Periodic Table omtalte emneside på Science History Institute Digital Collections med utvalgte visuelle representasjoner av det periodiske systemet for elementene, med vekt på alternative layouter inkludert sirkulære, sylindriske, pyramideformede, spiralformede og trekantede former.
- IUPACs periodiske system for grunnstoffene
- Dynamisk periodisk system , med interaktive oppsett
- Eric Scerri , ledende vitenskapsfilosof som spesialiserer seg på historien og filosofien til det periodiske system
- Internett-databasen med periodiske tabeller
- Periodisk system over utrydningstruede grunnstoffer
- Periodisk system med prøver
- Periodisk system for videoer
- WebElements