Porphyria cutanea tarda - Porphyria cutanea tarda
| Porphyria cutanea tarda | |
|---|---|
| Andre navn | PCT |
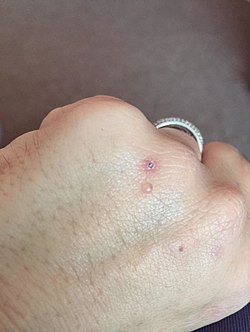 | |
| Blister på hånden til en person med porphyria cutanea tarda | |
| Spesialitet |
Endokrinologi |
Porphyria cutanea tarda er den vanligste undertypen av porfyri . Sykdommen er navngitt fordi den er en porfyri som ofte viser seg med hudmanifestasjoner senere i livet. Lidelsen skyldes lave nivåer av enzymet som er ansvarlig for det femte trinnet i hemproduksjon . Heme er et viktig molekyl for alle kroppens organer. Det er en komponent i hemoglobin , molekylet som transporterer oksygen i blodet.
Hepatoerythropoietic porfyri har blitt beskrevet som en homozygot form av porphyria cutanea tarda, selv om det også kan være forårsaket hvis to forskjellige mutasjoner oppstår på samme sted.
Symptomer
Porphyria cutanea tarda (PCT) er anerkjent som den mest utbredte undertypen av porfyriske sykdommer.
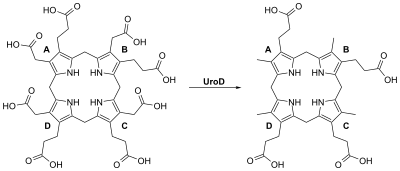
PCT er preget av onykolyse og blemmer i huden i områder som mottar høyere eksponering for sollys. Hovedårsaken er mangel på uroporphyrinogen decarboxylase (UROD), et cytosolisk enzym som er et trinn i den enzymatiske banen som fører til syntese av hem. Bak den direkte årsaken er det en rekke genetiske og miljømessige risikofaktorer.
Pasienter som er diagnostisert med PCT søker vanligvis behandling etter utvikling av lysfølsomhet som forårsaker blemmer og erosjoner på utsatte hudområder . Dette observeres vanligvis i ansikt, hender, underarmer og underben. Helbredelsen er langsom og etterlater arrdannelse . Selv om blemmer er de vanligste hudmanifestasjonene av PCT, forekommer andre hudmanifestasjoner hyperpigmentering (ligner en brunfarge) og hypertrichose (hovedsakelig på kinnene) forekommer også. PCT er en kronisk tilstand, med ytre symptomer som ofte avtar og gjentar seg som følge av flere faktorer. I tillegg til hudlesjonene er kronisk leversykdom svært vanlig hos pasienter med sporadisk PCT. Dette innebærer leverfibrose (arrdannelse i leveren) og betennelse . Imidlertid leverproblemer er mindre vanlig hos pasienter med arvelig formen av sykdommen . I tillegg vil pasienter ofte annullere en vinrød urin med økt konsentrasjon av uroporfyrin I på grunn av deres enzymatiske mangel.
Vitamin-, mineral- og enzymmangel
Visse vitamin- og mineralmangler er vanlige hos personer med porfyri cutanea tarda. De vanligste manglene er beta-karoten , retinol, vitamin A og vitamin C. Betakaroten er nødvendig for å syntetisere vitamin A og vitamin A er nødvendig for å syntetisere retinol. Mangel på retinolbindende protein skyldes mangel på retinol som er nødvendig for å utløse produksjonen.
Porfyriner interagerer med jern, absorberende fotoner for å lage reaktive oksygenarter er virkningsmekanismen som forårsaker kløende, smertefulle blemmer av PCT. De reaktive oksygenartene bruker hudens antioksidanter beta-karoten, vitamin E og vitamin C. Tilskudd av disse tre vitaminene reduserer oksidasjonen og reduserer potensielt alvorlighetsgraden av blæredannelse. Ingen av de tre vitaminene kan hemme de skadelige effektene av oksiderte porfyriner, spesielt uroporfyriner og koproporfyriner, men alle tre som jobber sammen synergistisk er i stand til å nøytralisere deres skadelige effekter.
Genetikk

Arvelige mutasjoner i UROD -genet forårsaker omtrent 20% av tilfellene (de andre 80% av tilfellene har ikke mutasjoner i UROD, og er klassifisert som sporadiske). UROD lager et enzym kalt uroporphyrinogen III decarboxylase , som er kritisk for den kjemiske prosessen som fører til hemproduksjon. Aktiviteten til dette enzymet reduseres vanligvis med 50% i alle vev hos mennesker med den arvelige formen for tilstanden.
Ugenetiske faktorer som for mye jern eller delvis genetiske faktorer som alkoholforstyrrelse og andre som er nevnt ovenfor, kan øke etterspørselen etter hem og enzymene som kreves for å lage hem. Kombinasjonen av denne økte etterspørselen og reduserte aktiviteten til uroporphyrinogen decarboxylase forstyrrer hemproduksjonen og lar biprodukter av prosessen samle seg i kroppen, og utløser tegn og symptomer på porphyria cutanea tarda.
Den HFE -genet gjør et protein som hjelper cellene regulere absorpsjonen av jern fra fordøyelseskanalen og inn i cellene i kroppen. Enkelte mutasjoner i HFE -genet forårsaker hemokromatose (en jernoverbelastningsforstyrrelse ). Personer som har disse mutasjonene har også en økt risiko for å utvikle porfyri cutanea tarda.
I de 20% av tilfellene hvor porfyri cutanea tarda arves, arves det i et autosomalt dominerende mønster, noe som betyr at en kopi av det endrede genet er tilstrekkelig til å redusere enzymaktivitet og forårsake tegn og symptomer på lidelsen.
Annen
Selv om arvelige mangler i uroporfyrinogen dekarboksylase ofte fører til utvikling av PCT, er det en rekke risikofaktorer som både kan forårsake og forverre symptomene på denne sykdommen. En av de vanligste risikofaktorene som er observert er infeksjon med hepatitt C -virus. En gjennomgang av en samling PCT -studier noterte hepatitt C -infeksjon i 50% av dokumenterte tilfeller av PCT. Ytterligere risikofaktorer inkluderer alkoholforstyrrelse, overflødig jern (fra jerntilskudd samt matlaging på skillet i støpejern) og eksponering for klorerte sykliske hydrokarboner og Agent Orange .
Det kan være et paraneoplastisk fenomen .
Forverrende faktorer
- Alkohol
- Østrogen
- Jern
- Hepatitt C -virus
Patogenese
Porphyria cutanea tarda er hovedsakelig forårsaket av uroporphyrinogen decarboxylase -mangel (UROD). Uroporfyrinogen dekarboksylase forekommer i naturen som en homodimer av to underenheter. Den deltar i det femte trinnet i hem -syntesebanen, og er aktiv i cytosolen. Denne enzymatiske omdannelsen resulterer i koproporfyrinogen III som hovedprodukt. Dette oppnås ved å fjerne de fire karboksylgruppene som er tilstede i det sykliske uroporfyrinogen III -molekylet med urviseren. Derfor er en mangel på dette enzymet fører til den ovennevnte oppbygging av uroporfyrinogen og hepta-karboksylsyre porphyrinogen , og i mindre grad heksa-karboksylsyre porphyrinogen, og penta-karboksylsyre porphyrinogen i urinen, noe som kan være nyttig i diagnosen av denne lidelse.
De dermatologiske symptomene på PCT som inkluderer blemmer og lesjoner på soleksponerte områder av huden er forårsaket av opphopning av porfyrinforbindelser (spesielt uroporfyrinogen) nær hudoverflaten som har blitt oksidert av frie radikaler eller sollys. De oksiderte porfyrinene starter degranulering av dermale mastceller , som frigjør proteaser som kataboliserer de omkringliggende proteinene. Dette starter en cellemediert positiv tilbakemeldingssløyfe som samsvarer med beskrivelsen av en forsinket overfølsomhetsreaksjon av type 4 . De resulterende blærene vises derfor ikke umiddelbart, men begynner å dukke opp 2-3 dager etter sollys. På grunn av den sterkt konjugerte strukturen til porfyriner som involverer alternerende enkelt- og doble karbonbindinger, viser disse forbindelsene en dyp lilla farge, noe som resulterer i misfarging observert i huden. Overdreven alkoholinntak reduserer hepcidinproduksjonen , noe som fører til økt jernabsorpsjon fra tarmen og en økning i oksidativt stress. Dette oksidative stresset fører da til inhibering av uroporphyrinogen decarboxylase, og skaper et overskudd av uroporphyrinogen III som oksideres fra de relativt ufarlige porfyrinogenene til deres oksiderte porfyrinerform. Konsentrerte tilfeller av oksidativt stress (alkohol, fysisk traume, psykologisk stress, etc.) får leveren til å bløde disse porfyrinene inn i blodstrømmen der de deretter er utsatt for oksidasjon.
Den sterke forbindelsen mellom PCT og hepatitt C -virusinfeksjon er ikke helt forstått. Studier har antydet at den cytopatiske effekten av viruset på hepatocytter kan føre til frigjøring av fritt jern. Dette jernet kan forstyrre aktiviteten til cytokrom p450 og frigjøre aktiverte oksygenarter. Disse kan oksidere UROD -substratet uroporphyrinogen, noe som kan resultere i inhibering av UROD og føre til mangelfull aktivitet av dette nøkkelenzymet.
Overdreven bruk av alkohol er ofte forbundet med både indusering av PCT og forverring av en allerede eksisterende diagnose av lidelsen. Det antas å gjøre det ved å forårsake oksidativ skade på leverceller, noe som resulterer i oksidert art av uroporfyrinogen som hemmer aktiviteten til hepatisk UROD. Det føles også å øke opptaket av jern i leverceller, noe som fører til ytterligere oksidasjon av uroporfyrinogen ved frigjøring av aktiverte oksygenarter. I tillegg kan eksponering for klorerte sykliske hydrokarboner føre til mangel på aktivitet av uroporfyrinogen dekarboksylase, noe som forårsaker oppbygging av overflødig uroporfyrinogen. I tillegg har alkohol vist seg å øke aktiviteten til delta-aminolevulinsyresyntetase (ALA-syntetase), det hastighetsbegrensende enzymatiske trinnet i hem-syntese i mitokondriene, hos rotter. Derfor kan alkoholforbruk øke produksjonen av uroporfyrinogen, noe som forverrer symptomene hos personer med porfyri cutanea tarda.
Diagnose
Selv om det vanligste symptomet på PCT er utseende av hudskader og blemmer, er utseendet deres ikke avgjørende. Laboratorietesting viser ofte høye nivåer av uroporfyrinogen i urinen, klinisk referert til som uroporfyrinogenuri. I tillegg er det sterkt foreslått å teste for vanlige risikofaktorer som hepatitt C og hemokromatose , da deres høye forekomst hos pasienter med PCT kan kreve ytterligere behandling. Hvis klinisk utseende av PCT er tilstede, men laboratorier er negative, bør diagnosen pseudoporfyri vurderes alvorlig.
Klassifisering
Noen kilder deler PCT inn i to typer: sporadisk og familiær. Andre kilder inkluderer en tredje type, men dette er mindre vanlig.
| Type | OMIM | Beskrivelse |
|---|---|---|
| Type I ("sporadisk") | 176090 | Type I porphyria cutanea tarda, den sporadiske formen, indikeres av UROD -mangel som bare observeres i leverceller og ingen andre steder i kroppen. Genetisk vil disse personene ikke vise mangel på UROD -genet, selv om andre genetiske faktorer som HFE -mangel (resulterer i hemokromatose og opphopning av jern i leveren) antas å spille en nøkkelrolle. Vanligvis forekommer en rekke risikofaktorer som alkoholforstyrrelse og hepatitt C-virusinfeksjon hos disse individer sammen for å resultere i den kliniske manifestasjonen av PCT. |
| Type II ("familiær") | 176100 | Pasienter som viser type II PCT har en spesifikk mangel på UROD -genet, gått ned i et autosomalt dominerende mønster. De som har denne mangelen er heterozygote for UROD -genet. De viser ikke fullstendig mangel på funksjonell uroporfyrinogen dekarboksylase, bare en mangelfull form av enzymet som er preget av redusert omdannelse av uroporfyrinogen til koproporfyrinogen. Derfor vil uttrykket av uroporfyrinogen dekarboksylase bli redusert i hele kroppen til disse individene, mens det er isolert til leveren hos pasienter av type I. Selv om denne genetiske mangelen er hovedforskjellen mellom type I og type II PCT, er risikofaktorene nevnt før ofte sett hos pasienter som har type II PCT. Faktisk går mange mennesker som har det mangelfulle UROD -genet ofte hele livet uten å ha en klinisk manifestasjon av PCT -symptomer. |
| Type III | - | Den minst vanlige er Type III, som ikke er forskjellig fra type I for så vidt pasientene har normale UROD -gener. Til tross for dette observeres type III PCT hos mer enn ett familiemedlem, noe som indikerer en genetisk komponent som ikke er relatert til uttrykket av uroporfyrinogen dekarboksylase. |
En studie brukte 74% som cutoff for UROD -aktivitet, der pasientene under dette nummeret ble klassifisert som type II, og de ovenfor klassifisert som type III hvis det var en familiehistorie, og type I hvis det ikke var det.
Genetiske varianter assosiert med hemokromatose har blitt observert hos PCT -pasienter, noe som kan bidra til å forklare arvet PCT som ikke er forbundet med UROD.
Behandling
Siden PCT er en kronisk tilstand, er en omfattende behandling av sykdommen det mest effektive behandlingsmiddelet. Primært er det viktig at pasienter diagnostisert med PCT unngår alkoholforbruk, jerntilskudd, overdreven eksponering for sollys (spesielt om sommeren), samt østrogen og klorerte sykliske hydrokarboner, som alle potensielt kan forverre lidelsen. I tillegg kan håndteringen av overflødig jern (på grunn av hemokromatose hos PCT -pasienter) oppnås gjennom flebotomi , hvorved blodet systematisk tømmes fra pasienten. En grenseoverskridende jernmangel har vist seg å ha en beskyttende effekt ved å begrense hem syntese. I fravær av jern, som skal inkorporeres i porfyrinet som dannes i det siste trinnet i syntesen, blir mRNA for erytroid 5-aminolevulinatsyntase (ALAS-2) blokkert ved binding av et jern-responsivt element (IRE) binding cytosolisk protein, og transkripsjon av dette nøkkelenzymet er hemmet.
Lave doser av malaria kan brukes. Oralt inntatt klorokin absorberes fullstendig i tarmen og er fortrinnsvis konsentrert i lever, milt og nyrer. De virker ved å fjerne overflødig porfyrin fra leveren ved å øke utskillelseshastigheten ved å danne et koordinasjonskompleks med porfyrinets jernsenter samt en intramolekylær hydrogenbinding mellom en propionat sidekjede i porfyrinet og det protonerte kinuklidin -nitrogenatomet til enten alkaloid . På grunn av tilstedeværelsen av kloratomet er hele komplekset mer vannløselig, slik at nyrene fortrinnsvis kan fjerne det fra blodstrømmen og kaste det ut ved vannlating. Klorokinbehandling kan forårsake porfyriangrep i løpet av de første par månedene av behandlingen på grunn av massemobilisering av porfyriner fra leveren til blodstrømmen. Fullstendig remisjon kan sees innen 6–12 måneder, da hver dose med malaria bare kan fjerne en begrenset mengde porfyriner og det vanligvis er tiår med akkumulering som skal fjernes. Opprinnelig ble høyere doser brukt til å behandle tilstanden, men er ikke lenger anbefalt på grunn av levertoksisitet. Til slutt, på grunn av den sterke forbindelsen mellom PCT og hepatitt C, er behandlingen av hepatitt C (hvis den er tilstede) avgjørende for effektiv behandling av PCT. Klorokin , hydroksyklorokin og veneseksjon brukes vanligvis i styringsstrategien.
Epidemiologi
PCT -prevalens er estimert til 1 av 10.000. Anslagsvis 80% av tilfellene av porfyri cutanea tarda er sporadiske. Den nøyaktige frekvensen er ikke klar fordi mange mennesker med tilstanden aldri opplever symptomer, og de som gjør det, blir ofte feildiagnostisert med alt fra idiopatisk fotodermatitt og sesongmessige allergier til elveblest .
Samfunn og kultur
Porphyria cutanea tarda er involvert i opprinnelsen til vampyrmyter. Dette er fordi mennesker med sykdommen har en tendens til å unngå sol på grunn av lysfølsomhet og kan utvikle misdannelse som spiser nesene, øyelokkene, leppene og tannkjøttet og gir tennene et fang-lignende utseende. Det har også blitt antydet at de kan ha utviklet et ønske om sunt blod for å erstatte sitt eget i en selvmedisinert behandling i tidligere århundrer.
Noen folklore -forskere hevder at dette er en feil, først antydet på 1990 -tallet, fordi mytevampyrer ikke hadde lysfølsomhet, og de ble heller ikke beskrevet som å se ut som den moderne inkarnasjonen av vampyrer. De ble beskrevet som uintelligente roamingvesener som matet seg på ofrene til det punktet at de ble røde og kraftig oppblåste, fet av blod. Fang ble svært sjelden nevnt. Fotosensitivitet ble ikke lagt til vampyrmytologien før filmen Nosferatu fra 1922 . Grev Dracula fra Bram Strokers roman kunne gå fritt rundt i dagslys uskadd, men ikke like kraftig i boken.
Porphyria cutanea tarda er navnet på en sang av rockebandet AFI på deres fjerde album Black Sails in the Sunset , utgitt 18. mai 1999.
Porfyri cutanea tarda er den sykdommen som både Dabney Pratt og Brother Rush lider i Virginia Hamilton 's barne roman Søt Whispers, Brother Rush .
Referanser
Eksterne linker
- Porphyria cutanea tarda ved NIHs kontor for sjeldne sykdommer
| Klassifisering | |
|---|---|
| Eksterne ressurser |