mRNA -vaksine - mRNA vaccine
En mRNA -vaksine er en type vaksine som bruker en kopi av et molekyl som kalles messenger RNA (mRNA) for å produsere en immunrespons. Vaksinen leverer molekyler av antigen -kodende mRNA inn i immunceller , som bruker det designet mRNA som en mal for å bygge fremmed protein som normalt vil bli produsert av et patogen (for eksempel et virus ) eller av en kreftcelle . Disse proteinmolekylene stimulerer en adaptiv immunrespons som lærer kroppen å identifisere og ødelegge det tilsvarende patogenet eller kreftcellene. MRNA blir levertved en samformulering av RNA innkapslet i lipid-nanopartikler som beskytter RNA-trådene og hjelper dem med å absorbere dem inn i cellene.
Reaktogenisitet , en vaksines tendens til å produsere bivirkninger, er lik den for konvensjonelle ikke-RNA-vaksiner. Personer som er utsatt for en autoimmun respons kan ha en bivirkning på messenger -RNA -vaksiner. Fordelene med mRNA -vaksiner fremfor tradisjonelle vaksiner er enkel design, hastighet og lavere produksjonskostnader, induksjon av både cellulær og humoral immunitet og mangel på interaksjon med genomisk DNA . Mens noen messenger-RNA-vaksiner, for eksempel Pfizer-BioNTech COVID-19-vaksinen , har den ulempen at de krever ultrakold lagring før distribusjon, har ikke andre mRNA-vaksiner, som Moderna , CureVac og Walvax COVID-19 vaksiner , slike krav .
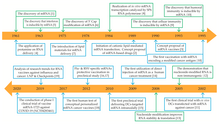
I RNA-terapi har messenger-RNA-vaksiner tiltrukket seg stor interesse som COVID-19-vaksiner . I desember 2020 fikk Pfizer-BioNTech og Moderna godkjenning for sine mRNA-baserte COVID-19-vaksiner. Desember ble UK Medicines and Healthcare products Regulatory Agency (MHRA) den første legemiddelregulatoren som godkjente en mRNA -vaksine, og godkjente Pfizer - BioNTech -vaksinen for utbredt bruk. 11. desember utstedte US Food and Drug Administration (FDA) en nødsituasjonsgodkjenning for Pfizer - BioNTech -vaksinen og godkjente en uke senere Moderna -vaksinen.
Historie
Tidlig forskning
Den første vellykkede transfeksjonen av mRNA pakket i en liposomal nanopartikkel inn i en celle ble publisert i 1989. "Naken" (eller ubeskyttet) mRNA ble injisert et år senere i musen til mus. Disse studiene var det første beviset på at in vitro transkriberte mRNA var i stand til å levere genetisk informasjon for å produsere proteiner i levende cellevev og førte til konseptforslaget om messenger -RNA -vaksiner.
Liposominnkapslet mRNA ble vist i 1993 for å stimulere T-celler i mus. Året etter ble selvforsterkende mRNA utviklet ved å inkludere både et viralt antigen og replikasekodende gen. Metoden ble brukt hos mus for å fremkalle både en humoral og cellulær immunrespons mot et viralt patogen. Det neste året ble mRNA som koder for et tumorantigen vist å fremkalle en lignende immunrespons mot kreftceller hos mus.
Utvikling
Den første humane kliniske studien med ex vivo dendritiske celler transfektert med mRNA som koder for tumorantigener ( terapeutisk kreft -mRNA -vaksine ) ble startet i 2001. Fire år senere ble vellykket bruk av modifiserte nukleosider som en metode for å transportere mRNA inne i celler uten å sette i gang kroppens forsvarssystemet ble rapportert. Resultater fra kliniske studier av en mRNA -vaksine direkte injisert i kroppen mot kreftceller ble rapportert i 2008.
BioNTech i 2008 og Moderna i 2010 ble grunnlagt for å utvikle mRNA bioteknologi. Det amerikanske forskningsbyrået DARPA lanserte på dette tidspunktet bioteknologisk forskningsprogram ADEPT for å utvikle nye teknologier for det amerikanske militæret . Byrået anerkjente potensialet til nukleinsyre -teknologi for forsvar mot pandemier og begynte å investere i feltet. DARPA -tilskudd ble sett på som en tillitserklæring som igjen oppmuntret andre offentlige etater og private investorer til å investere i mRNA -teknologi. DARPA tildelte den gang et tilskudd på 25 millioner dollar til Moderna.
De første kliniske forsøkene på mennesker med en mRNA -vaksine mot et smittestoff ( rabies ) begynte i 2013. I løpet av de neste årene ble det startet kliniske studier med mRNA -vaksiner for en rekke andre virus. mRNA -vaksiner for mennesker har blitt studert for smittsomme midler som influensa , Zika -virus , cytomegalovirus og Chikungunya -virus .
Akselerasjon
Den COVID-19-epidemien , og sekvensering av det forårsakende virus SARS-CoV-2 i begynnelsen av 2020, har ført til den raske utviklingen av de første godkjente mRNA vaksiner. BioNTech og Moderna i desember samme år fikk godkjenning for sine mRNA-baserte COVID-19-vaksiner . Desember, syv dager etter den siste åtte ukers prøveperioden, ble det britiske legemiddel- og helseproduktreguleringsorganet i Storbritannia den første globale legemiddelregulatoren i historien som godkjente en mRNA-vaksine, og ga nødhjelpstillatelse for Pfizer-BioNTechs BNT162b2 COVID-19-vaksine for utbredt bruk. Desember ga FDA godkjennelse for nødsituasjoner for Pfizer-BioNTech COVID-19-vaksinen og en uke senere lignende godkjenning for Moderna COVID-19-vaksinen .
Mekanisme

Målet med en vaksine er å stimulere det adaptive immunsystemet til å lage antistoffer som nøyaktig retter seg mot det aktuelle patogenet . Markørene på patogenet som antistoffene retter seg mot kalles antigener .
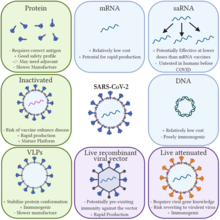
Tradisjonelle vaksiner stimulerer en antistoffrespons ved å injisere enten antigener , et svekket (svekket) virus, et inaktivert (dødt) virus eller en rekombinant antigen-kodende virusvektor (ufarlig bærervirus med et antigen- transgen ) i kroppen. Disse antigenene og virusene tilberedes og vokser utenfor kroppen.
Derimot introduserer mRNA-vaksiner et kortvarig syntetisk skapt fragment av RNA-sekvensen til et virus i individet som blir vaksinert. Disse mRNA -fragmentene tas opp av dendritiske celler gjennom fagocytose . De dendritiske cellene bruker sitt indre maskineri ( ribosomer ) til å lese mRNA og produsere virale antigener som mRNA koder. Kroppen degraderer mRNA -fragmentene i løpet av få dager etter introduksjonen. Selv om ikke-immunceller potensielt også kan absorbere vaksine-mRNA, produsere antigener og vise antigenene på overflatene, absorberer dendritiske celler mRNA-kulene mye lettere. MRNA -fragmentene blir oversatt i cytoplasma og påvirker ikke kroppens genomiske DNA, lokalisert separat i cellekjernen .
Når de virale antigenene er produsert av vertscellen, blir de normale adaptive immunsystemprosessene fulgt. Antigener brytes ned av proteasomer . Klasse I og klasse II MHC -molekyler fester seg deretter til antigenet og transporterer det til cellemembranen og "aktiverer" den dendritiske cellen. Når de er aktivert, migrerer dendritiske celler til lymfeknuter , hvor de presenterer antigenet for T -celler og B -celler . Dette utløser produksjonen av antistoffer spesifikt rettet mot antigenet, noe som til slutt resulterer i immunitet .
mRNA
Den sentrale komponenten i en mRNA -vaksine er dens mRNA -konstruksjon. Den in vitro- transkribert mRNA blir generert fra en konstruert plasmid -DNA, som har et RNA-polymerase-promoter og sekvensen som svarer til mRNA-konstruksjonen. Ved å kombinere T7 -fag -RNA -polymerase og plasmid -DNA, kan mRNA transkriberes i laboratoriet. Effekten av vaksinen er avhengig av stabiliteten og strukturen til det designede mRNA.
Den in vitro- transkribert mRNA har de samme konstruksjonsdeler som naturlig mRNA i eukaryote celler . Den har en 5'- hette , en 5'-oversatt region (UTR) og 3'-UTR , en åpen leseramme (ORF), som koder for det relevante antigenet, og en 3'-poly (A) hale . Ved å modifisere disse forskjellige komponentene i det syntetiske mRNA, kan stabiliteten og translasjonsevnen til mRNA forbedres, og igjen kan effekten av vaksinen forbedres.
MRNA kan forbedres ved å bruke syntetiske 5'-cap analoger som forbedrer stabiliteten og øker proteinoversettelsen. På samme måte kan regulatoriske elementer i 5'-oversatte regionen og 3'-oversatte regionen endres, og lengden på poly (A) halen optimaliseres for å stabilisere mRNA og øke proteinproduksjonen. MRNA- nukleotidene kan modifiseres for både å redusere medfødt immunaktivering og øke mRNAs halveringstid i vertscellen. Den nukleinsyresekvensen og kodonbruk virkninger proteintranslasjon. Berikning av sekvensen med guanin-cytosininnhold forbedrer mRNA-stabilitet og halveringstid og igjen proteinproduksjon. Erstatning av sjeldne kodoner med synonyme kodoner som ofte brukes av vertscellen, øker også proteinproduksjonen.
Leveranse
For en vaksine for å være vellykket, må tilstrekkelige mRNA gå inn i vertscellen cytoplasma til å stimulere produksjonen av de spesifikke antigener. Innføring av mRNA -molekyler står imidlertid overfor en rekke vanskeligheter. Ikke bare er mRNA -molekyler for store til å krysse cellemembranen ved enkel diffusjon , de er også negativt ladet som cellemembranen, noe som forårsaker en gjensidig elektrostatisk frastøtning . I tillegg nedbrytes mRNA lett av RNAaser i hud og blod.
Det er utviklet forskjellige metoder for å overvinne disse leveringshinder. Metoden for vaksineadministrasjon kan i stor grad klassifiseres etter om mRNA -overføring til celler skjer innenfor ( in vivo ) eller utenfor ( ex vivo ) organismen.
Ex vivo
Dendritiske celler viser antigener på overflatene , noe som fører til interaksjoner med T -celler for å starte en immunrespons. Dendritiske celler kan samles fra pasienter og programmeres med ønsket mRNA, og deretter administreres tilbake til pasienter for å skape en immunrespons.
Den enkleste måten som ex vivo dendritiske celler tar opp mRNA -molekyler er gjennom endocytose , en ganske ineffektiv vei i laboratoriemiljøet som kan forbedres betydelig gjennom elektroporering .
In vivo
Siden oppdagelsen av at direkte administrering av in vitro transkribert mRNA fører til uttrykk for antigener i kroppen, har in vivo tilnærminger blitt undersøkt. De tilbyr noen fordeler i forhold til ex vivo -metoder, spesielt ved å unngå kostnadene ved å høste og tilpasse dendritiske celler fra pasienter og etterligne en vanlig infeksjon.
Ulike injeksjonsveier , for eksempel i hud , blod eller muskler , resulterer i varierende nivåer av mRNA -opptak, noe som gjør valg av administrasjonsvei til et kritisk aspekt ved in vivo levering. En studie viste ved sammenligning av forskjellige ruter at injeksjon av lymfeknuter fører til den største T-celleresponsen.
Naken mRNA -injeksjon
Naken mRNA -injeksjon betyr at levering av vaksinen bare utføres i en bufferløsning . Denne opptaksmåten for mRNA har vært kjent siden 1990 -tallet. De første verdensomspennende kliniske studiene brukte intradermale injeksjoner av naken mRNA for vaksinasjon. En rekke metoder har blitt brukt for å levere naken mRNA, for eksempel subkutane, intravenøse og intratumorale injeksjoner. Selv om naken mRNA -levering forårsaker en immunrespons, er effekten relativt svak, og etter injeksjon blir mRNA ofte raskt degradert.
Polymer- og peptidvektorer
Kationiske polymerer kan blandes med mRNA for å generere beskyttende belegg som kalles polyplexer . Disse beskytter det rekombinante mRNA mot ribonukleaser og hjelper til med penetrering i celler. Protamin er et naturlig kationisk peptid og har blitt brukt til å innkapsle mRNA for vaksinasjon.
Lipid nanopartikkel vektor
Første gang FDA godkjente bruk av lipid -nanopartikler som et legemiddelleveringssystem var i 2018, da byrået godkjente det første siRNA -stoffet , Onpattro . Innkapsling av mRNA -molekylet i lipid -nanopartikler var et kritisk gjennombrudd for å produsere levedyktige mRNA -vaksiner, og løste en rekke viktige tekniske barrierer for å levere mRNA -molekylet til vertscellen. Forskning på bruk av lipider for å levere siRNA til celler ble et grunnlag for lignende forskning på bruk av lipider for å levere mRNA. Imidlertid måtte nye lipider oppfinnes for å kapsle mRNA -tråder, som er mye lengre enn siRNA -tråder.
Lipid gir hovedsakelig et lag med beskyttelse mot nedbrytning, noe som gir mer robust translasjonell utgang. I tillegg tillater tilpasningen av lipidets ytre lag målretting av ønskede celletyper gjennom ligandinteraksjoner . Imidlertid har mange studier også fremhevet vanskeligheten med å studere denne typen levering, og viser at det er en inkonsekvens mellom in vivo og in vitro -applikasjoner av nanopartikler når det gjelder mobilinntak. Nanopartiklene kan administreres til kroppen og transporteres via flere ruter, for eksempel intravenøst eller gjennom lymfesystemet .
Et problem med lipid -nanopartikler er at flere av gjennombruddene som fører til praktisk bruk av den teknologien, innebærer bruk av mikrofluidika . Mikrofluidiske reaksjonskamre er vanskelige å skalere, siden hele poenget med mikrofluidikk er å utnytte væskens mikroskalaoppførsel. Den eneste veien rundt dette hinderet er å kjøre et omfattende antall mikrofluidiske reaksjonskamre parallelt, en ny oppgave som krever spesialbygd utstyr. For mRNA-vaksiner mot COVID-19 var dette den viktigste flaskehalsen i produksjonen. Pfizer brukte en slik parallell tilnærming for å løse skaleringsproblemet. Etter å ha bekreftet at blandebatterier ikke direkte kunne skaleres opp, laget Pfizer omtrent 100 av de små mikserne (hver på størrelse med en amerikansk halvmynt ), koblet dem sammen med pumper og filtre med en "labyrint av rørledninger". og sette opp et datasystem for å regulere strømning og trykk gjennom mikserne.
Et annet problem, med stor bruk av denne leveringsmetoden, er tilgjengeligheten av de nye lipidene som brukes til å lage lipid-nanopartikler, spesielt ioniserbare kationiske lipider. Før 2020 ble slike lipider produsert i små mengder målt i gram eller kilo, og de ble brukt til medisinsk forskning og en håndfull medisiner for sjeldne tilstander. Ettersom sikkerheten og effekten av mRNA -vaksiner ble klar i slutten av 2020, ble de få selskapene som kunne produsere de nødvendige lipidene, konfrontert med utfordringen med å øke produksjonen for å svare på ordre om flere tonn lipider.
Viral vektor
I tillegg til ikke-virale leveringsmetoder har RNA-virus blitt konstruert for å oppnå lignende immunologiske responser. Typiske RNA -virus som brukes som vektorer inkluderer retrovirus , lentivirus , alfavirus og rabdovirus , som hver kan variere i struktur og funksjon. Kliniske studier har brukt slike virus på en rekke sykdommer hos modeldyr som mus , kylling og primater .
Fordeler
Tradisjonelle vaksiner
mRNA -vaksiner gir spesifikke fordeler i forhold til tradisjonelle vaksiner . Fordi mRNA-vaksiner ikke er konstruert fra et aktivt patogen (eller til og med et inaktivert patogen), er de ikke-smittsomme. I kontrast krever tradisjonelle vaksiner produksjon av patogener, som hvis de gjøres i store mengder, kan øke risikoen for lokaliserte utbrudd av viruset på produksjonsanlegget. En annen biologisk fordel med mRNA -vaksiner er at siden antigenene produseres inne i cellen, stimulerer de cellulær immunitet , så vel som humoral immunitet .
mRNA -vaksiner har produksjonsfordelen at de kan utformes raskt. Moderna designet sin mRNA-1273- vaksine for COVID-19 på 2 dager. De kan også produseres raskere, billigere og på en mer standardisert måte (med færre feilrater i produksjonen), noe som kan forbedre responsen på alvorlige utbrudd.
Pfizer - BioNTech -vaksinen krevde opprinnelig 110 dager å masseprodusere (før Pfizer begynte å optimalisere produksjonsprosessen til bare 60 dager), som var vesentlig raskere enn tradisjonelle influensa- og poliovaksiner. Innenfor den større tidsrammen er den faktiske produksjonstiden bare ca. 22 dager: to uker for molekylær kloning av DNA-plasmider og rensing av DNA, fire dager for DNA-til-RNA- transkripsjon og rensing av mRNA, og fire dager for å innkapse mRNA i lipid nanopartikler etterfulgt av fyll og finish . Flertallet av dagene som trengs for hvert produksjonsløp, er allokert til streng kvalitetskontroll i hvert trinn.
DNA -vaksiner
I tillegg til å dele fordelene med teoretiske DNA -vaksiner fremfor etablerte tradisjonelle vaksiner , har mRNA -vaksiner også flere fordeler i forhold til DNA -vaksiner. Den mRNA blir oversatt i det cytosolen , slik at det ikke er behov for RNA for å gå inn i cellekjernen , og risikoen for å bli integrert i vertsgenomet er avverget. Modifiserte nukleosider (for eksempel pseudouridiner , 2'-O-metylerte nukleosider) kan inkorporeres i mRNA for å undertrykke immunresponsstimulering for å unngå umiddelbar nedbrytning og gi en mer vedvarende effekt gjennom forbedret oversettelseskapasitet. Den åpne leserammen (ORF) og utranslaterte regioner (UTR) av mRNA kan optimaliseres for forskjellige formål (en prosess som kalles sekvensutvikling av mRNA), for eksempel gjennom å berike innholdet av guanin-cytosin eller velge spesifikke UTR som er kjent for å øke oversettelsen. En ytterligere ORF -koding for en replikasjonsmekanisme kan legges til for å forsterke antigenoversettelse og derfor immunrespons, noe som reduserer mengden utgangsmateriale som trengs.
Ulemper
Oppbevaring
Fordi mRNA er skjørt, må noen vaksiner oppbevares ved svært lave temperaturer for å unngå nedbrytning og dermed gi mottakeren liten effektiv immunitet. Pfizer - BioNTechs BNT162b2 mRNA -vaksine må oppbevares mellom −80 og −60 ° C (−112 og −76 ° F). Moderna sier at deres mRNA-1273- vaksine kan lagres mellom −25 og −15 ° C (−13 og 5 ° F), som kan sammenlignes med en hjemmefryser, og at den forblir stabil mellom 2 og 8 ° C (36 og 46) ° F) i opptil 30 dager. I november 2020 rapporterte Nature : "Selv om det er mulig at forskjeller i LNP -formuleringer eller mRNA -sekundære strukturer kan forklare termostabilitetsforskjellene [mellom Moderna og BioNtech], mistenker mange eksperter at begge vaksineproduktene til slutt vil vise seg å ha lignende lagringskrav og holdbarhet under forskjellige temperaturforhold. " Flere plattformer studeres som kan tillate lagring ved høyere temperaturer.
Nylig
Før 2020 hadde ingen mRNA -teknologiplattform (stoff eller vaksine) blitt godkjent for bruk hos mennesker, så det var fare for ukjente effekter. 2020-COVID-19-pandemien krevde raskere produksjonskapasitet for mRNA-vaksiner, gjorde dem attraktive for nasjonale helseorganisasjoner og førte til debatt om hvilken type innledende autorisasjon mRNA-vaksiner bør få (inkludert bruk for nødbruk eller utvidet tilgangstillatelse ) etter åtte- uke med post-endelige forsøk på mennesker.
Bivirkninger
Reaktogenisitet er lik den for konvensjonelle, ikke-RNA-vaksiner. Imidlertid kan de som er utsatt for en autoimmun respons ha en bivirkning på mRNA -vaksiner. MRNA -trådene i vaksinen kan fremkalle en utilsiktet immunreaksjon - dette innebærer at kroppen tror seg selv som syk, og at personen føler at de er som et resultat. For å minimere dette er mRNA -sekvenser i mRNA -vaksiner designet for å etterligne de som produseres av vertsceller.
Sterke, men forbigående reaktogene effekter ble rapportert i forsøk med nye COVID-19 mRNA-vaksiner; de fleste mennesker vil ikke oppleve alvorlige bivirkninger som inkluderer feber og tretthet. Alvorlige bivirkninger er definert som de som forhindrer daglig aktivitet.
Effekt
COVID-19 mRNA-vaksinene fra Moderna og Pfizer-BioNTech har effektrater på 90 til 95 prosent. Tidligere mRNA-medikamentforsøk på andre patogener enn COVID-19 var ikke effektive og måtte forlates i de tidlige fasene av forsøkene. Årsaken til effekten av de nye mRNA -vaksinene er ikke klar.
Lege-vitenskapsmann Margaret Liu uttalte at effekten av de nye COVID-19 mRNA-vaksinene kan skyldes det "store mengden ressurser" som ble utviklet, eller at vaksinene kan "utløse en uspesifikk inflammatorisk respons på mRNA som kan øke den spesifikke immunresponsen, gitt at den modifiserte nukleosidteknikken reduserte betennelse, men ikke har eliminert den helt ", og at" dette også kan forklare de intense reaksjonene som smerter og feber rapportert hos noen mottakere av mRNA SARS-CoV- 2 vaksiner ". Disse reaksjonene, selv om de var alvorlige, var forbigående og et annet syn er at de antas å være en reaksjon på lipidmedisinleveringsmolekylene.
Tøven
Det er feilinformasjon som antyder at mRNA -vaksiner kan endre DNA i kjernen. mRNA i cytosolen nedbrytes veldig raskt før det ville få tid til å komme inn i cellekjernen. (mRNA-vaksiner må lagres ved svært lav temperatur for å forhindre mRNA-nedbrytning.) Retrovirus kan være enkeltstrenget RNA (akkurat som SARS-CoV-2- vaksine er enkeltstrenget RNA) som kommer inn i cellekjernen og bruker revers transkriptase for å lage DNA fra RNA i cellekjernen. Et retrovirus har mekanismer som skal importeres til kjernen, men andre mRNA mangler disse mekanismene. Når den er inne i kjernen, kan opprettelse av DNA fra RNA ikke skje uten en primer , som følger med et retrovirus, men som ikke ville eksistere for annet mRNA hvis den plasseres i kjernen.
Kategorier
De to hovedkategoriene av mRNA-vaksiner bruker enten ikke-amplifiserende (konvensjonelt) mRNA eller selvforsterkende mRNA. De to første godkjente mRNA-vaksinene (Pfizer-BioNTech og Moderna COVID-19 vaksiner) bruker ikke-amplifiserende mRNA. Begge mRNA -typene fortsetter å bli undersøkt som vaksinemetoder mot andre potensielle patogener og kreftceller.
Ikke-forsterkende mRNA
Konvensjonelle mRNA-vaksiner bruker en ikke-amplifiserende mRNA-konstruksjon. Ikke-forsterkende mRNA har bare en åpen leseramme som koder for antigenproteinet av interesse. Den totale mengden mRNA som brukes av cellen er lik mengden mRNA levert av vaksinen. I en konvensjonell mRNA -vaksine er dosestyrken begrenset av mengden mRNA som kan leveres av vaksinen.
Selvforsterkende mRNA
Selvforsterkende mRNA (saRNA) vaksiner ligner konvensjonelle mRNA-vaksiner, med unntak av at saRNA-vaksiner også replikerer sitt mRNA selv. Det selvforsterkende mRNA har to åpne leserammer . Den første åpne leserammen, som konvensjonell mRNA, koder for antigenproteinet av interesse. Den andre åpne leserammen koder for en RNA-avhengig RNA-polymerase (og dens hjelperproteiner) som selvrepliserer mRNA-konstruksjonen i cellen og lager flere selvkopier. Dette gjør at mindre mengder mRNA kan brukes til vaksine. Mekanismene og følgelig evalueringen av selvforsterkende mRNA kan være forskjellige, ettersom selvforsterkende mRNA er fundamentalt forskjellig ved å være et mye større molekyl i størrelse.
Ulike saRNA -vaksiner blir undersøkt, inkludert utvikling av en malariavaksine . Gritstone bio startet i slutten av 2021 en fase 1-studie av en saRNA COVID-19-vaksine, brukt som en boostervaksine . Vaksinen er designet for å målrette både mot piggproteinet til SARS -CoV -2 -viruset og virusproteiner som kan være mindre utsatt for genetisk variasjon, for å gi større beskyttelse mot SARS -CoV -2 -varianter.
Se også
Referanser
Videre lesning
- Sahin U , Karikó K , Türeci Ö (oktober 2014). "mRNA-basert terapi-å utvikle en ny klasse medisiner" . Nat Rev Drug Discov . 13 (10): 759–80. doi : 10.1038/nrd4278 . PMID 25233993 .
- Dolgin E (14. september 2021). "Den sammenfiltrede historien til mRNA -vaksiner" . Natur . 597 (9): 318–324. doi : 10.1038/d41586-021-02483-w . PMID 34522017 .
Eksterne linker
| Scholia har en profil for RNA -vaksine (Q85795487) . |
- "Fem ting du trenger å vite om: mRNA -vaksiner" . Horisont .
- "RNA -vaksiner: en introduksjon" . PHG Foundation . University of Cambridge .
- "Forstå mRNA COVID-19 vaksiner" . Senter for sykdomskontroll og forebygging . 4. mars 2021.
- "Forstå og forklare mRNA COVID-19 vaksiner" . Senter for sykdomskontroll og forebygging . 4. mars 2021.
- MIT Forelesning 10: Kizzmekia Corbett, Vaccines " på YouTube