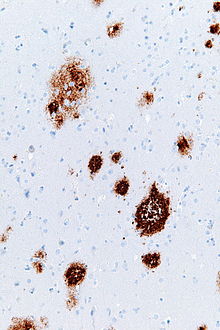
Amyloid -plaketter - Amyloid plaques
Amyloidplakk (også kjent som neurittplakk , Aβ -plakk eller senilplakk ) er ekstracellulære avsetninger av amyloid beta (Aβ) -proteinet hovedsakelig i gråstoffet i hjernen. Degenerative nevronelementer og en overflod av mikroglia og astrocytter kan være assosiert med amyloidplakk. Noen plaques oppstår i hjernen som følge av aldringsprosessen (aldring), men et stort antall plakk og nevrofibrillære floker er karakteristiske trekk ved Alzheimers sykdom . Unormale neuritter i amyloidplakk er kronglete, ofte hovne aksoner og dendritter . Neurittene inneholder en rekke organeller og celleavfall, og mange av dem inkluderer karakteristiske parede spiralformede filamenter , den ultrastrukturelle komponenten i nevrofibrillære floker. Plakkene er svært varierende i form og størrelse; i vevsdeler som er immunfarget for Aβ, omfatter de en log-normal størrelsesfordelingskurve med et gjennomsnittlig plakkareal på 400-450 kvadrat mikrometer (µm²). De minste plakettene (mindre enn 200 µm²), som ofte består av diffuse forekomster av Aβ, er spesielt mange. Den tilsynelatende størrelsen på plaketter påvirkes av typen flekker som brukes til å oppdage dem, og av planet der de blir snittet for analyse under mikroskopet. Plater dannes når Aβ misfoldes og aggregeres til oligomerer og lengre polymerer , de sistnevnte er karakteristiske for amyloid . Misfoldet og aggregert Aβ antas å være nevrotoksisk , spesielt i sin oligomere tilstand.
Historie
I 1892 beskrev Paul Blocq og Gheorghe Marinescu først tilstedeværelsen av plaketter i grå substans. De omtalte plakettene som 'knuter av neuroglial sklerose'. I 1898 rapporterte Emil Redlich plaketter hos tre pasienter, hvorav to hadde klinisk verifisert demens . Redlich brukte begrepet 'miliersklerose' for å beskrive plakk fordi han trodde de lignet hirsefrø, og han var den første som omtalte lesjonene som 'plakk'. På begynnelsen av 1900-tallet bemerket Oskar Fischer deres likhet med actinomyces 'Drusen' (geode-lignende lesjoner), noe som førte til at han kalte den degenerative prosessen 'drusige Nekrose'. Alois Alzheimer blir ofte kreditert for å først koble plaketter til demens i en presentasjon fra 1906 (publisert i 1907), men denne korte rapporten fokuserte hovedsakelig på nevrofibrillære floker, og plakk ble bare kort nevnt. Alzheimers første materielle beskrivelse av plakk dukket opp i 1911. I motsetning publiserte Oskar Fischer en rekke omfattende undersøkelser av plakk og demens i 1907, 1910 og 1912. I 1911 foreslo Max Bielschowsky amyloid-karakter av plakkavleiringer . Dette ble senere bekreftet av Paul Divry, som viste at plaketter som er beiset med fargestoffet Kongorød viser den optiske egenskapen til dobbeltbrytning , som er karakteristisk for amyloider generelt. I 1911 introduserte Teofil Simchowicz begrepet 'senile plakk' for å betegne deres hyppige tilstedeværelse i hjernen til eldre individer. I 1968 bekreftet en kvantitativ analyse av Gary Blessed, Bernard Tomlinson og Martin Roth sammenhengen mellom senile plakk med demens . Henryk Wisniewski og Robert Terry skapte begrepet 'nevritiske plakk' i 1973 for å betegne plakk som inkluderer unormale nevronprosesser (neuritter). Et viktig fremskritt i 1984 og 1985 var identifiseringen av Aβ som proteinet som danner kjernene til plakk. Denne oppdagelsen førte til generering av nye verktøy for å studere plaketter, spesielt antistoffer mot Aβ, og presenterte et molekylært mål for utvikling av potensielle terapier for Alzheimers sykdom. Kunnskap om aminosyresekvensen til Aβ gjorde det også mulig for forskere å oppdage genetiske mutasjoner som forårsaker autosomalt dominerende Alzheimers sykdom, som alle øker sannsynligheten for at Aβ vil samle seg i hjernen.
Generasjonen av amyloid beta
Amyloid beta (Aβ) er et lite protein, oftest 40 eller 42 aminosyrer i lengde, som frigjøres fra et lengre moderprotein kalt Aβ-forløperproteinet (APP). APP produseres av mange celletyper i kroppen, men det er spesielt rikelig i nevroner . Det er et enkeltpass transmembranprotein , det vil si at det passerer en gang gjennom cellemembraner . Aβ -segmentet i APP er delvis inne i membranen og delvis utenfor membranen. For å frigjøre Aβ, blir APP sekvensielt spaltet av to enzymer : for det første av beta-sekretase (eller β-amyloid-spaltende enzym (BACE)) utenfor membranen, og for det andre av gammasekretase (γ-sekretase), et enzymkompleks i membranen . De sekvensielle handlingene til disse sekretasene resulterer i Aβ -proteinfragmenter som frigjøres til det ekstracellulære rommet Utslippet av Aβ økes av aktiviteten til synapser . I tillegg til Aβ -peptider som er 40 eller 42 aminosyrer lange, genereres også flere mindre store Aβ -fragmenter. Aβ kan modifiseres kjemisk på forskjellige måter, og lengden på proteinet og kjemiske modifikasjoner kan påvirke både dets tendens til å aggregere og dets toksisitet.
Identifikasjon

Amyloid plakk er synlige med det lysmikroskop ved hjelp av en rekke farveteknikker, inkludert sølvflekker , kongorødt , Tioflavin , cresylfiolett , PAS-reaksjon , og selvlysende konjugert oligothiophenes (LCOS). Disse metodene flekker ofte forskjellige komponenter i plakkene, og de varierer i følsomhet. Plakkene kan også visualiseres immunhistokjemisk med antistoffer rettet mot Aβ eller andre komponenter i lesjonene. Immunhistokjemiske flekker er spesielt nyttige fordi de er både følsomme og spesifikke for antigener som er assosiert med plakk.
Sammensetning
Aβ -avsetningene som omfatter amyloidplakk er varierende i størrelse og utseende. Under lysmikroskopet spenner de fra små, sprø akkumuleringer som er noen få mikrometer i diameter til mye større tette eller diffuse masser. Såkalte 'klassiske plaketter' består av en kompakt Aβ-amyloidkjerne som er omgitt av en korona av noe mindre tett pakket Aβ. Klassiske plaketter inkluderer også unormale, hovne nevronprosesser ( neuritter ) som stammer fra mange forskjellige typer nevroner, sammen med aktiverte astrocytter og mikroglia . Unormale neuritter og aktiverte glialceller er ikke typiske for de fleste diffuse plakk, og det har blitt antydet at diffuse avsetninger er et tidlig stadium i utviklingen av plakk.
Anatomisk fordeling
Dietmar Thal og hans kolleger har foreslått en sekvens av stadier av plakkdannelse i hjernen til Alzheimer -pasienter I fase 1 vises plakk i neocortex ; i fase 2 vises de i allocortex , hippocampusformasjon og amygdala ; i fase 3 påvirkes de basale ganglier og diencephalon ; i fase 4 vises plakk i mellomhjernen og medulla oblongata ; og i fase 5 vises de i pons og lillehjernen . Således, i sluttstadiet Alzheimers sykdom, kan plakk finnes i de fleste deler av hjernen. De er uvanlige i ryggmargen .
Dannelse og spredning
Den normale funksjonen til Aβ er ikke sikker, men plakk oppstår når proteinet folder seg feil og begynner å samle seg i hjernen ved en prosess med molekylær templating ('seeding'). Mathias Jucker og Lary Walker har sammenlignet denne prosessen med dannelse og spredning av prioner ved sykdommer kjent som spongiform encefalopati eller prionsykdom . I følge prionparadigmet, folder visse proteiner seg sammen til former som er rike på beta-ark sekundærstruktur . I denne tilstanden får de andre proteiner av samme type til å vedta den samme unormale beta-arkrike strukturen. De feilfoldede proteinene holder seg til hverandre og stabler til slutt sammen for å danne oligomerer som smelter sammen for å lage amyloidfibriller som er typiske for modne plaketter.
Involvering i sykdom
Rikelig med Aβ -plaketter, sammen med nevrofibrillære floker som består av aggregert tau -protein , er de to lesjonene som er nødvendige for den nevropatologiske diagnosen Alzheimers sykdom. Selv om antallet neurofibrillære floker korrelerer sterkere med graden av demens enn antallet plakk, indikerer genetiske og patologiske funn at Aβ spiller en sentral rolle i risiko, utbrudd og progresjon av Alzheimers sykdom. Av spesiell betydning er de lengre (42 aminosyrene) artene av Aβ kjent som Aβ42. Forhøyede nivåer av Aβ, samt en økning i forholdet mellom Aβ42 og 40-aminosyreformen (Aβ40), er viktige tidlige hendelser i patogenesen av Alzheimers sykdom.
Inntil nylig krevde diagnosen Alzheimers sykdom en mikroskopisk analyse av plakk og floker i hjernevev, vanligvis ved obduksjon. Imidlertid kan Aβ-plakk (sammen med cerebral Aβ-amyloid angiopati ) nå påvises i hjernen til levende fag. Dette gjøres ved å fremstille radiomerkede midler som selektivt binder seg til Aβ -avleiringer i hjernen etter å ha blitt infundert i blodet. De ligander krysse blod-hjerne-barrieren og feste til aggregert Ap, og deres retensjon i hjernen bestemmes ved positronemisjonstomografi (PET). I tillegg kan tilstedeværelsen av plakk og floker estimeres ved å måle mengden av Aβ- og tau -proteiner i cerebrospinalvæsken .
Hendelse
Sannsynligheten for å ha plakk i hjernen øker med stigende alder. Fra 60 år (10%) til 80 år (60%) øker andelen mennesker med senile plakk lineært. Kvinner er litt mer sannsynlig å ha plakk enn menn. Både plaketter og Alzheimers sykdom er også mer vanlig hos eldre personer med trisomi -21 ( Downs syndrom ). Dette antas å skyldes overflødig produksjon av Aβ fordi APP -genet er på kromosom 21, som eksisterer som tre kopier i Downs syndrom.
Amyloidplakk forekommer naturlig i de aldrende hjernene til ikke -menneskelige arter, alt fra fugler til store aper. I ikke -menneskelige primater, som er de nærmeste biologiske slektningene til mennesker, har det blitt funnet plaketter hos alle artene som er undersøkt så langt. Neurofibrillære floker er imidlertid sjeldne, og ingen ikke -menneskelige arter har vist seg å ha demens sammen med fullstendig nevropatologi av Alzheimers sykdom.
Forskning
Forskning har vært rettet mot å forstå de biokjemiske , cytologiske og inflammatoriske egenskapene til plakk, bestemme hvordan plakk oppstår og spre seg i hjernen, identifisere genetiske og miljømessige risikofaktorer, oppdage metoder for å oppdage dem i den levende hjernen og utvikle terapeutiske strategier for å forhindre eller fjerne dem. Forskning på dannelse og spredning av amyloidplakk har blitt fremskyndet av utviklingen av genmodifiserte musemodeller. Til tross for noen begrensninger har disse modellene også bidratt til oppdagelsen av nye terapeutiske strategier. For eksempel har et voksende utvalg av behandlinger som reduserer Aβ -nivåer og antall plakk i hjernen blitt identifisert ved hjelp av transgene gnagermodeller. Disse strategiene inkluderer immunterapeutiske tilnærminger og hemmere av sekretasene som frigjør Aβ fra APP. Slike behandlinger blir nå klinisk evaluert for behandling av Alzheimers sykdom. Funnene så langt indikerer at fjerning av plaketter hos pasienter med demens er til liten nytte, muligens fordi hjernen er alvorlig skadet da tegn og symptomer på Alzheimers sykdom først dukket opp. Mikroglia-mediert plakkdannelse kan faktisk være gunstig ved innkapsling av Aβ i tette plakkkjerner. Av denne grunn tror mange forskere at tidligere inhibering av Aβ -aggregering og plakkdannelse er nødvendig for å bremse eller forhindre tauopati og demens ved Alzheimers sykdom. Annen forskning er rettet mot å forstå betennelsen som ofte er forbundet med plakk eller identifisere miljømessige, fysiologiske og genetiske risikofaktorer for plakkdannelse og Alzheimers sykdom.
Se også
Referanser
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (september 1991). "Senilplakkneuritter ved Alzheimers sykdom akkumulerer amyloid -forløperprotein" . Prosedyrer fra National Academy of Sciences i USA . 88 (17): 7552–6. Bibkode : 1991PNAS ... 88.7552C . doi : 10.1073/pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Augustine, George J .; Fitzpatrick, David; Hall, William C .; LaManita, Anthony-Samuel; White, Leonard E .; Mooney, Richard D .; Platt, Michael L. (2012). Nevrovitenskap (5. utg.). Sunderland, MA: Sinauer Associates. s. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). "Patogenesen til senile plakk" . J Neuropathol Exp Neurol . 56 (4): 321–339. doi : 10.1097/00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). "Aβ -plaketter" . Gratis nevropatologi . 1 (31): 31. doi : 10.17879/freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19. mars 2011). "Alzheimers sykdom". Lancet . 377 (9770): 1019–31. doi : 10.1016/S0140-6736 (10) 61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; West HL; Rebeck GW; Buldyrev SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Kvantitativ analyse av senile plakk ved Alzheimers sykdom: observasjon av log-normal størrelsesfordeling og molekylær epidemiologi av forskjeller assosiert med apolipoprotein E genotype og trisomi 21 (Downs syndrom)" . Prosedyrer fra National Academy of Sciences i USA . 92 (8): 3586–3590. Bibcode : 1995PNAS ... 92.3586H . doi : 10.1073/pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ a b c Röhr D, Boon BD, et al. (Desember 2020). "Etikettfri vibrasjonsavbildning av forskjellige Aβ-plakketyper ved Alzheimers sykdom avslører sekvensielle hendelser i plakkutvikling" . Acta Neuropathologica Communications . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haass C; Selkoe DJ (2007). "Løselige proteinoligomerer i nevrodegenerasjon: leksjoner fra Alzheimers amyloid beta-peptid". Nat Rev Mol Cell Biol . 8 (2): 101–112. doi : 10.1038/nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle . s. 445–6. OCLC 492619936 .
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (januar 2009). "Georges Marinesco og den tidlige forskningen innen nevropatologi". Nevrologi . 72 (1): 88–91. doi : 10.1212/01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). "Ueber miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ a b c Goedert M (2009). "Oskar Fischer og studiet av demens" . Hjernen . 132 (4): 1102–1111. doi : 10.1093/brain/awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin . 64 : 146–8.
- ^ Divry P (1927). "Etude histo-chimique des plaques séniles". Journal Belge de Neurologie et de Psychiatrie . 9 : 643–657.
- ^ Buxbaum JN; Linke RP (2012). "En molekylær historie om amyloidosene". Journal of Molecular Biology . 421 (2–3): 142–159. doi : 10.1016/j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. i: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, s. 267–444.
- ^ Ohry A; Buda O (2015). "Teofil Simchowicz (1879-1957): forskeren som skapte senile plakk i nevropatologi". Rumensk journal for morfologi og embryologi . 56 (4): 1545–1548. PMID 26743308 .
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). "Teofil Simchowicz (1879-1957)" . Journal of Neurology . 264 (8): 1831–1832. doi : 10.1007/s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Velsignet G; Tomlinson BE; Roth M (1968). "Sammenhengen mellom kvantitative mål for demens og senil endring i den cerebrale grå substansen hos eldre personer". British Journal of Psychiatry . 114 (512): 797–811. doi : 10.1192/bjp.114.512.797 . PMID 5662937 .
- ^ Wisniewski, Henryk M .; Terry, Robert D. (1973). "Kapittel 1: Ny undersøkelse av patogenesen til senil plakett". I Zimmerman, HM (red.). Fremskritt i nevropatologi, bind 2 . Grune og Stratton. s. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). "Alzheimers sykdom: første rapport om rensing og karakterisering av et nytt cerebrovaskulært amyloidprotein". Biokjemisk og biofysisk forskningskommunikasjon . 120 (3): 885–890. doi : 10.1016/s0006-291x (84) 80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). "Alzheimers sykdom og Downs syndrom: deling av et unikt cerebrovaskulært amyloidfibrilprotein". Biokjemisk og biofysisk forskningskommunikasjon . 122 (3): 1131–1135. doi : 10.1016/0006-291x (84) 91209-9 . PMID 6236805 .
- ^ Masters CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). "Amyloid plakkkjerneprotein ved Alzheimers sykdom og Downs syndrom" . Prosedyrer ved National Academy of Sciences USA . 82 (12): 4245–4249. Bibcode : 1985PNAS ... 82.4245M . doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ a b c Walsh DM; Selkoe DJ (2020). "Amyloid beta-protein og utover: veien videre i Alzheimers sykdom". Nåværende mening i nevrobiologi . 61 : 116–124. doi : 10.1016/j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Long JM; Holtzman DM (2019). "Alzheimers sykdom: En oppdatering om patobiologi og behandlingsstrategier" . Cell . 179 (2): 312–339. doi : 10.1016/j.cell.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). "Proteopatiske stammer og heterogeniteten til nevrodegenerative sykdommer" . Årlig gjennomgang av genetikk . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). "Kapittel 19: Biologi av β-amyloid-forløperprotein og mekanismen for Alzheimers sykdom". I Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (red.). Alzheimers sykdom . Lippincott Williams og Wilkins. s. 293–310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). "Handel og proteolytisk behandling av APP" . Cold Spring Harbour Perspectives in Medicine . 2 (5: a006270): a006270. doi : 10.1101/cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (september 2002). "Amyloid-forløperprotein, preseniliner og alfa-synuklein: molekylær patogenese og farmakologiske anvendelser ved Alzheimers sykdom". Farmakologiske anmeldelser . 54 (3): 469–525. doi : 10.1124/pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; Valverde A; Checler F (2018). "Er N- og C-terminalt avkortede Aβ-arter viktige patologiske utløsere ved Alzheimers sykdom?" . Journal of Biological Chemistry . 293 (40): 15419–15428. doi : 10.1074/jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ Kummer MP; Heneka MT (2014). "Avkortet og modifisert amyloid-beta-art" . Alzheimers forskning og terapi . 6 (3): 28. doi : 10.1186/alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). "Sammenligning av syv fargemetoder for senile plakk og nevrofibrillære floker i en potensiell serie på 15 eldre pasienter". Nevropatologi og anvendt nevrobiologi . 15 (6): 563–78. doi : 10.1111/j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). "Selvlysende konjugerte poly- og oligo-tiofen: optiske ligander for spektral tildeling av en mengde proteinaggregater". Biokjemiske samfunnstransaksjoner . 40 (4): 704–710. doi : 10.1042/BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (desember 2011). "Er rutinemetoder gode nok til å flekke senile plakk og nevrofibrillære floker i forskjellige hjerneområder hos demente pasienter?" (PDF) . Psychiatria Danubina . 23 (4): 334–9. PMID 22075733 . Arkivert fra originalen (PDF) 2017-08-11 . Hentet 2014-06-22 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Stadier av den patologiske prosessen ved Alzheimers sykdom: alderskategorier fra 1 til 100 år" . Journal of Neuropathology and Experimental Neurology . 70 (11): 960–969. doi : 10.1097/NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). "Faser av Abeta-avsetning i den menneskelige hjerne og dens relevans for utviklingen av AD". Nevrologi . 58 (12): 1791–1800. doi : 10.1212/wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; Walter J; Saido TC; Fändrich M (2015). "Neuropatologi og biokjemi av Aβ og dets aggregater ved Alzheimers sykdom" . Acta Neuropathologica . 129 (2): 167–182. doi : 10.1007/s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ a b Jucker, M; Walker, LC (2013). "Selvforplantning av patogene proteinaggregater i nevrodegenerative sykdommer" . Natur . 501 (7465): 45–51. Bibcode : 2013Natur.501 ... 45J . doi : 10.1038/nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Walker LC; Jucker M (2015). "Neurodegenerative sykdommer: Utvidelse av prionkonseptet" . Årlig gjennomgang av nevrovitenskap . 38 : 87–103. doi : 10.1146/annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). "Prioner" . Prosedyrer fra National Academy of Sciences USA . 95 (23): 13363–13383. Bibcode : 1998PNAS ... 9513363P . doi : 10.1073/pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). "Amyloidtilstanden til proteiner ved menneskelige sykdommer" . Cell . 148 (6): 1188–1203. doi : 10.1016/j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). "Korrelasjon av nevropatologiske endringer i Alzheimers sykdom med kognitiv status: en gjennomgang av litteraturen" . Journal of Neuropathology and Experimental Neurology . 71 (5): 362–381. doi : 10.1097/NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ a b Findeis MA (november 2007). "Rollen til amyloid beta -peptid 42 i Alzheimers sykdom". Farmakologi og terapi . 116 (2): 266–86. doi : 10.1016/j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). "Ulike aspekter ved Alzheimers sykdomsrelaterte amyloide β-peptidpatologi og deres forhold til amyloid positronemisjonstomografi og demens" . Acta Neuropathologica Communications . 7 (1): 178. doi : 10.1186/s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). "Småmolekylære PET-sporstoffer for avbildning av proteinopatier" . Seminarer i nukleærmedisin . 47 (5): 553–575. doi : 10.1053/j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchie C; Smailagic N; Noel-Storr AH; Ukoumunne O; Ladds EC; Martin S (2017). "CSF tau og CSF tau/ABeta -forholdet for diagnostisering av Alzheimers sykdom demens og andre demens hos mennesker med mild kognitiv svikt (MCI)" . Cochrane Database of Systematic Reviews . 3 (3): CD010803. doi : 10.1002/14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; Lehmann S; Otto M; Zetterberg H; Lewczuk P (2019). "Fordeler og ulemper ved bruk av CSF Amyloid beta (Abeta) 42/40 -forholdet i diagnosen Alzheimers sykdom" . Alzheimers forskning og terapi . 11 (1): 34. doi : 10.1186/s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). "Aldersforekomst av senil hjerneamyloidose" (PDF) . Patologi - forskning og praksis . 181 (5): 558–562. doi : 10.1016/S0344-0338 (86) 80149-2 . PMID 3786248 .
- ^ Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen" . Berlin, Tyskland: Neuropathologische Abteilung. Arkivert fra originalen 2011-07-19.
- ^ a b Hode E; Powell D; Gull BT; Schmitt FA (2012). "Alzheimers sykdom i Downs syndrom" . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Cintron A; Walker LC (2012). "Ikke-menneskelige primatmodeller av Alzheimer-lignende cerebral proteopati" . Nåværende farmasøytisk design . 18 (8): 1159–1169. doi : 10.2174/138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Walker LC; Jucker M (2017). "Menneskets eksepsjonelle sårbarhet for Alzheimers sykdom" . Trender innen molekylær medisin . 23 (6): 534–545. doi : 10.1016/j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). "Fordelene og begrensningene ved dyremodeller for translasjonsforskning i nevrodegenerative sykdommer". Naturmedisin . 16 (11): 1210–1214. doi : 10.1038/nm.2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). "Oversikt over transgene musemodeller for Alzheimers sykdom". Gjeldende protokoller innen nevrovitenskap . 89 (1: e81): 1210–1214. doi : 10.1002/cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (april 2021). "Microglia bruker TAM -reseptorer for å oppdage og sluke amyloid β -plakk" . Naturimmunologi . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoff RM; Becher B (2015). "Immunangrep: betennelsens rolle i Alzheimers sykdom". Naturanmeldelser Neuroscience . 16 (6): 358–372. doi : 10.1038/nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E (2016). "Cellefasen av Alzheimers sykdom" . Cell . 164 (4): 603–615. doi : 10.1016/j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). "Miljømessige risikofaktorer for demens: en systematisk gjennomgang" . BMC geriatri . 16 (1): 175. doi : 10.1186/s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
Videre lesning
- Jellinger KA (2005). "Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (Juli 1997). "Aggregering og oppdeling av senile plaketter ved Alzheimers sykdom" . Prosedyrer fra National Academy of Sciences i USA . 94 (14): 7612–6. Bibcode : 1997PNAS ... 94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .