Spinal muskelatrofi - Spinal muscular atrophy
| Spinal muskelatrofi | |
|---|---|
| Andre navn | Autosomal recessiv proksimal spinal muskelatrofi, 5q spinal muskelatrofi |
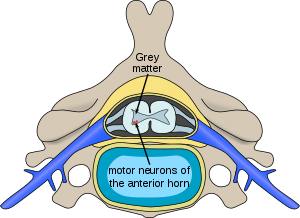 | |
| Plassering av nevroner påvirket av spinal muskelatrofi i ryggmargen | |
| Spesialitet | Nevrologi |
| Symptomer | Progressiv muskelsvakhet |
| Komplikasjoner | Skoliose , leddkontrakturer , lungebetennelse |
| Typer | Skriv 0 til type 4 |
| Årsaker | Mutasjon i SMN1 |
| Diagnostisk metode | Genetisk testing |
| Differensialdiagnose | Medfødt muskeldystrofi , Duchenne muskeldystrofi , Prader-Willi syndrom |
| Behandling | Støttende behandling , medisiner |
| Medisinering | Nusinersen , onasemnogene abeparvovec , Risdiplam |
| Prognose | Varierer etter type |
| Frekvens | 1 av 10 000 mennesker |
Spinal muskelatrofi ( SMA ) er en sjelden nevromuskulær lidelse som resulterer i tap av motoriske nevroner og progressiv muskelsvinn . Det blir vanligvis diagnostisert i barndommen eller tidlig barndom, og hvis det ikke behandles, er det den vanligste genetiske årsaken til spedbarnsdød. Det kan også vises senere i livet og deretter ha et mildere sykdomsforløp. Felles trekk er progressiv svakhet i frivillige muskler, med armer, bein og respiratoriske muskler som først blir påvirket. Tilknyttede problemer kan omfatte dårlig hodekontroll, svelgevansker, skoliose og leddkontrakturer .
Startalderen og alvorlighetsgraden av symptomer danner grunnlaget for den tradisjonelle klassifiseringen av spinal muskelatrofi i en rekke typer.
Spinal muskelatrofi skyldes en abnormitet ( mutasjon ) i SMN1 -genet som koder for SMN , et protein som er nødvendig for å overleve motoriske nevroner . Tap av disse nevronene i ryggmargen forhindrer signal mellom hjernen og skjelettmuskulaturen . Et annet gen, SMN2 , regnes som et sykdomsmodifiserende gen, siden jo mer SMN2 kopierer, jo mildere er sykdomsforløpet. Diagnosen SMA er basert på symptomer og bekreftet av genetisk testing .
Vanligvis arves mutasjonen i SMN1 -genet fra begge foreldrene på en autosomal recessiv måte, selv om det i rundt 2% av tilfellene forekommer under tidlig utvikling ( de novo ). Forekomsten av spinal muskelatrofi over hele verden varierer fra omtrent 1 av 4 000 fødsler til rundt 1 av 16 000 fødsler, hvor 1 av 7 000 og 1 av 10 000 ofte siteres for henholdsvis Europa og USA.
Utfall i det naturlige sykdomsforløpet varierer fra død i løpet av få uker etter fødselen i de mest akutte tilfellene til normal forventet levetid i de langvarige SMA -formene. Innføringen av forårsakende behandlinger i 2016 har forbedret resultatene betydelig. Medikamenter som er rettet mot den genetiske årsaken til sykdommen inkluderer nusinersen , risdiplam , og den genterapi medisinering onasemnogene abeparvovec . Støttende omsorg inkluderer fysioterapi , ergoterapi, åndedrettsstøtte, ernæringsstøtte, ortopediske inngrep og mobilitetsstøtte .
Klassifisering
5q SMA er en enkelt sykdom som manifesterer seg over et bredt spekter av alvorlighetsgrad og påvirker spedbarn gjennom voksne. Før genetikken ble forstått, ble de forskjellige manifestasjonene antatt å være forskjellige sykdommer- Werdnig-Hoffmann sykdom da små barn ble rammet og Kugelberg – Welander sykdom for sent oppståtte tilfeller.
I 1990 ble det innsett at disse separate sykdommene dannet et spekter av den samme lidelsen. Spinal muskelatrofi ble deretter klassifisert i 3-5 kliniske typer, enten basert på alderen på symptomdebut eller den maksimale motorfunksjonen som ble oppnådd. For tiden er konsensus at fenotypen for spinal muskelatrofi spenner over et kontinuum av symptomer uten klar avgrensning av undertyper. Den tradisjonelle klassifiseringen, som er skissert i tabellen nedenfor, brukes imidlertid fremdeles i dag både i klinisk forskning og noen ganger kontroversielt som et kriterium for tilgang til terapier.
| Type | Eponym | Vanlig startalder | Naturhistorie (uten farmakologisk behandling) | OMIM |
|---|---|---|---|---|
| SMA 0 | Prenatal | Symptomer observeres ved fødselen og blir ofte tydelige i prenatalperioden som redusert fosterbevegelse. Berørte barn har vanligvis bare en enkelt kopi av SMN2 -genet og overlever vanligvis bare noen få uker, selv med 24/7 respiratorisk støtte. Dette skjemaet er svært sjeldent - står for ca. 2% av tilfellene. | ||
|
SMA 1 (Infantile) |
Werdnig - Hoffmann sykdom | 0–6 måneder | Dette skjemaet er diagnostisert hos rundt 50% av pasientene, hos hvem sykdommen manifesterer seg i de første ukene eller månedene av livet. SMA starter deretter raskt og uventet, med forskjellige muskelgrupper som ikke lykkes gradvis. Spedbarn lærer aldri å sitte uten støtte og mister de fleste gradvis mesteparten av muskelfunksjonen. Døden er vanligvis forårsaket av svikt i respiratoriske muskler forårsaket av lungebetennelse (ofte aspirasjonspneumoni ). Med mindre det tilbys respiratorisk støtte og/eller farmakologisk behandling tidlig, overlever babyer som er diagnostisert med SMA type 1 vanligvis ikke over to år. Med riktig åndedrettsstøtte er det kjent at de med mildere SMA type 1-fenotyper, som står for rundt 10% av SMA 1-tilfellene, overlever til ungdomsårene og voksenlivet selv uten farmakologisk behandling, selv om de alltid krever omsorg døgnet rundt. | 253300 |
|
SMA 2 (middels) |
Dubowitz sykdom | 6–18 måneder | Mellomformen, diagnostisert hos rundt 20% av pasientene, angir mennesker som var i stand til å opprettholde en sittestilling minst en gang i livet, men som aldri lærte å gå uten støtte. Utbruddet av svakhet blir vanligvis lagt merke til en tid mellom 6 og 18 måneders liv. Fremgangen er kjent for å variere sterkt, noen mennesker blir gradvis svakere over tid, mens andre gjennom nøye vedlikehold forblir relativt stabile. Kroppsmuskulaturen er svekket, og luftveiene er en stor bekymring, det samme er muskelsammentrekninger og krumning av ryggraden. Forventet levealder reduseres, selv om de fleste med SMA 2 lever godt inn i voksenlivet selv uten behandling. | 253550 |
|
SMA 3 (ungdom) |
Kugelberg – Welander sykdom | > 12 måneder | Ungdomsformen, diagnostisert hos rundt 30% av pasientene, manifesterer seg etter 12 måneders alder, eller etter at barna allerede har lært å gjøre minst noen få uavhengige trinn. Sykdommen utvikler seg sakte, og de fleste med SMA 3 mister gangevnen en gang i livet, og krever støtte for mobilitet. Åndedrettsengasjement er sjelden og forventet levealder er normal eller nesten normal. | 253400 |
|
SMA 4 (voksen debut) |
Voksenlivet | Dette betegner voksenoppstått form, noen ganger også klassifisert som en sent oppstått SMA type 3. Det forekommer hos ca. 5% av pasientene og manifesterer seg vanligvis i det tredje eller fjerde tiåret av livet. Symptomene består i gradvis svekkelse av benmuskulaturen, noe som ofte gjør det nødvendig for pasienten å bruke ganghjelpemidler. Andre komplikasjoner er sjeldne og forventet levealder er upåvirket. | 271150 |
For enkelhets skyld klassifiserer omsorgsfokuserte publikasjoner pasientene i "ikke-sitter", "sitter" og "turgåere" basert på deres faktiske funksjonelle status.
Motorisk utvikling og sykdomsprogresjon hos mennesker med SMA blir vanligvis vurdert ved hjelp av validerte funksjonsskalaer-CHOP-INTEND (Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders) eller HINE (Hammersmith Infant Neurological Examination) hos spedbarn; og enten MFM (Motor Function Measure) eller en av flere varianter av HFMS (Hammersmith Functional Motor Scale) hos eldre pasienter.
Den selvbetegnede etiketten Werdnig - Hoffmann sykdom (noen ganger feilstavet med et enkelt n ) refererer til de tidligste kliniske beskrivelsene av barndomens SMA av Johann Hoffmann og Guido Werdnig . Det samme navnet Kugelberg – Welander sykdom er etter Erik Klas Hendrik Kugelberg (1913–1983) og Lisa Welander (1909–2001) som først dokumenterte den sent oppståtte formen og skilte den fra muskeldystrofi. Svært sjelden brukt Dubowitz sykdom (for ikke å forveksle med Dubowitz syndrom ) er oppkalt etter Victor Dubowitz , en engelsk nevrolog som forfattet flere studier om den mellomliggende SMA -fenotypen.
Tegn og symptomer
Symptomene varierer avhengig av SMA -typen, sykdomsstadiet samt individuelle faktorer. Tegn og symptomer nedenfor er vanligst i alvorlig SMA type 0/I:
- Arefleksi , spesielt i ekstremiteter
- Generell muskelsvakhet , dårlig muskeltonus , slapphet eller en tendens til å floppe
- Vanskeligheter med å oppnå utviklingsmessige milepæler, problemer med å sitte/stå/gå
- Hos små barn: adoptering av en froskelårsposisjon når du sitter (hofter bortført og knær bøyde)
- Tap av styrke i åndedrettsmuskulaturen : svak hoste , svakt gråt (spedbarn), opphopning av sekreter i lungene eller halsen, respiratorisk lidelse
- Klokkeformet overkropp (forårsaket av å bare bruke magemuskler for respirasjon) ved alvorlig SMA-type
- Fascikulasjoner (rykninger) i tungen
- Problemer med å suge eller svelge, dårlig fôring
Årsaker
Spinal muskelatrofi er forårsaket av en genetisk mutasjon i SMN1 -genet .
Menneskelig kromosom 5 inneholder to nesten identiske gener på sted 5q13: en telomerisk kopi SMN1 og en sentromerisk kopi SMN2 . Hos friske individer koder SMN1 -genet overlevelse av motorneuronprotein (SMN) som, som navnet sier, spiller en avgjørende rolle i overlevelse av motoriske nevroner . Den SMN2 gen, på den annen side - som følge av en variasjon i et enkelt nukleotid (840.C → T) - undergår alternativ spleising i krysset av intron 6 til exon 8, med bare 10-20% av SMN2 transkripter som koder et fullt funksjonell overlevelse av motorneuronprotein (SMN-fl) og 80–90% av transkripsjoner som resulterer i en avkortet proteinforbindelse (SMNΔ7) som raskt nedbrytes i cellen.
Hos individer som er berørt av SMA, er SMN1 -genet mutert på en slik måte at det ikke er i stand til å kode SMN -proteinet riktig - på grunn av enten en sletting som oppstår ved ekson 7 eller på andre punktmutasjoner (som ofte resulterer i funksjonell konvertering av SMN1 sekvens til SMN2 ). Nesten alle mennesker har imidlertid minst én funksjonell kopi av SMN2 -genet (hvor de fleste har 2–4 av dem) som fortsatt koder 10–20% av det vanlige nivået av SMN -proteinet, slik at noen nevroner kan overleve. På sikt resulterer imidlertid den reduserte tilgjengeligheten av SMN -proteinet i gradvis død av motoriske nevronceller i det fremre hornet i ryggmargen og hjernen. Skjelettmuskler , som alle er avhengige av disse motoriske nevronene for nevral input, har nå redusert innervering (også kalt denervasjon ), og har derfor redusert input fra sentralnervesystemet (CNS). Redusert impulsoverføring gjennom motorneuronene fører til redusert kontraktil aktivitet av den denerverte muskel. Følgelig gjennomgår denerverte muskler progressiv atrofi (bortkastet).
Muskler i nedre ekstremiteter påvirkes vanligvis først, etterfulgt av muskler i øvre ekstremiteter, ryggrad og nakke og, i mer alvorlige tilfeller, lunge- og mastikasjonsmuskler. Proksimale muskler påvirkes alltid tidligere og i større grad enn distale muskler.
Alvorligheten av SMA -symptomer er i stor grad relatert til hvor godt de gjenværende SMN2 -genene kan gjøre opp for tap av funksjon av SMN1 . Dette avhenger delvis av antall kopier av SMN2 -genet som er tilstede på kromosomet. Mens friske individer vanligvis bærer to SMN2 -genkopier , kan personer med SMA ha alt mellom 1 og 5 (eller flere) av dem; jo større antall SMN2 -kopier , jo mildere er sykdommens alvorlighetsgrad. Således har de fleste SMA type I babyer en eller to SMN2 kopier; personer med SMA II og III har vanligvis minst tre SMN2 -kopier ; og personer med SMA IV har normalt minst fire av dem. Korrelasjonen mellom symptomens alvorlighetsgrad og SMN2 -kopiantallet er imidlertid ikke absolutt, og det ser ut til å eksistere andre faktorer som påvirker sykdomsfenotypen.
Spinal muskelatrofi arves i et autosomalt recessivt mønster, noe som betyr at det defekte genet befinner seg på et autosom . To kopier av det defekte genet - en fra hver forelder - er påkrevd for å arve lidelsen: foreldrene kan være bærere og ikke påvirkes personlig. SMA ser ut til å virke de novo (dvs. uten arvelige årsaker) i rundt 2–4% av tilfellene.
Spinal muskelatrofi påvirker individer i alle etniske grupper, i motsetning til andre kjente autosomale recessive lidelser, som sigdcellesykdom og cystisk fibrose , som har betydelige forskjeller i forekomst blant etniske grupper. Den generelle forekomsten av SMA, av alle typer og på tvers av alle etniske grupper, er i området 1 per 10 000 individer; genfrekvensen er rundt 1: 100, derfor er omtrent en av 50 personer bærere. Det er ingen kjente helsekonsekvenser av å være transportør. En person kan bare lære bærerstatus hvis barnet er påvirket av SMA eller ved å få sekvensert SMN1 -genet.
Berørte søsken har vanligvis en lignende form for SMA. Forekomster av forskjellige SMA -typer blant søsken eksisterer imidlertid - selv om de er sjeldne, kan disse tilfellene skyldes ytterligere de novo -sletting av SMN -genet, uten at NAIP -genet er involvert , eller forskjellene i SMN2 -kopitall .
Diagnose
SMA diagnostiseres ved hjelp av genetisk testing som oppdager homozygot sletting av SMN1 -genet i over 95% av tilfellene, og en sammensatt SMN1 -mutasjon hos de resterende pasientene. Genetisk testing utføres vanligvis ved hjelp av en blodprøve, og MLPA er en av de mer brukte genetiske testteknikkene, da den også gjør det mulig å fastslå antall SMN2 -genkopier , som har klinisk betydning.
Symptomatisk kan SMA diagnostiseres med en viss grad bare hos barn med akutt form som viser en progressiv sykdom med paradoksal pust , bilateral lav muskeltonus og fraværende senereflekser.
Tidlig diagnose
Tidlig diagnose av SMA, på det asymptomatiske stadiet av sykdommen, gir mulighet for
Preimplantasjonstesting
Preimplantasjonsgenetisk diagnose kan brukes til å undersøke for SMA-berørte embryoer under in vitro-befruktning .
Prenatal testing
Prenatal testing for SMA er mulig gjennom chorionic villus-prøvetaking , cellefri foster-DNA- analyse og andre metoder.
Nyfødt screening
Rutinemessig nyfødt screening for SMA blir stadig mer vanlig i utviklede land, gitt tilgjengeligheten av årsakssykdommer som er mest effektive på det asymptomatiske stadiet av sykdommen. I 2018 ble screening for nyfødte for SMA lagt til den amerikanske listen over anbefalte tester for nyfødte screening, og fra april 2020 har den blitt vedtatt i 39 amerikanske stater. Fra mai 2021 har SMA -screening for nyfødte blitt implementert i Taiwan og er under implementering i Australia, Belgia, Canada, Frankrike, Tyskland, Nederland, Polen, Serbia og Slovenia. I tillegg gjennomføres pilotprosjekter i Australia, Kina, Italia og Japan.
Transportør testing
De som risikerer å være bærere av SMN1 -sletting , og dermed risikerer å få avkom påvirket av SMA, kan gjennomgå bæreranalyse ved hjelp av en blod- eller spyttprøve. Den American College of Fødselsleger og Gynekologer anbefaler alle folk tenker på å bli gravid bli testet for å se om de er bærer av. Bærefrekvensen for SMA er sammenlignbar med andre lidelser som thalassemi, og i en nordindisk kohort har det vist seg å være 1 av 38. Imidlertid vil genetisk testing ikke kunne identifisere alle personer i fare siden om lag 2% av tilfellene er forårsaket av de novo mutasjoner og 5% av normalpopulasjonene har to kopier av SMN1 på det samme kromosomet, noe som gjør det mulig å være bærer ved å ha ett kromosom med to kopier og et andre kromosom med null kopier. Denne situasjonen vil føre til et falskt negativt resultat, ettersom bærerstatusen ikke blir korrekt oppdaget av en tradisjonell genetisk test.
Ledelse
Administrasjonen av SMA varierer basert på alvorlighetsgrad og type. I de mest alvorlige former (type 0/1) har individer den største muskelsvakheten som krever rask intervensjon. Mens den minst alvorlige formen (type 4/voksen debut), kan det hende at individer ikke søker de visse aspektene ved omsorg før senere (tiår) i livet. Mens typer SMA og individer blant hver type kan variere, kan derfor spesifikke aspekter ved en persons omsorg variere.
Medisinering
Nusinersen (markedsført som Spinraza) brukes til å behandle spinal muskelatrofi. Det er et antisense -nukleotid som modifiserer den alternative spleisen av SMN2 -genet. Det gis direkte til sentralnervesystemet ved hjelp av en intratekal injeksjon . Nusinersen forlenger overlevelse og forbedrer motorisk funksjon hos spedbarn med SMA. Den ble godkjent for bruk i USA i 2016, og for bruk i EU i 2017.
Onasemnogene abeparvovec (markedsført som Zolgensma) er en genterapibehandling som bruker selvkomplementær adeno-assosiert virus type 9 (scAAV-9) som en vektor for å levere SMN1- transgenet. Terapien ble først godkjent i USA i mai 2019 som en intravenøs formulering for barn under 24 måneder. Godkjenning i EU, Japan og andre land fulgte, om enn ofte med forskjellige godkjenningsområder.
Risdiplam (markedsført som Evrysdi) er en medisin som tas gjennom munnen i flytende form. Det er et pyridazinderivat som virker ved å øke mengden funksjonelt overlevende motorisk nevronprotein produsert av SMN2 -genet ved å endre spleisemønsteret . Risdiplam ble først godkjent for medisinsk bruk i USA i august 2020 og har siden blitt godkjent i over 30 land.
Puster
Luftveiene er det vanligste systemet som påvirkes, og komplikasjonene er den viktigste dødsårsaken hos SMA -typer 0/1 og 2. SMA type 3 kan ha lignende luftveisproblemer, men det er mer sjelden. Komplikasjonene som oppstår på grunn av svekkede interkostale muskler på grunn av mangel på stimulering fra nerven. Membranen er mindre påvirket enn interkostale muskler. Når de er svekket, får musklene aldri helt den samme funksjonelle evnen til å hjelpe til med å puste og hoste samt andre funksjoner. Derfor er pusten vanskeligere og utgjør en risiko for å ikke få nok oksygen/grunne pust og utilstrekkelig frigjøring av luftveisekresjoner. Disse problemene oppstår oftere mens du sover, når musklene er mer avslappede. Svelging av muskler i svelget kan påvirkes, noe som fører til aspirasjon kombinert med en dårlig hostemekanisme som øker sannsynligheten for infeksjon/ lungebetennelse . Mobilisering og tømming av sekreter innebærer manuell eller mekanisk brystfysioterapi med postural drenering, og manuell eller mekanisk hostehjelp. For å hjelpe til med å puste, brukes ikke-invasiv ventilasjon ( BiPAP ) ofte, og trakeostomi kan noen ganger utføres i mer alvorlige tilfeller; begge ventilasjonsmetodene forlenger overlevelse i tilsvarende grad, selv om trakeostomi forhindrer taleutvikling.
Ernæring
Jo mer alvorlig typen SMA, jo mer sannsynlig er det at du har ernæringsrelaterte helseproblemer. Helseproblemer kan omfatte problemer med å mate, kjeveåpning, tygging og svelging. Personer med slike vanskeligheter kan ha økt risiko for over- eller underernæring, manglende evne til å trives og aspirasjon. Andre ernæringsproblemer, spesielt hos personer som ikke er ambulerende (mer alvorlige typer SMA), inkluderer mat som ikke går raskt nok gjennom magen, magesmerter, forstoppelse, oppkast og oppblåsthet. Der kan det være nødvendig hos SMA type I og personer med mer alvorlig type II å ha et fôringsrør eller gastrostomi . I tillegg svekker metabolske abnormiteter som følge av SMA β-oksidasjon av fettsyrer i muskler og kan føre til organisk acidemi og påfølgende muskelskade, spesielt ved faste. Det foreslås at personer med SMA, spesielt de med mer alvorlige former for sykdommen, reduserer inntaket av fett og unngår langvarig faste (dvs. spiser oftere enn friske mennesker), i tillegg til å velge mykere matvarer for å unngå aspirasjon. Under en akutt sykdom, spesielt hos barn, kan ernæringsproblemer først presentere eller forverre et eksisterende problem (eksempel: aspirasjon), samt forårsake andre helseproblemer som elektrolytt og forstyrrelse av blodsukkeret.
Ortopedi
Skjelettproblemer assosiert med svake muskler i SMA inkluderer stramme ledd med begrenset bevegelsesområde, hofteforstyrrelser, spinal deformitet, osteopeni, økt risiko for brudd og smerter. Svake muskler som normalt stabiliserer ledd som virvelsøylen fører til utvikling av kyfose og/eller skoliose og leddkontraktur. Fremre fusjon er ofte utført på personer med SMA I / II når de når en alder på 8-10 for å avlaste trykket av en deformert ryggraden på lungene. Videre kan immobile individer, holdning og posisjon på mobilitetsutstyr samt bevegelsesøvelser og beinforsterkning være viktig for å forhindre komplikasjoner. Personer med SMA kan også ha stor nytte av ulike former for fysioterapi , ergoterapi og fysioterapi.
Ortotiske enheter kan brukes til å støtte kroppen og hjelpe til med å gå. For eksempel brukes ortoter som AFOer (fotfotsortoser) for å stabilisere foten og for å hjelpe gangart, brukes TLSOer (thorax lumbale sakrale ortoser) for å stabilisere torsoen. Hjelpemiddelteknologi kan hjelpe til med å håndtere bevegelser og daglig aktivitet og øke livskvaliteten sterkt.
Annen
Selv om hjertet ikke er et spørsmål om rutinemessig bekymring, har det blitt foreslått en kobling mellom SMA og visse hjertesykdommer.
Barn med SMA skiller seg ikke fra den generelle befolkningen i sin oppførsel; deres kognitive utvikling kan være litt raskere, og visse aspekter av deres intelligens er over gjennomsnittet. Til tross for funksjonshemming rapporterer SMA-berørte mennesker om høy grad av tilfredshet fra livet.
Palliativ behandling i SMA har blitt standardisert i Consensus Statement for Standard of Care in Spinal Muscular Atrophy som har blitt anbefalt for standard adopsjon over hele verden.
Prognose
I mangel av farmakologisk behandling har mennesker med SMA en tendens til å forverres over tid. Nylig har overlevelsen økt hos alvorlige SMA -pasienter med aggressiv og proaktiv støttende respiratorisk og ernæringsstøtte.
Hvis de ikke behandles, når ikke flertallet av barna som er diagnostisert med SMA type 0 og 1 4 år, og tilbakevendende luftveisproblemer er den viktigste dødsårsaken. Med riktig omsorg lever mildere SMA type I -tilfeller (som står for ca. 10% av alle SMA1 -tilfeller) i voksen alder. Langsiktig overlevelse i SMA type I er ikke tilstrekkelig dokumentert; Imidlertid synes fremskritt innen respiratorisk støtte å ha redusert dødeligheten fra 2007.
I ubehandlet SMA type II er sykdomsforløpet tregere å utvikle seg og forventet levealder er lavere enn den friske befolkningen. Døden før 20 -årsalderen er hyppig, selv om mange mennesker med SMA lever for å bli foreldre og besteforeldre. SMA type III har normal eller nesten normal levealder hvis omsorgsstandarder følges. Type IV, voksenstartet SMA betyr vanligvis bare nedsatt mobilitet og påvirker ikke forventet levetid.
Forskningsretninger
Siden den underliggende genetiske årsaken til SMA ble identifisert i 1995, har flere terapeutiske tilnærminger blitt foreslått og undersøkt som først og fremst fokuserer på å øke tilgjengeligheten av SMN -protein i motoriske nevroner. De viktigste forskningsretningene har vært som følger:
SMN1 generstatning
Genterapi i SMA tar sikte på å gjenopprette den SMN1 genfunksjon ved å sette inn spesiallaget nukleotid- sekvens (en SMN1 transgen ) inn i cellekjernen ved anvendelse av en viral vektor . Denne tilnærmingen har blitt utnyttet av den første godkjente genterapien for SMA, scAAV -9 -basert behandling onasemnogen abeparvovec.
SMN2 alternativ spleisemodulasjon
Denne tilnærmingen tar sikte på å modifisere den alternative spleisen av SMN2- genet for å tvinge det til å kode for en høyere prosentandel av SMN-protein i full lengde. Noen ganger kalles det også genkonvertering , fordi det prøver å konvertere SMN2 -genet funksjonelt til SMN1 -gen. Det er den terapeutiske mekanismen for de godkjente medisinene nusinersen og risdiplam.
Branaplam er en annen SMN2 -spleisemodulator som har nådd det kliniske utviklingsstadiet.
Historisk sett undersøkte denne forskningsretningen også andre molekyler. RG3039, også kjent som Quinazoline495, var et proprietært kinazolinderivat utviklet av Repligen og lisensiert til Pfizer i mars 2014 som ble avbrutt kort tid etter bare å ha fullført fase I -forsøk. PTK-SMA1 var en proprietær småmolekylerings spleisemodulator fra tetracyklingruppen utviklet av Paratek Pharmaceuticals og skulle gå inn i klinisk utvikling i 2010, men det skjedde imidlertid aldri. RG7800, utviklet av Hoffmann-La Roche, var et molekyl som ligner risdiplam som har gjennomgått fase I-testing, men ble avbrutt på grunn av dyretoksisitet. Tidlige leads inkluderte også natriumortovanadat og aclarubicin .
Morpholino -type antisense -oligonukleotider, med samme cellulære mål som nusinersen, er fortsatt gjenstand for forskning på behandling av SMA og andre enkeltgen -sykdommer, inkludert ved University College London og ved University of Oxford .
SMN2 genaktivering
Denne tilnærmingen tar sikte på å øke ekspresjon (aktivitet) av SMN2- genet, og dermed øke mengden av tilgjengelig SMN-protein i full lengde.
- Oral salbutamol (albuterol), et populært astmamedisin , viste terapeutisk potensial i SMA både in vitro og i tre småskala kliniske studier som involverte pasienter med SMA type 2 og 3, i tillegg til å tilby respiratoriske fordeler.
Noen få forbindelser viste opprinnelig lovende, men klarte ikke å demonstrere effekt i kliniske studier. Butyrater ( natriumbutyrat og natriumfenylbutyrat ) ga et løfte i in vitro -studier, men en klinisk studie med symptomatiske mennesker bekreftet ikke effekten. En annen klinisk studie med pre-symptomatisk type 1–2 spedbarn ble fullført i 2015, men ingen resultater er publisert.
- Valproinsyre (VPA) ble brukt i SMA på eksperimentell basis på 1990- og 2000 -tallet fordi in vitro -forskning antydet dets moderate effektivitet. Imidlertid viste det ingen effekt i oppnåelige konsentrasjoner når det ble utsatt for en stor klinisk studie. Det har også blitt foreslått at det kan være effektivt hos en undergruppe av mennesker med SMA, men virkningen kan bli undertrykt av fettsyretranslokase hos andre. Andre hevder at det faktisk kan forverre SMA -symptomer. Det brukes for tiden ikke på grunn av risikoen for alvorlige bivirkninger knyttet til langvarig bruk. En metaanalyse fra 2019 antydet at VPA kan tilby fordeler, selv uten å forbedre funksjonell poengsum.
- Hydroksykarbamid (hydroksyurea) ble vist effektivt i musemodeller og senere kommersielt undersøkt av Novo Nordisk , Danmark, men viste ingen effekt på mennesker med SMA i påfølgende kliniske studier.
Forbindelser som økte SMN2 aktivitet in vitro , men ikke gjøre det til et klinisk stadium inkludere veksthormon , forskjellige histondeacetylase inhibitorer , benzamid M344, hydroksamsyrer (CBHA, SBHA, entinostat , panobinostat , trichostatin A , vorinostat ), prolaktin , så vel som naturlig polyfenolforbindelser som resveratrol og curcumin . Celecoxib , en p38 pathway- aktivator, brukes noen ganger off-label av personer med SMA basert på en enkelt dyrestudie, men slik bruk støttes ikke av forskning på klinisk stadium.
SMN -stabilisering
SMN-stabilisering tar sikte på å stabilisere SMNΔ7-proteinet, det kortvarige defekte proteinet som er kodet av SMN2- genet, slik at det er i stand til å opprettholde nevronceller.
Ingen forbindelser er blitt videreført til det kliniske stadiet. Aminoglykosider viste evne til å øke tilgjengeligheten av SMN -proteiner i to studier. Indoprofen ga et løfte in vitro .
Nevrobeskyttelse
Nevrobeskyttende medisiner tar sikte på å muliggjøre overlevelse av motoriske nevroner selv med lave nivåer av SMN -protein.
- Olesoxime var en proprietær nevrobeskyttende forbindelse utviklet av det franske selskapet Trophos , senere kjøpt av Hoffmann-La Roche , som viste stabiliserende effekt i en fase II klinisk studie med mennesker med SMA type 2 og 3. Dens utvikling ble avbrutt i 2018 med tanke på konkurranse med nusinersen og dårligere enn forventet data som kommer fra en åpen utvidelsesforsøk.
Av klinisk undersøkte forbindelser som ikke viste effekt, holdt tyrotropinfrigivende hormon (TRH) noe løfte i en åpen, ukontrollert klinisk studie, men viste seg ikke å være effektiv i en påfølgende dobbeltblind placebokontrollert studie. Riluzole , et stoff som har en mild klinisk fordel ved amyotrofisk lateral sklerose , ble foreslått testet på samme måte i SMA; Imidlertid ble en studie fra 2008–2010 på SMA type 2 og 3 stoppet tidlig på grunn av mangel på tilfredsstillende resultater. Andre forbindelser som hadde en nevrobeskyttende effekt i in vitro- forskning, men som aldri flyttet til in vivo- studier, inkluderer β-laktamantibiotika (f.eks. Ceftriaxon ) og follistatin .
Muskel restaurering
Denne tilnærmingen tar sikte på å motvirke effekten av SMA ved å målrette muskelvevet i stedet for nevroner.
- Reldesemtiv (CK-2127107, CK-107) er en skeleton- troponinaktivator utviklet av Cytokinetics i samarbeid med Astellas . Legemidlet tar sikte på å øke muskelreaktiviteten til tross for redusert nevral signalering. Molekylet viste en viss suksess i fase II kliniske studier hos ungdom og voksne med SMA type 2, 3 og 4.
- Apitegromab (SRK-015) er monoklonalt antistoff som virker for å blokkere aktiveringen av et skjelettmuskelprotein myostatin , og derved fremme muskelvevsvekst. Fra og med 2021 viste molekylet suksess som en eksperimentell tilleggsbehandling hos barn og voksne pasienter behandlet med nusinersen.
Stamceller
Mens stamceller aldri utgjør en del av noen anerkjent behandling for SMA, benytter en rekke private selskaper, vanligvis lokalisert i land med slapp regulatorisk tilsyn, mediehype og markedsstamcelleinjeksjoner som en "kur" for en lang rekke lidelser , inkludert SMA. Den medisinske konsensus er at slike prosedyrer ikke gir noen klinisk fordel mens de bærer betydelig risiko, derfor blir personer med SMA frarådet dem. I 2013–2014 mottok et lite antall SMA1-barn i Italia domstolmandaterte stamcelleinjeksjoner etter utholdenhetssvindelen , men behandlingen ble rapportert uten effekt
Registre
Personer med SMA i EU kan delta i klinisk forskning ved å legge inn detaljene i registre som administreres av TREAT-NMD .
Se også
Referanser
Videre lesning
- Parano E, Pavone L, Falsaperla R, Trifiletti R, Wang C (august 1996). "Molekylært grunnlag for fenotypisk heterogenitet hos søsken med spinal muskelatrofi". Annals of Neurology . 40 (2): 247–51. doi : 10.1002/ana.410400219 . PMID 8773609 . S2CID 42514712 .
- Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (august 2007). "Konsensuserklæring for standard omsorg ved spinal muskelatrofi". Journal of Child Neurology . 22 (8): 1027–49. doi : 10.1177/0883073807305788 . PMID 17761659 . S2CID 6478040 .
Eksterne linker
| Klassifisering | |
|---|---|
| Eksterne ressurser |
- Spinal muskelatrofi ved Curlie
- SMA på NINDS


