TNT - TNT
|
|
|||

|
|||
| Navn | |||
|---|---|---|---|
|
Foretrukket IUPAC -navn
2-metyl-1,3,5-trinitrobenzen |
|||
| Andre navn
2,4,6-Trinitrotoluen
2,4,6-Trinitromethylbenzen 2,4,6-Trinitrotoluol TNT, Tolite, Trilite, Trinitrotoluol, Trinol, Tritolo, Tritolol, Triton, Tritone, Trotol, Trotyl |
|||
| Identifikatorer | |||
|
3D -modell ( JSmol )
|
|||
| Forkortelser | TNT | ||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard |
100.003.900 |
||
| EC -nummer | |||
| KEGG | |||
|
PubChem CID
|
|||
| RTECS -nummer | |||
| UNII | |||
| FN -nummer |
0209 - Tørr eller fuktet med <30% vann 0388, 0389 - Blandinger med trinitrobenzen, hexanitrostilbene |
||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C 7 H 5 N 3 O 6 | |||
| Molar masse | 227,132 g · mol −1 | ||
| Utseende | Lysegult fast stoff. Loose "nåler", flak eller priller før lige smelte casting . En solid blokk etter å ha blitt hellet i et foringsrør. | ||
| Tetthet | 1,654 g/cm 3 | ||
| Smeltepunkt | 80,35 ° C (176,63 ° F; 353,50 K) | ||
| Kokepunkt | 240,0 ° C (464,0 ° F; 513,1 K) (brytes ned) | ||
| 0,13 g/L (20 ° C) | |||
| Løselighet i eter , aceton , benzen , pyridin | løselig | ||
| Damptrykk | 0,0002 mmHg (20 ° C) | ||
| Eksplosive data | |||
| Støtfølsomhet | Ufølsom | ||
| Friksjon følsomhet | Ufølsom for 353 N | ||
| Detonasjonshastighet | 6900 m/s | ||
| RE -faktor | 1,00 | ||
| Farer | |||
| Sikkerhetsdatablad | ICSC 0967 | ||
| GHS -piktogrammer |
   
|
||
| GHS Signalord | Fare | ||
| H201 , H301 , H311 , H331 , H373 , H411 | |||
| P210 , P273 , P309+311 , P370+380 , P373 , P501 | |||
| NFPA 704 (brann diamant) | |||
| Dødelig dose eller konsentrasjon (LD, LC): | |||
|
LD 50 ( median dose )
|
795 mg/kg (rotte, oral) 660 (mus, oral) |
||
|
LD Lo ( lavest publisert )
|
500 mg/kg (kanin, oral) 1850 mg/kg (katt, oral) |
||
| NIOSH (amerikanske helseeksponeringsgrenser): | |||
|
PEL (tillatt)
|
TWA 1,5 mg/m 3 [hud] | ||
|
REL (anbefalt)
|
TWA 0,5 mg/m 3 [hud] | ||
|
IDLH (Umiddelbar fare)
|
500 mg/m 3 | ||
| Relaterte forbindelser | |||
|
Relaterte forbindelser
|
pikrinsyre heksanitrobenzen 2,4-Dinitrotoluen |
||
|
Med mindre annet er angitt, gis data for materialer i standardtilstand (ved 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Infobox -referanser | |||
Trinitrotoluen ( / ˌ t r aɪ ˌ n aɪ t r oʊ t ɒ lj u jeg n / ) mer vanlig kjent som TNT , eller mer spesifikt 2,4,6-trinitrotoluen , er en kjemisk forbindelse med formelen C 6 H 2 (NO 2 ) 3 CH 3 . Dette gule faste stoffet brukes tidvis som et reagens i kjemisk syntese, men det er best kjent som et eksplosivt materiale med praktiske håndteringsegenskaper. Det eksplosive utbyttet av TNT anses å være standard sammenlignende konvensjon for bomber og asteroider. I kjemi brukes TNT for å generere ladningsoverføringssalter .
Historie
TNT ble først fremstilt i 1863 av den tyske kjemikeren Julius Wilbrand og opprinnelig brukt som et gult fargestoff. Potensialet som eksplosiv ble ikke anerkjent på tre tiår, hovedsakelig fordi det var for vanskelig å detonere fordi det var mindre følsomt enn alternativer. Dens eksplosive egenskaper ble først oppdaget av en annen tysk kjemiker, Carl Häussermann, i 1891. TNT kan trygt helles når væske i skallkasser, og er så ufølsom at den ble unntatt fra Storbritannias eksplosivlov 1875 og ble ikke ansett som et eksplosiv for formål med produksjon og lagring.
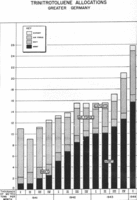
De tyske væpnede styrkene tok den som en fylling for artilleri skjell i 1902. TNT-fylt panserbrytende granater ville eksplodere etter at de hadde trengt rustning av britiske kapital skip , mens den britiske Lyddite -filled skjell tendens til å eksplodere på slående rustning, og dermed bruker mye av energien sin utenfor skipet. Britene begynte å erstatte Lyddite med TNT i 1907.
Den amerikanske marinen fortsatte å fylle rustningsgjennomtrengende skjell med eksplosiv D etter at noen andre nasjoner hadde byttet til TNT, men begynte å fylle marinegruver , bomber , dybdeladninger og torpedokriger med sprengladninger av råvare B TNT med fargen brunt sukker og som krever en eksplosiv boosterladning av granulatkrystallisert klasse A TNT for detonasjon. Høy-eksplosive granater ble fylt med klasse A TNT, som ble foretrukket for andre anvendelser som industriell kjemisk kapasitet ble tilgjengelig for fjerning av xylen og lignende hydrokarboner fra toluen råstoffet og andre nitrotoluen isomer biprodukter fra reaksjonene nitreringsmidler.
Detonasjon av 500 tonn TNT-eksplosjonsladning som en del av Operation Sailor Hat i 1965. Den forbigående eksplosjonsbølgen etterlot en hvit vannoverflate og en hvit kondenssky er synlig over hodet.
Forberedelse
I industrien produseres TNT i en tretrinnsprosess. Først toluen blir nitrert med en blanding av svovelsyre og salpetersyre for å produsere mononitrotoluene (MNT). MNT separeres og renitreres deretter til dinitrotoluen (DNT). I det siste trinnet nitreres DNT til trinitrotoluen (TNT) ved bruk av en vannfri blanding av salpetersyre og oleum . Salpetersyre forbrukes av produksjonsprosessen, men den fortynnede svovelsyren kan rekonsentreres og gjenbrukes. Etter nitrering stabiliseres TNT ved en prosess som kalles sulfitasjon, hvor den rå TNT -en behandles med vandig natriumsulfittoppløsning for å fjerne mindre stabile isomerer av TNT og andre uønskede reaksjonsprodukter. Skyllevannet fra sulfitasjon er kjent som rødt vann og er et betydelig forurensende og avfallsprodukt fra TNT -produksjon.
Kontroll av nitrogenoksider i fôrsalpetersyre er svært viktig fordi fritt nitrogendioksid kan resultere i oksidasjon av metylgruppen av toluen. Denne reaksjonen er svært eksoterm og medfører risikoen for at en løpsom reaksjon fører til en eksplosjon.
I laboratoriet produseres 2,4,6-trinitrotoluen i en totrinns prosess. En nitreringsblanding av konsentrerte salpetersyre og svovelsyre brukes til å nitrere toluen til en blanding av mono- og di-nitrotoluen-isomerer, med forsiktig avkjøling for å opprettholde temperaturen. De nitrerte toluenene separeres deretter, vaskes med fortynnet natriumbikarbonat for å fjerne nitrogenoksider og nitreres deretter forsiktig med en blanding av røykende salpetersyre og svovelsyre.
applikasjoner
TNT er et av de mest brukte sprengstoffene for militære, industrielle og gruvedrift. TNT har blitt brukt i forbindelse med hydraulisk brudd , en prosess som brukes til å utvinne olje og gass fra skiferformasjoner. Teknikken innebærer fortrengning og detonering av nitroglyserin i hydraulisk induserte brudd etterfulgt av brønnboringsskudd ved bruk av pelletisert TNT.
TNT er verdsatt delvis på grunn av dets ufølsomhet for sjokk og friksjon, med redusert risiko for utilsiktet detonasjon sammenlignet med mer følsomme eksplosiver som nitroglyserin . TNT smelter ved 80 ° C (176 ° F), langt under temperaturen den vil spontant detonere, slik at den kan helles eller trygt kombineres med andre eksplosiver. TNT verken absorberer eller oppløses i vann, noe som gjør at den kan brukes effektivt i våte miljøer. For å detonere må TNT utløses av en trykkbølge fra et startsprengstoff, kalt en eksplosiv booster .
Selv om blokker av TNT er tilgjengelige i forskjellige størrelser (f.eks. 250 g, 500 g, 1000 g), er det mer vanlig å finne det i synergistiske eksplosive blandinger som omfatter en variabel prosentandel av TNT pluss andre ingredienser. Eksempler på eksplosive blandinger som inneholder TNT inkluderer:
- Amatex : ( ammoniumnitrat og RDX )
- Amatol : (ammoniumnitrat)
- Ammonalt : (ammoniumnitrat og aluminiumspulver pluss noen ganger kull).
- Baratol : ( bariumnitrat og voks)
- Sammensetning B (RDX og parafinvoks)
- Sammensetning H6
- Syklotol (RDX)
- Ednatol
- Heksanitt ( heksanitrodifenylamin )
- Minol
- Octol
- Pentolitt
- Picratol
- Tetrytol
- Torpex
- Tritonal
Eksplosiv karakter
Ved detonasjon gjennomgår TNT en dekomponering som tilsvarer reaksjonen
- 2 C 7 H 5 N 3 O 6 → 3 N 2 + 5 H 2 + 12 CO + 2 C
pluss noen av reaksjonene
-
H
2+ CO → H
2O + C
og
- 2CO → CO
2 + C.
Reaksjonen er eksoterm, men har en høy aktiveringsenergi i gassfasen (~ 62 kcal/mol). De kondenserte fasene (fast eller flytende) viser markant lavere aktiveringsenergier på omtrent 35 kcal/mol på grunn av unike bimolekylære nedbrytningsveier ved forhøyede tettheter. På grunn av produksjonen av karbon har TNT -eksplosjoner et sotet utseende. Fordi TNT har et overskudd av karbon, kan eksplosive blandinger med oksygenrike forbindelser gi mer energi per kilo enn TNT alene. I løpet av 1900 -tallet var amatol , en blanding av TNT med ammoniumnitrat et mye brukt militært eksplosiv.
TNT kan detoneres med en initiator med høy hastighet eller ved effektiv hjernerystelse. I mange år pleide TNT å være referansepunktet for figuren av ufølsomhet . TNT hadde en vurdering på nøyaktig 100 på "F of I" -skalaen. Referansen er siden blitt endret til et mer følsomt eksplosiv som heter RDX , som har en F på I -vurdering på 80.
Energiinnhold

Detonasjonsvarmen som brukes av NIST til å definere et tonn TNT -ekvivalent er 1000 cal/g eller 1000 kcal/kg, 4,184 MJ/kg eller 4,184 GJ/tonn. Energitettheten til TNT brukes som referansepunkt for mange andre eksplosiver, inkludert atomvåpen, hvis energiinnhold måles i ekvivalente kiloton (~ 4,184 terajoules eller 4,184 TJ eller 1,162 GWh) eller megaton (~ 4,184 peta joule eller 4,184 PJ eller 1.162 TWh) av TNT. Forbrenningsvarmen er imidlertid 14,5 mega joule per kilo eller 14,5 MJ/kg eller 4,027 kWh/kg, noe som krever at noe av karbonet i TNT reagerer med atmosfærisk oksygen, noe som ikke forekommer i den første hendelsen.
Til sammenligning inneholder krutt 3 megajoule per kilo, dynamitt inneholder 7,5 megajoule per kilo, og bensin inneholder 47,2 megajoule per kilo (selv om bensin krever en oksidant , så en optimalisert bensin- og O 2 -blanding inneholder 10,4 megajoule per kilo).
Gjenkjenning
Ulike metoder kan brukes til å oppdage TNT, inkludert optiske og elektrokjemiske sensorer og eksplosive snusehunder. I 2013, forskere fra Indian Institute of Technology ved hjelp av edel-metall kan quantum klynger detektere TNT ved sub- zeptomolar (10 -18 mol / m 3 ) nivå.
Sikkerhet og giftighet
TNT er giftig, og hudkontakt kan forårsake hudirritasjon, slik at huden får en lys gul-oransje farge. Under første verdenskrig fant kvinnelige ammunisjonsarbeidere som håndterte kjemikaliet at huden ble lysegul, noe som resulterte i at de fikk kallenavnet " kanaripiker " eller ganske enkelt "kanarifugler".
Personer utsatt for TNT over en lengre periode har en tendens til å oppleve anemi og unormale leverfunksjoner . Blod og levereffekter, milt forstørrelse og andre skadelige effekter på immunsystemet har også blitt funnet i dyr som fordøyet eller åndet trinitrotoluen. Det er tegn på at TNT påvirker mannlig fruktbarhet negativt . TNT er oppført som et mulig kreftfremkallende menneske , med kreftfremkallende effekter påvist i dyreforsøk med rotter, selv om effekter på mennesker så langt ikke er noen (ifølge IRIS 15. mars 2000). Forbruk av TNT produserer rød urin ved tilstedeværelse av nedbrytningsprodukter og ikke blod som noen ganger tror.
Noen militære testområder er forurenset med avløpsvann fra ammunisjonsprogrammer, inkludert forurensning av overflate- og undergrunnsvann som kan være farget rosa på grunn av tilstedeværelsen av TNT. Slik forurensning, kalt "rosa vann", kan være vanskelig og dyrt å bøte på .
TNT er utsatt for utsondring av dinitrotoluenes og andre isomerer av trinitrotoluen når prosjektiler som inneholder TNT lagres ved høyere temperaturer i varmere klima. Eksudasjon av urenheter fører til dannelse av porer og sprekker (som igjen forårsaker økt sjokkfølsomhet). Migrering av den exudated væske inn i tennrøret skruegjengen kan danne brannkanaler , noe som øker faren for utilsiktet detonasjon. Fuze -funksjonsfeil kan også skyldes at væsken migrerer inn i brenningsmekanismen. Kalsiumsilikat blandes med TNT for å dempe tendensen til ekssudasjon.
Rosa og rødt vann
Rosa vann og rødt vann er to forskjellige typer avløpsvann relatert til trinitrotoluen. Rosa vann produseres fra vaskeprosesser av utstyr etter påfylling eller demilitarisering av ammunisjon , og er som sådan generelt mettet med den maksimale mengden TNT som vil oppløses i vann (ca. 150 deler per million (ppm).) Imidlertid har den en ubestemt sammensetning som avhenger av den eksakte prosessen; spesielt kan den også inneholde cyklotrimetylentetrinitramin (RDX) hvis anlegget bruker TNT/RDX -blandinger, eller HMX hvis TNT/HMX brukes. Rødt vann (også kjent som "Sellittvann") produseres under prosessen som brukes til å rense rå TNT. Den har en kompleks sammensetning som inneholder mer enn et dusin aromatiske forbindelser, men hovedkomponentene er uorganiske salter ( natriumsulfat , natriumsulfitt , natriumnitrat og natriumnitrat ) og sulfonerte nitroaromater .
Rosa vann er faktisk fargeløst på generasjonstidspunktet, mens rødt vann kan være fargeløst eller veldig blekt rødt. Fargen produseres ved fotolytiske reaksjoner under påvirkning av sollys. Til tross for navnene er ikke rødt og rosa vann nødvendigvis forskjellige nyanser; fargen avhenger hovedsakelig av varigheten av soleksponering. Hvis det blir eksponert lenge nok, vil "rosa" vann bli mørkt brunt.
På grunn av TNT -toksisiteten har utslipp av rosa vann til miljøet vært forbudt i USA og mange andre land i flere tiår, men forurensning av bakken kan forekomme i svært gamle planter. Imidlertid anses RDX og tetryl -forurensning vanligvis som mer problematisk, ettersom TNT har svært lav jordmobilitet . Rødt vann er betydelig mer giftig, og som sådan har det alltid blitt ansett som farlig avfall. Det har tradisjonelt blitt kastet ved fordampning til tørrhet (ettersom de giftige komponentene ikke er flyktige), etterfulgt av forbrenning. Mye forskning har blitt utført for å utvikle bedre avhendingsprosesser.
Økologisk påvirkning
På grunn av sin egnethet i konstruksjon og riving har TNT blitt det mest brukte eksplosivet, og derfor er toksisiteten den mest karakteriserte og rapporterte. Resterende TNT fra produksjon, lagring og bruk kan forurense vann, jord, atmosfære og biosfære .
Konsentrasjonen av TNT i forurenset jord kan nå 50 g/kg jord, hvor de høyeste konsentrasjonene kan bli funnet på eller i nærheten av overflaten. I september 2001 erklærte United States Environmental Protection Agency (USEPA) TNT som et forurensende stoff hvis fjerning er prioritert. USEPA fastholder at TNT -nivåene i jord ikke bør overstige 17,2 gram per kilo jord og 0,01 milligram per liter vann.
Vandig løselighet
Oppløsning er et mål på hastigheten som fast TNT i kontakt med vann oppløses. Den relativt lave vandige løseligheten av TNT fører til at oppløsningen av faste partikler frigjøres kontinuerlig til miljøet over lengre tidsperioder. Studier har vist at TNT løste seg langsommere i saltvann enn i ferskvann. Men når saltholdigheten ble endret, løste TNT seg opp med samme hastighet (figur 2). Fordi TNT er moderat løselig i vann, kan det vandre gjennom jord under jorden og forårsake forurensning av grunnvann .
Jordadsorpsjon
Adsorpsjon er et mål på fordelingen mellom oppløselige og sedimentadsorberte forurensninger etter oppnåelse av likevekt. TNT og dets transformasjonsprodukter er kjent for å absorbere til overflatejord og sedimenter, der de gjennomgår reaktiv transformasjon eller forblir lagret. Bevegelsen eller organiske forurensninger gjennom jord er en funksjon av deres evne til å assosiere seg med den mobile fasen (vann) og den stasjonære fasen (jord). Materialer som forbinder sterkt med jord beveger seg sakte gjennom jord. Materialer som forbinder sterkt med vann beveger seg gjennom vann med hastigheter som nærmer seg grunnvannbevegelsen.
Foreningskonstanten for TNT med jord er 2,7 til 11 liter per kilo jord. Dette betyr at TNT har en en til ti ganger tendens til å feste seg til jordpartikler enn ikke når den føres inn i jorden. Hydrogenbinding og ionebytte er to foreslåtte mekanismer for adsorpsjon mellom nitrofunksjonelle grupper og jordkolloider.
Antall funksjonelle grupper på TNT påvirker evnen til å absorbere i jord. Adsorpsjonskoeffisientverdiene har vist seg å øke med en økning i antall aminogrupper. Således var adsorpsjonen av TNT-nedbrytningsproduktet 2,4-diamino-6-nitrotoluen (2,4-DANT) større enn for 4-amino-2,6-dinitrotoluen (4-ADNT), som var større enn for TNT. Lavere adsorpsjonskoeffisienter for 2,6-DNT sammenlignet med 2,4-DNT kan tilskrives den steriske hindringen for NO 2- gruppen i ortoposisjonen .
Forskning har vist at i ferskvannsmiljøer, med store mengder Ca 2+ , kan adsorpsjonen av TNT og dets transformasjonsprodukter til jord og sedimenter være lavere enn observert i et saltvannsmiljø, dominert av K + og Na + . Derfor, når man vurderer adsorpsjon av TNT, er jordtypen eller sedimentet og grunnvannets ioniske sammensetning og styrke viktige faktorer.
Foreningskonstantene for TNT og dets nedbrytningsprodukter med leire er bestemt. Leirmineraler har en betydelig effekt på adsorpsjonen av energiske forbindelser. Jordegenskaper, for eksempel organisk karboninnhold og kationbyttekapasitet, hadde betydelige virkninger av adsorpsjonskoeffisientene som er rapportert i tabellen nedenfor.
Ytterligere studier har vist at mobiliteten til TNT -nedbrytningsprodukter sannsynligvis vil være lavere "enn TNT i undergrunnsmiljøer der spesifikk adsorpsjon til leiremineraler dominerer sorpsjonsprosessen." Således er mobiliteten til TNT og dets transformasjonsprodukter avhengig av egenskapene til sorbenten. Mobiliteten til TNT i grunnvann og jord er ekstrapolert fra "sorpsjon og desorpsjon isoterm modeller bestemt med humussyrer , i akvifer sedimenter og jord". Fra disse modellene er det spådd at TNT har lav oppbevaring og transporterer lett i miljøet.
Sammenlignet med andre eksplosiver har TNT en høyere assosiasjonskonstant med jord, noe som betyr at den fester mer med jord enn med vann. Motsatt kan andre eksplosiver, for eksempel RDX og HMX med lave assosiasjonskonstanter (fra 0,06 til 7,3 L/kg og 0 til 1,6 L/kg) bevege seg raskere i vann.
Kjemisk nedbrytning
TNT er et reaktivt molekyl og er spesielt utsatt for å reagere med reduserte komponenter av sedimenter eller fotodegradering i nærvær av sollys. TNT er termodynamisk og kinetisk i stand til å reagere med et stort antall komponenter i mange miljøsystemer. Dette inkluderer helt abiotiske reaktanter, som fotoner , hydrogensulfid , Fe 2+ eller mikrobielle samfunn, både oksiske og anoksiske.
Jord med høyt leireinnhold eller små partikkelstørrelser og høyt totalt organisk karboninnhold har vist seg å fremme TNT -transformasjon. Mulige TNT-transformasjoner inkluderer reduksjon av en, to eller tre nitro-enheter til aminer og kobling av aminotransformasjonsprodukter for å danne dimerer . Dannelse av de to monoamino-transformasjonsproduktene, 2-ADNT og 4-ADNT er energisk favoriserte, og observeres derfor i forurenset jord og grunnvann. Diamino -produktene er energisk mindre gunstige, og enda mindre sannsynlig er triamino -produktene.
Transformasjonen av TNT forbedres betydelig under anaerobe forhold så vel som under sterkt reduserende forhold. TNT -transformasjoner i jord kan forekomme både biologisk og abiotisk.
Fotolyse er en viktig prosess som påvirker transformasjonen av energiske forbindelser. Endringen av et molekyl i fotolyse skjer i nærvær av direkte absorpsjon av lysenergi ved overføring av energi fra en fotosensibilisert forbindelse. Fototransformasjon av TNT "resulterer i dannelse av nitrobenzener , benzaldehyder , azodikarboksylsyrer og nitrofenoler , som et resultat av oksidasjon av metylgrupper , reduksjon av nitrogrupper og dimerdannelse."
Det er sett bevis på fotolysen av TNT på grunn av fargeendringen til rosa i avløpsvannet når det utsettes for sollys. Fotolyse var raskere i elvevann enn i destillert vann. Til syvende og sist påvirker fotolyse skjebnen til TNT først og fremst i vannmiljøet, men kan også påvirke reaksjonen når den utsettes for sollys på jordoverflaten.
Bionedbrytning
Den ligninolytiske fysiologiske fasen og manganperoksidasesystemet av sopp kan forårsake en svært begrenset mengde mineralisering av TNT i en flytende kultur; men ikke i jord. En organisme som er i stand til å utbedre store mengder TNT i jord har ennå ikke blitt oppdaget. Både ville og transgene planter kan fytoremediere sprengstoff fra jord og vann.
TNT i populærkulturen
- I spillet Angry Birds vises TNT som en trekasse som eksploderer når den blir slått.
- I spillet Minecraft vises TNT som mange røde dynamittpinner pakket sammen. TNT i Minecraft er laget av sand og krutt, og eksploderer med en forsinkelse etter å ha blitt antent med ild eller satt av andre eksplosiver innenfor en viss radius.
- I spillet Donkey Kong Country og oppfølgerne kan trefat fylt med TNT kastes mot fiender for å forårsake en eksplosjon. TNT fat kan også brukes til å bryte gjennom vegger og få tilgang til skjulte områder.
- I " Crash Bandicoot " -spillene er TNT -bokser bokser som vil drepe spilleren hvis de spinner inn i dem, men å hoppe på dem vil begynne en nedtelling som vil eksplodere boksen.
- TP-200 TNT brick er TNT i spillet Escape from Tarkov . Den vises som en gul murstein i spillet og brukes til seismiske undersøkelser.
- I Battlefield Vietnam , en del i Battlefield Series , er TNT avbildet som tre røde pinner bundet i begge ender av svarte stropper. Den har sikringer på hver pinne og brukes enten som granat eller plantet eksplosiv.
- TNT 600g Explosive er en riveavgift i game Squad .
Se også
- TNT -ekvivalent
- RE -faktor
- Liste over sprengstoff som ble brukt under andre verdenskrig
- Dynamitt
- IMX-101
- Tabell over eksplosive detonasjonshastigheter
- Flegmatisert
- Miljøskjebnen til TNT
Referanser
Eksterne linker
- Dynamitt og TNT ved The Periodic Table of Videos (University of Nottingham)
- youtube.com -video som viser sjokkbølgen og den typiske sorte røykskyen fra detonasjon av 160 kilo ren TNT
- CDC - NIOSH Pocket Guide to Chemical Hazards