X -inaktivering - X-inactivation

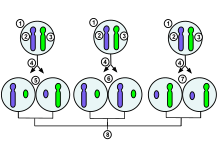
1. embryonale celle i et tidlig stadium av et kvinnelig menneske 2.
maternal x-kromosom
3. paternal x-kromosom
4. mitose og tilfeldig inaktivering av x-kromosom
5. paternalt kromosom inaktiveres tilfeldig i den ene dattercellen, mors kromosom inaktiveres i de andre
6 .Paternelt kromosom inaktiveres tilfeldig i begge dattercellene
7.Materielt kromosom inaktiveres tilfeldig i begge dattercellene
8.Tre mulige tilfeldige kombinasjonsresultater
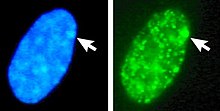
Venstre: DNA (DAPI) -farget kjerne. Pil indikerer plasseringen av Barr -kroppen (Xi). Høyre: DNA -assosiert histonesprotein påvist
X-inaktivering (også kalt Lyonization , etter engelsk genetiker Mary Lyon ) er en prosess der en av kopier av X-kromosomet inaktivert i reffereres kvinnelige pattedyr . Det inaktive X -kromosomet blir dempet ved at det blir pakket inn i en transkripsjonelt inaktiv struktur kalt heterokromatin . Da nesten alle hunnpattedyr har to X kromosomer, X-inaktive hindrer dem fra å ha dobbelt så mange X-kromosomet genprodukter som hanner , som bare utviser en enkelt kopi av X-kromosomet (se dosering kompensasjon ).
Valget av hvilket X -kromosom som skal inaktiveres er tilfeldig hos placentapattedyr som mennesker , men når et X -kromosom er inaktivert vil det forbli inaktivt gjennom cellens levetid og dets etterkommere i organismen (cellelinjen). X-inaktivering som er ujevnt fordelt over cellelinjer i en organisme ( skjev X-inaktivering ) forekommer ofte.
I motsetning til tilfeldig X-inaktivering hos placentapattedyr, gjelder inaktivering i pungdyr utelukkende for det paternalt avledede X-kromosomet.
Mekanisme
Syklus for X-kromosomaktivering hos gnagere
Avsnittene nedenfor har bare å gjøre med gnagere og gjenspeiler ikke XI hos de fleste pattedyr. X-inaktivering er en del av aktiveringssyklusen til X-kromosomet gjennom hele kvinnelivet. Egget og den befruktede zygoten bruker opprinnelig mors transkripsjoner, og hele det embryonale genomet blir taus inntil zygotisk genomaktivering. Deretter gjennomgår alle museceller en tidlig, påtrykt inaktivering av det paternalt avledede X-kromosomet i 4-8 celletrinnsembryoer . De ekstraembryoniske vevene (som gir opphav til morkaken og andre vev som støtter embryoet) beholder denne tidlige påtrykte inaktiveringen, og dermed er bare mors X -kromosom aktivt i disse vevene.
I den tidlige blastocysten reverseres denne første, påtrykte X-inaktiveringen i cellene i den indre cellemassen (som gir opphav til embryoet), og i disse cellene blir begge X-kromosomene aktive igjen. Hver av disse cellene inaktiverer deretter uavhengig og tilfeldig en kopi av X -kromosomet. Denne inaktiveringshendelsen er irreversibel i løpet av individets levetid, med unntak av kimlinjen. I den kvinnelige kimlinjen før meiotisk inntreden reverseres X-inaktivering, slik at alle haploide oocytter etter meiose inneholder et enkelt aktivt X-kromosom.
Oversikt
Den Xi markerer den inaktive, Xa aktive X-kromosomet. X P betegner faderlig, og X M betegner mors X -kromosom. Når egget (bærende X M ) blir befruktet av en sæd (bærer et Y eller et X P ) dannes en diploid zygote. Fra zygote, gjennom voksenstadiet, til neste generasjon egg, gjennomgår X -kromosomet følgende endringer:
- Xi P Xi M zygote → gjennomgår zygotisk genomaktivering , noe som fører til:
- Xa P Xa M → gjennomgår påtrykt (faderlig) X-inaktivering , noe som fører til:
- Xi P Xa M → undergår X-aktivering i det tidlige blastocyststadiet , noe som fører til:
- Xa P Xa M → undergår tilfeldig X-inaktivering i den embryonale slekten (indre cellemasse) i blastocyststadiet, noe som fører til:
- Xi P Xa M ELLER Xa P Xi M → undergår X-reaktivering i urkimceller før meiose , noe som fører til:
- Xa M Xa P diploide kimceller i meiotisk arrest. Siden meiosen jeg bare fullfører med eggløsning , eksisterer menneskelige kimceller i dette stadiet fra de første utviklingsukene til puberteten. Fullføring av meiose fører til:
- Xa M OG Xa P haploide kimceller (egg).
X -aktiveringssyklusen har blitt best studert hos mus, men det er flere studier på mennesker. Siden det meste av bevisene kommer fra mus, representerer skjemaet ovenfor hendelsene hos mus. Fullførelsen av meiosen er forenklet her for klarhet. Trinn 1–4 kan studeres i in vitro -befruktede embryoer og i differensierende stamceller; X-reaktivering skjer i det utviklende embryoet, og påfølgende (6–7) trinn inne i kvinnekroppen, derfor mye vanskeligere å studere.
Timing
Tidspunktet for hver prosess avhenger av arten, og i mange tilfeller diskuteres den nøyaktige tiden aktivt. [Hele delen av den menneskelige timingen for X-inaktivering i denne tabellen er svært tvilsom og bør fjernes til den er godt underbygget av empiriske data]
| Prosess | Mus | Menneskelig | |
| 1 | Aktivering av zygotisk genom | 2-4 celletrinn | 2–8 celletrinn |
| 2 | Påtrykt (farlig) X-inaktivering | 4-8 celletrinn | Uklart om det finner sted hos mennesker |
| 3 | X-aktivering | Tidlig blastocyststadium | Tidlig blastocyststadium |
| 4 | Tilfeldig X-inaktivering i den embryonale slekten (indre cellemasse) | Sent blastocyststadium | Sent blastocyststadium, etter implantasjon |
| 5 | X-reaktivering i urkimceller før meiose | Fra før utviklingsuke 4 til uke 14 |
Arv av inaktiveringsstatus på tvers av cellegenerasjoner
Etterkommerne til hver celle som inaktiverte et bestemt X -kromosom, vil også inaktivere det samme kromosomet. Dette fenomenet, som kan observeres i fargen på skilpaddeskatter når hunner er heterozygote for det X-koblede genet , bør ikke forveksles med mosaikk , som er et begrep som spesifikt refererer til forskjeller i genotypen til forskjellige cellepopulasjoner i samme individuell; X-inaktivering, som er en epigenetisk endring som resulterer i en annen fenotype, er ikke en endring på genotypisk nivå. For en individuell celle eller avstamning er inaktiveringen derfor skjev eller ' ikke-tilfeldig ', og dette kan gi opphav til milde symptomer hos kvinnelige 'bærere' av X-koblede genetiske lidelser.
Valg av ett aktivt X -kromosom
Normale hunner har to X -kromosomer, og i en gitt celle vil ett kromosom være aktivt (betegnet Xa) og ett vil være inaktivt (Xi). Studier av individer med ekstra kopier av X -kromosomet viser imidlertid at det i celler med mer enn to X -kromosomer fortsatt bare er ett Xa, og alle de resterende X -kromosomene er inaktiverte. Dette indikerer at standardtilstanden til X -kromosomet hos kvinner er inaktivering, men ett X -kromosom er alltid valgt for å forbli aktivt.
Det er forstått at inaktivering av X-kromosom er en tilfeldig prosess som forekommer på omtrent tidspunktet for gastrulering i epiblasten (celler som vil gi opphav til embryoet). Mors og fars X -kromosomer har like stor sannsynlighet for inaktivering. Dette antyder at kvinner forventes å lide av X-koblede lidelser omtrent 50% så ofte som menn (fordi kvinner har to X-kromosomer, mens menn bare har ett); men i virkeligheten er forekomsten av disse lidelsene hos kvinner mye lavere enn det. En forklaring på denne forskjellen er at 12–20% av genene på det inaktiverte X-kromosomet forblir uttrykt, og gir dermed kvinner ekstra beskyttelse mot defekte gener kodet av X-kromosomet. Noen antyder at denne forskjellen må være et bevis på foretrukket (ikke-tilfeldig) inaktivering. Foretrukket inaktivering av det faderlige X-kromosomet forekommer i både pungdyr og i cellelinjer som danner membranene som omgir embryoet, mens hos placentapattedyr enten det maternale eller det paternalt avledede X-kromosomet kan inaktiveres i forskjellige cellelinjer.
Tidsperioden for inaktivering av X-kromosom forklarer denne forskjellen. Inaktivering skjer i epiblasten under gastrulering, noe som gir opphav til embryoet. Inaktivering skjer på cellenivå, noe som resulterer i et mosaikkuttrykk, der flekker av celler har et inaktivt mors X-kromosom, mens andre flekker har et inaktivt faderlig X-kromosom. For eksempel vil en kvinnelig heterozygot for hemofili (en X-koblet sykdom) få omtrent halvparten av levercellene til å fungere skikkelig, noe som vanligvis er nok til å sikre normal blodpropp. Sjanse kan resultere i betydelig flere dysfunksjonelle celler; Imidlertid er slike statistiske ekstremer usannsynlige. Genetiske forskjeller på kromosomet kan også gjøre et X-kromosom mer sannsynlig å gjennomgå inaktivering. Hvis et X-kromosom har en mutasjon som hindrer veksten eller gjør det ikke levedyktig, vil celler som tilfeldig inaktiverte X ha en selektiv fordel i forhold til celler som tilfeldig inaktiverte den normale allelen. Selv om inaktivering i utgangspunktet er tilfeldig, vil celler som inaktiverer en normal allel (slik at den muterte allelen er aktiv) til slutt bli overgrodd og erstattet av funksjonelt normale celler der nesten alle har det samme X-kromosomet aktivert.
Det antas at det er en autosomalt kodet 'blokkeringsfaktor' som binder seg til X-kromosomet og forhindrer inaktivering av det. Modellen postulerer at det er en begrensende blokkeringsfaktor, så når det tilgjengelige blokkeringsfaktormolekylet binder seg til ett X -kromosom, er de gjenværende X -kromosomene ikke beskyttet mot inaktivering. Denne modellen støttes av eksistensen av et enkelt Xa i celler med mange X -kromosomer og av eksistensen av to aktive X -kromosomer i cellelinjer med dobbelt det normale antallet autosomer.
Sekvenser ved X -inaktiveringssenteret ( XIC ), som er tilstede på X -kromosomet, styrer lyddemping av X -kromosomet. Den hypotetiske blokkeringsfaktoren er spådd å binde seg til sekvenser i XIC.
Uttrykk for X-koblede lidelser hos heterozygote kvinner
Effekten av heterozygositet hos kvinner er tydelig i noen lokaliserte trekk, for eksempel det unike pelsmønsteret til en kalikokatt. Det kan imidlertid være vanskeligere å fullt ut forstå uttrykket for ikke-lokaliserte trekk hos disse hunnene, for eksempel uttrykk for sykdom.
Siden hanner bare har én kopi av X-kromosomet, er alle uttrykte X-kromosomale gener (eller alleler , i tilfelle av flere variantformer for et gitt gen i befolkningen) på den kopien av kromosomet. Hunnene vil imidlertid først og fremst uttrykke gener eller alleler som befinner seg på den X-kromosomale kopien som forblir aktiv. Med tanke på situasjonen for ett gen eller flere gener som forårsaker individuelle forskjeller i en bestemt fenotype (dvs. forårsaker variasjon observert i populasjonen for den fenotypen), er det hos homozygote hunner ikke spesielt viktig hvilken kopi av kromosomet som er inaktivert, ettersom allelene på begge eksemplarer er de samme. Hos kvinner som er heterozygote ved årsaksgenene, kan imidlertid inaktivering av en kopi av kromosomet over den andre ha en direkte innvirkning på deres fenotypiske verdi. På grunn av dette fenomenet er det en observert økning i fenotypisk variasjon hos hunner som er heterozygote ved det eller de involverte genene enn hos kvinner som er homozygote ved det eller disse genene. Det er mange forskjellige måter som den fenotypiske variasjonen kan utspille seg på. I mange tilfeller kan heterozygote kvinner være asymptomatiske eller bare presentere mindre symptomer på en gitt lidelse, for eksempel med X-koblet adrenoleukodystrofi.
Differensiering av fenotype hos heterozygote hunner fremmes av tilstedeværelsen av X-inaktiveringsskjevhet. Vanligvis dempes hvert X-kromosom i halvparten av cellene, men denne prosessen er skjev når fortrinnsvis inaktivering av et kromosom oppstår. Det antas at skjevhet skjer enten ved en tilfeldighet eller ved en fysisk egenskap ved et kromosom som kan føre til at det blir dempet mer eller mindre ofte, for eksempel en ugunstig mutasjon.
I gjennomsnitt inaktiveres hvert X-kromosom i halvparten av cellene, men 5-20% av "tilsynelatende normale" kvinner viser X-inaktivering. I tilfeller der skjevhet er tilstede, kan et bredt spekter av symptomuttrykk forekomme, noe som resulterer i at uttrykket varierer fra mindre til alvorlig, avhengig av skjevheten. Et ekstremt tilfelle av dette ble sett der monozygotiske tvillinger av kvinner hadde ekstrem variasjon i uttrykk for Menkes sykdom (en X-koblet lidelse) som resulterte i døden til den ene tvillingen mens den andre forble asymptomatisk.
Det antas at X-inaktivering-skjevhet kan skyldes problemer i mekanismen som forårsaker inaktivering, eller av problemer i selve kromosomet. Imidlertid stilles det fortsatt spørsmålstegn ved sammenhengen mellom fenotype og skjevhet, og bør undersøkes fra sak til sak. En studie som så på både symptomatiske og asymptomatiske kvinner som var heterozygote for Duchenne og Becker muskeldystrofier (DMD) fant ingen tilsynelatende sammenheng mellom transkriptuttrykk og skjev X-inaktivering. Studien antyder at begge mekanismene er uavhengig regulert, og at det er andre ukjente faktorer som spiller inn.
Kromosomal komponent
X-inaktiveringssenteret (eller ganske enkelt XIC) på X-kromosomet er nødvendig og tilstrekkelig for å forårsake X-inaktivering. Kromosomale translokasjoner som plasserer XIC på et autosom fører til inaktivering av autosomet, og X -kromosomer som mangler XIC, blir ikke inaktivert.
XIC inneholder fire ikke- oversatte RNA- gener, Xist , Tsix , Jpx og Ftx , som er involvert i X-inaktivering. XIC inneholder også bindingssteder for både kjente og ukjente regulatoriske proteiner .
Xist og Tsix RNA
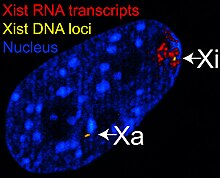
Det X-inaktive spesifikke transkripsjon ( Xist ) -genet koder for et stort ikke-kodende RNA som er ansvarlig for å formidle den spesifikke dempingen av X-kromosomet som det transkriberes fra. Det inaktive X -kromosomet er belagt med Xist RNA, mens Xa ikke er det (se figur til høyre). X -kromosomer som mangler Xist -genet kan ikke inaktiveres. Kunstig plassering og uttrykk av Xist -genet på et annet kromosom fører til at det kromosomet blir dempet.
Før inaktivering uttrykker begge X -kromosomene Xist RNA svakt fra Xist -genet. Under inaktiveringsprosessen slutter den fremtidige Xa å uttrykke Xist, mens den fremtidige Xi dramatisk øker Xist RNA -produksjonen. På den fremtidige Xi belegger Xist RNA kromosomet gradvis og sprer seg ut fra XIC; Xist RNA lokaliserer seg ikke til Xa. Den stanse av gener langs Xi opptrer kort tid etter belegning av Xist RNA.
I likhet med Xist koder Tsix -genet for et stort RNA som ikke antas å kode for et protein. Tsix RNA transkriberes antisense til Xist, noe som betyr at Tsix -genet overlapper Xist -genet og transkriberes på den motsatte DNA -strengen fra Xist -genet. Tsix er en negativ regulator av Xist; X -kromosomer som mangler Tsix -uttrykk (og dermed har høye nivåer av Xist -transkripsjon) inaktiveres mye oftere enn normale kromosomer.
I likhet med Xist, før inaktivering, uttrykker begge X -kromosomer svakt Tsix RNA fra Tsix -genet. Ved begynnelsen av X-inaktivering slutter den fremtidige Xi å uttrykke Tsix RNA (og øker Xist uttrykk), mens Xa fortsetter å uttrykke Tsix i flere dager.
Rep A er et langt ikke -kodende RNA som fungerer med et annet langt ikke -kodende RNA, Xist, for X inaktivering. Rep A hemmer funksjonen til Tsix, antisens til Xist, i forbindelse med eliminering av ekspresjon av Xite. Det fremmer metylering av Tsix -regionen ved å tiltrekke seg PRC2 og dermed inaktivere et av X -kromosomene.
Demping
Det inaktive X -kromosomet uttrykker ikke flertallet av genene, i motsetning til det aktive X -kromosomet. Dette skyldes demping av Xi ved undertrykkende heterokromatin , som komprimerer Xi -DNA og forhindrer uttrykk for de fleste gener.
Sammenlignet med Xa har Xi høye nivåer av DNA-metylering , lave nivåer av histonacetylering , lave nivåer av histon H3 lysin-4 metylering og høye nivåer av histon H3 lysin-9 metylering og H3 lysin-27 metyleringsmerke som er plassert av PRC2 -komplekset rekruttert av Xist , som alle er assosiert med gendemping. PRC2 regulerer kromatinkomprimering og omdannelse av kromatin i flere prosesser, inkludert DNA -skaderesponsen . I tillegg finnes en histonvariant kalt macroH2A ( H2AFY ) utelukkende på nukleosomer langs Xi.
Barr -kropper
DNA pakket i heterochromatin, for eksempel Xi, er mer kondensert enn DNA pakket i euchromatin , for eksempel Xa. Den inaktive X danner en diskret kropp i kjernen som kalles en Barr -kropp . Barr -kroppen er vanligvis lokalisert i kjernens periferi , replikerer sent i cellesyklusen , og inneholder, som den inneholder Xi, heterokromatinmodifikasjoner og Xist RNA.
Uttrykte gener på det inaktive X -kromosomet
En brøkdel av genene langs X -kromosomet slipper unna inaktivering på Xi. Xist -genet uttrykkes ved høye nivåer på Xi og uttrykkes ikke på Xa. Mange andre gener slipper unna inaktivering; noen uttrykkes likt fra Xa og Xi, og andre, mens de uttrykkes fra begge kromosomene, er fremdeles hovedsakelig uttrykt fra Xa. Opptil en fjerdedel av genene på den menneskelige Xi er i stand til å rømme. Studier av musen tyder på at i en gitt celletype slipper 3% til 15% av genene fra inaktivering, og at rømmende genidentitet varierer mellom vev.
Mange av genene som slipper unna inaktivering er tilstede langs regioner av X -kromosomet som, i motsetning til de fleste av X -kromosomet, inneholder gener som også er tilstede på Y -kromosomet . Disse regionene kalles pseudoautosomale regioner, ettersom individer av begge kjønn vil motta to kopier av hvert gen i disse regionene (som et autosom), i motsetning til de fleste gener langs kjønnskromosomene. Siden individer av begge kjønn vil motta to kopier av hvert gen i en pseudoautosomal region , er det ikke nødvendig med doseringskompensasjon for kvinner, så det antas at disse DNA-områdene har utviklet mekanismer for å unnslippe X-inaktivering. Genene til pseudoautosomale regioner i Xi har ikke de typiske modifikasjonene av Xi og har lite Xist RNA bundet.
Eksistensen av gener langs det inaktive X som ikke blir dempet forklarer feilene hos mennesker med unormale mengder X -kromosom, for eksempel Turners syndrom (X0) eller Klinefelter syndrom (XXY). Teoretisk sett bør X-inaktivering eliminere forskjellene i gentosering mellom berørte individer og personer med et normalt kromosomkomplement. Hos berørte individer er imidlertid X-inaktivering ufullstendig, og doseringen av disse ikke-dempede genene vil variere ettersom de unnslipper X-inaktivering, som ligner på en autosomal aneuploidi .
De nøyaktige mekanismene som styrer flukt fra X-inaktivering er ikke kjent, men stille og rømningsområder har vist seg å ha forskjellige kromatinmerker. Det har blitt antydet at flukt fra X-inaktivering kan formidles ved uttrykk for langt ikke-kodende RNA (lncRNA) innenfor de rømmende kromosomale domenene.
Bruk i eksperimentell biologi
Stanley Michael Gartler brukte inaktivering av X-kromosom for å demonstrere den klonale opprinnelsen til kreft. Undersøkelse av normale vev og svulster fra hunner heterozygote for isoenzymer av det kjønnsbundne G6PD- genet viste at tumorceller fra slike individer bare uttrykker én form for G6PD, mens normale vev består av en nesten like blanding av celler som uttrykker de to forskjellige fenotypene. Dette mønsteret antyder at en enkelt celle, og ikke en populasjon, vokser til kreft. Imidlertid har dette mønsteret blitt bevist feil for mange krefttyper, noe som tyder på at noen kreftformer kan være polyklonale.
Dessuten anses måling av metylering (inaktivering) status for den polymorfe humane androgenreseptoren (HUMARA) som ligger på X-kromosom som den mest nøyaktige metoden for å vurdere klonalitet i kvinnelige kreftbiopsier. Et stort utvalg av svulster ble testet ved denne metoden, noen, for eksempel nyrecellekarsinom, ble funnet monoklonale mens andre (f.eks. Mesoteliom) ble rapportert polyklonale.
Forskere har også undersøkt bruk av X-kromosominaktivering for å dempe aktiviteten til autosomale kromosomer. For eksempel Jiang et al. satt inn en kopi av Xist -genet i en kopi av kromosom 21 i stamceller avledet fra et individ med trisomi 21 ( Downs syndrom ). Det innsatte Xist-genet induserer Barr-kroppsdannelse, utløser stabile heterokromatinmodifikasjoner og demper de fleste genene på den ekstra kopien av kromosom 21. I disse modifiserte stamcellene ser det ut til at den Xist-medierte gendemping reverserer noen av defektene forbundet med Down syndrom.
Historie
I 1959 viste Susumu Ohno at de to X -kromosomene til pattedyr var forskjellige: en så ut som autosomene ; den andre var kondensert og heterokromatisk. Dette funnet antydet, uavhengig av to grupper av etterforskere, at det ene av X -kromosomene ble inaktivert.
I 1961 Mary Lyon foreslått tilfeldig inaktivering av en kvinnelig X-kromosom for å forklare den spettet fenotypen til hunnmus heterozygote for pelsfarge gener . Lyon -hypotesen redegjorde også for funnene om at en kopi av X -kromosomet i hunnceller var sterkt kondensert, og at mus med bare én kopi av X -kromosomet utviklet seg som ufruktbare hunner. Dette foreslo for Ernest Beutler å studere heterozygote hunner for glukose-6-fosfat dehydrogenase (G6PD) -mangel, at det var to røde cellepopulasjoner av erytrocytter i slike heterozygoter: mangelfulle celler og normale celler, avhengig av om det inaktiverte X-kromosomet (i kjernen i den røde cellens forløpercelle) inneholder den normale eller defekte G6PD -allelen.
Se også
- Sexbestemmelsessystem
- Doseringskompensasjon
- Barr kropp
- Heterokromatin
- Epigenetikk
- Skjev X-inaktivering
- Utviklingsforstyrrelser som antas å være relatert til X-inaktivering:
Referanser
Videre lesning
- Huynh KD, Lee JT (mai 2005). "X-kromosominaktivering: en hypotese som forbinder ontogeni og fylogeni". Naturanmeldelser. Genetikk . 6 (5): 410–8. doi : 10.1038/nrg1604 . PMID 15818384 . S2CID 19245310 .
- Goto T, Monk M (juni 1998). "Regulering av inaktivering av X-kromosom i utvikling hos mus og mennesker" (gjennomgangsartikkel) . Mikrobiologi og molekylærbiologi anmeldelser . 62 (2): 362–78. doi : 10.1128/MMBR.62.2.362-378.1998 . PMC 98919 . PMID 9618446 .
- Lyon MF (desember 2003). "Lyon og LINE -hypotesen". Seminarer i celle- og utviklingsbiologi (gjennomgangsartikkel). 14 (6): 313–8. doi : 10.1016/j.semcdb.2003.09.015 . PMID 15015738 .
- Ng K, Pullirsch D, Leeb M, Wutz A (januar 2007). "Xist and the order of Silencing" (gjennomgangsartikkel) . EMBO -rapporter . 8 (1): 34–9. doi : 10.1038/sj.embor.7400871 . PMC 1796754 . PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (august 2015). "Xistisk lokalisering og funksjon: ny innsikt fra flere nivåer" . Genombiologi . 16 : 166. doi : 10.1186/s13059-015-0733-y . PMC 4539689 . PMID 26282267 .
Eksterne linker
-
 Medier relatert til inaktivering av X -kromosom på Wikimedia Commons
Medier relatert til inaktivering av X -kromosom på Wikimedia Commons - Kruszelnicki K (2004-02-11). "Hybrid Auto-Immune Women 3" . ABC Science .

