Yersinia pestis -Yersinia pestis
| Yersinia pestis | |
|---|---|
|
|
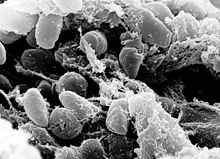
| En scanning-elektronmikroskopibilde som viser en masse av Yersinia pestis bakterier i den forutgående av en infisert loppe | |
|
Vitenskapelig klassifisering |
|
| Domene: | Bakterie |
| Filum: | Proteobakterier |
| Klasse: | Gammaproteobakterier |
| Rekkefølge: | Enterobacterales |
| Familie: | Yersiniaceae |
| Slekt: | Yersinia |
| Arter: |
Y. pestis
|
| Binomisk navn | |
|
Yersinia pestis (Lehmann & Neumann, 1896)
van Loghem, 1944 |
|
| Synonymer | |
|
|
Yersinia pestis ( Y. pestis ) (tidligere Pasteurella pestis ) er en gramnegativ , ikke-motil , stavformet , coccobacillus- bakterie, uten sporer som er relatert til både Yersinia pseudotuberculosis og Yersinia enterocolitica . Det er en fakultativ anaerob organisme som kan infisere mennesker via den orientalske rotteloppen ( Xenopsylla cheopis ). Det forårsaker sykdommen pest , som forårsaket Svartedauden , den dødeligste pandemien i nedtegnet historie. Pest har tre hovedformer: pneumonisk , septisk og bubonisk .
Y. pestis ble oppdaget i 1894 av Alexandre Yersin , en sveitsisk/fransk lege og bakteriolog fra Pasteur Institute , under en epidemi av pesten i Hong Kong . Yersin var medlem av Pasteur -tankeskolen . Kitasato Shibasaburō , en japansk bakteriolog som praktiserte Kochs metodikk , var også engasjert på det tidspunktet i å finne årsaken til pesten. Imidlertid koblet Yersin faktisk pesten med en basill, opprinnelig kalt Pasteurella pestis ; den ble omdøpt til Yersinia pestis i 1944.
Hvert år rapporteres fortsatt tusenvis av tilfeller av pesten til Verdens helseorganisasjon . Med riktig antibiotikabehandling er prognosen for ofre mye bedre enn før antibiotika ble utviklet. En fem til seks ganger økning av tilfeller skjedde i Asia i løpet av Vietnamkrigen , muligens på grunn av forstyrrelse av økosystemer og nærmere nærhet mellom mennesker og dyr. Pesten finnes nå ofte i Afrika sør for Sahara og Madagaskar, områder som nå utgjør over 95% av rapporterte tilfeller. Pesten har også en skadelig effekt på ikke-menneskelige pattedyr; i USA inkluderer disse svarthale-præriehunden og den truede svartfoten ilderen .
Generelle egenskaper
Y. pestis er en ikke-motil, stavformet, fakultativ anaerob bakterie med bipolar flekker (gir den et sikkerhetsnålsutseende ) som produserer et antifagocytisk slimlag. I likhet med andre Yersinia -arter tester den negativt for urease , laktosegjæring og indol . Den nærmeste slektningen er den gastrointestinale patogenen Yersinia pseudotuberculosis , og fjernere Yersinia enterocolitica .
Genom
En komplett genomisk sekvens er tilgjengelig for to av de tre underartene av Y. pestis : stamme KIM (av biovar Y. p. Medievalis ), og stamme CO92 (av biovar Y. p. Orientalis , hentet fra et klinisk isolat i USA ). I 2006 ble den genomiske sekvensen til en stamme av biovar Antiqua fullført. I likhet med de andre patogene stammene, er det tegn på tap av funksjonsmutasjoner. Den kromosomet av stamme KIM er 4,600,755 basepar lange; kromosomet til stamme CO92 er 4.653.728 basepar langt. Som Y. pseudotuberculosis og Y. enterocolitica , er Y. pestis vert for plasmidet pCD1. Den er også vert for to andre plasmider, pPCP1 (også kalt pPla eller pPst) og pMT1 (også kalt pFra) som ikke bæres av de andre Yersinia -artene . pFra koder for en fosfolipase D som er viktig for Y. pestis evne til å overføres av lopper. pPla koder for en protease , Pla, som aktiverer plasmin i menneskelige verter og er en veldig viktig virulensfaktor for lungepest. Sammen koder disse plasmidene, og en patogenitetsøy som heter HPI, for flere proteiner som forårsaker patogenesen som Y. pestis er kjent for. Blant annet er disse virulensfaktorene påkrevd for bakteriell vedheft og injeksjon av proteiner i vertscellen, invasjon av bakterier i vertscellen (via et type III sekresjonssystem ), og oppkjøp og binding av jern høstet fra røde blodlegemer ( av sideroforer ). Y. pestis antas å stamme fra Y. pseudotuberculosis , bare forskjellig i nærvær av spesifikke virulensplasmider.
En omfattende og komparativ proteomanalyse av Y. pestis stamme KIM ble utført i 2006. Analysen fokuserte på overgangen til en veksttilstand som etterligner vekst i vertsceller.
Lite ikke -kodende RNA
Mange bakterielle små ikke -kodende RNA er identifisert for å spille regulatoriske funksjoner. Noen kan regulere virulensgenene. Omtrent 63 nye antatte sRNA ble identifisert gjennom dyp sekvensering av Y. pestis sRNA-ome. Blant dem var Yersinia -spesifikk (også tilstede i Y. pseudotuberculosis og Y. enterocolitica ) Ysr141 ( Yersinia small RNA 141). Ysr141 sRNA ble vist å regulere syntesen av type III sekresjonssystem (T3SS) effektorprotein YopJ. Yop-Ysc T3SS er en kritisk komponent i virulens for Yersinia- arter. Mange nye sRNA ble identifisert fra Y. pestis dyrket in vitro og i de infiserte lungene til mus, noe som tyder på at de spiller en rolle i bakteriell fysiologi eller patogenese. Blant dem spådde sR035 å koble seg sammen med SD-region og transkripsjonsinitieringssted for en termosensitiv regulator ymoA, og sR084 spådde å koble seg sammen med pels , jernopptaksregulator .
Patogenese og immunitet

I urbane og sylvatiske (skog) sykluser av Y. pestis skjer det meste av spredningen mellom gnagere og lopper. I den sylvatiske syklusen er gnageren vill, men i bysyklusen er gnageren først og fremst den brune rotten ( Rattus norvegicus ). I tillegg kan Y. pestis spre seg fra bymiljøet og tilbake. Overføring til mennesker skjer vanligvis gjennom bitt av infiserte lopper. Hvis sykdommen har utviklet seg til den pneumoniske formen, kan mennesker spre bakterien til andre ved hoste, oppkast og muligens nysing.
I reservoarverter
Flere arter av gnagere fungerer som hovedreservoaret for Y. pestis i miljøet. I steppene antas det naturlige reservoaret å være hovedsakelig murmeldyr . I det vestlige USA antas det at flere arter av gnagere opprettholder Y. pestis . Imidlertid har den forventede sykdomsdynamikken ikke blitt funnet hos noen gnagere. Flere arter av gnagere er kjent for å ha variabel motstand, noe som kan føre til asymptomatisk bærerstatus . Bevis indikerer at lopper fra andre pattedyr har en rolle i menneskelige pestutbrudd.
Mangelen på kunnskap om pestdynamikken hos pattedyrarter er også sant blant mottakelige gnagere som den svarthale præriehunden ( Cynomys ludovicianus ), der pesten kan forårsake kollaps av kolonier, noe som resulterer i en massiv effekt på matveier på prærien. Imidlertid følger overføringsdynamikken i præriehunder ikke dynamikken i blokkerte lopper; skrotter, blokkerte lopper eller en annen vektor kan muligens være viktig i stedet.
I andre regioner i verden er reservoaret for infeksjonen ikke klart identifisert, noe som kompliserer forebyggings- og tidligvarslingsprogrammer. Et slikt eksempel ble sett i et utbrudd i 2003 i Algerie .
Vector
Overføringen av Y. pestis med lopper er godt karakterisert. Første oppkjøp av Y. pestis av vektoren skjer under fôring av et infisert dyr. Flere proteiner og deretter bidra til opprettholdelse av bakteriene i den loppefordøyelseskanalen, blant dem hemin lagringssystemet og Yersinia murine toksin (YMT). Selv om Ymt er svært giftig for gnagere og en gang ble antatt å være produsert for å sikre reinfeksjon av nye verter, er det viktig for Y. pestis overlevelse i lopper.
Heminlagringssystemet spiller en viktig rolle i overføringen av Y. pestis tilbake til en pattedyrsvert. Mens de er i insektvektoren, induserer proteiner som er kodet av heminlagringssystemets genetiske lokus biofilmdannelse i proventriculus , en ventil som forbinder mellomtarmen og spiserøret . Tilstedeværelsen av denne biofilmen ser ut til å være nødvendig for stabil infeksjon av loppen. Aggregering i biofilmen hemmer fôring, da en masse blodpropp og bakterier dannes (referert til som "Bacots blokk" etter entomolog AW Bacot , den første som beskriver dette fenomenet). Overføring av Y. pestis skjer under loppens forsøk på å mate. Inntatt blod pumpes inn i spiserøret, hvor det løsner bakterier som ligger i proventriculus, som regurgiteres tilbake til vertssirkulasjonssystemet.
Hos mennesker og andre mottakelige verter
Patogenese på grunn av Y. pestis -infeksjon hos pattedyrverter skyldes flere faktorer, inkludert disse bakteriens evne til å undertrykke og unngå normale immunsystemresponser som fagocytose og antistoffproduksjon . Loppebitt lar bakteriene passere hudbarrieren. Y. pestis uttrykker en plasminaktivator som er en viktig virulensfaktor for pneumonisk pest, og som kan nedbrytes på blodpropper for å lette systematisk invasjon. Mange av bakteriens virulensfaktorer er antifagocytiske. To viktige antifagocytiske antigener , kalt F1 (fraksjon 1) og V eller LcrV , er begge viktige for virulens . Disse antigenene produseres av bakterien ved normal menneskelig kroppstemperatur. Videre overlever Y. pestis og produserer F1- og V -antigener mens den befinner seg i hvite blodlegemer som monocytter , men ikke i nøytrofiler . Naturlig eller indusert immunitet oppnås ved produksjon av spesifikke opsoniske antistoffer mot F1- og V -antigener; antistoffer mot F1 og V induserer fagocytose av nøytrofile.
I tillegg lar type III-sekresjonssystemet (T3SS) Y. pestis injisere proteiner i makrofager og andre immunceller. Disse T3SS-injiserte proteinene, kalt Yersinia ytre proteiner (Yops), inkluderer Yop B/D, som danner porer i vertscellemembranen og har blitt knyttet til cytolyse . YopO, YopH , YopM, YopT, YopJ og YopE injiseres i cytoplasma av vertsceller av T3SS i porene som delvis er skapt av YopB og YopD. De injiserte Yops begrenser fagocytose og cellesignalveier som er viktige i det medfødte immunsystemet , som diskutert nedenfor. I tillegg er noen Y. pestis -stammer i stand til å forstyrre immunsignalering (f.eks. Ved å forhindre frigjøring av noen cytokiner ).
Y. pestis formerer seg inne i lymfeknuter , der den er i stand til å unngå ødeleggelse av celler i immunsystemet som makrofager . Y. pestis evne til å hemme fagocytose gjør at den kan vokse i lymfeknuter og forårsake lymfadenopati . YopH er et proteintyrosinfosfatase som bidrar til Y. pestis evne til å unngå celler fra immunsystemet. I makrofager har det vist seg at YopH defosforylerer p130Cas , Fyb ( FYN- bindende protein) SKAP-HOM og Pyk , en tyrosinkinase som er homolog med FAK . YopH også binder p85-subenheten av fosfoinositid-3-kinase , den Gab1 de Gab2 adapter proteinene, og den Vav guaninnukleotid utveksling faktor .
YopE fungerer som et GTPase-aktiverende protein for medlemmer av Rho-familien av GTPaser som RAC1 . YopT er en cysteinprotease som hemmer RhoA ved å fjerne isoprenylgruppen , som er viktig for å lokalisere proteinet til cellemembranen . YopE og YopT har blitt foreslått å fungere for å begrense YopB/D-indusert cytolyse. Dette kan begrense funksjonen til YopB/D for å lage porene som brukes for Yop-innsetting i vertsceller og forhindre YopB/D-indusert brudd i vertsceller og frigjøring av celleinnhold som vil tiltrekke og stimulere immunsystemresponser.
YopJ er en acetyltransferase som binder seg til en konservert α-helix av MAPK-kinaser . YopJ acetylerer MAPK -kinaser ved seriner og treoniner som normalt fosforyleres under aktivering av MAP -kinasekaskaden . YopJ aktiveres i eukaryote celler ved interaksjon med fytinsyre med målcelle (IP6). Denne forstyrrelsen av vertscelleproteinkinaseaktivitet forårsaker apoptose av makrofager, og dette foreslås å være viktig for etablering av infeksjon og for å unngå unnvikelse av vertens immunrespons. YopO er en proteinkinase også kjent som Yersinia proteinkinase A (YpkA). YopO er en kraftig inducer av human makrofagapoptose.
Det har også blitt antydet at en bakteriofag - Ypφ - kan ha vært ansvarlig for å øke virulensen til denne organismen.
Avhengig av hvilken form for pesten den enkelte blir smittet med, utvikler pesten en annen sykdom; Imidlertid påvirker pesten generelt vertscellens evne til å kommunisere med immunsystemet, noe som hindrer kroppen i å bringe fagocytiske celler til infeksjonsområdet.
Y. pestis er en allsidig morder. I tillegg til gnagere og mennesker, er det kjent å ha drept kameler, kyllinger og griser. Husdyr og katter er også utsatt for pest, men katter er mer sannsynlig å utvikle sykdom når de blir smittet. I begge er symptomene lik de som mennesker opplever, og kan være dødelige for dyret. Mennesker kan bli utsatt ved å komme i kontakt med et infisert dyr (død eller levende), eller puste inn smittsomme dråper som en syk hund eller katt har hostet ut i luften.
Immunitet
En formalin -inaktivert vaksine var tidligere tilgjengelig i USA for voksne med høy risiko for å pådra seg pesten inntil Food and Drug Administration fjerner den fra markedet . Det var av begrenset effektivitet og kan forårsake alvorlig betennelse . Eksperimenter med genteknologi av en vaksine basert på F1- og V -antigener er i gang og viser lovende. Imidlertid er bakterier som mangler antigen F1 fortsatt virulente, og V -antigenene er tilstrekkelig variable slik at vaksiner sammensatt av disse antigenene kanskje ikke er fullt beskyttende. The United States Army Medical Research Institute of Infectious Diseases har funnet ut at en eksperimentell F1 / V antigen-basert vaksine beskytter krabbe-spising makaker , men klarte ikke å beskytte afrikanske grønne apearter . En systematisk gjennomgang av Cochrane Collaboration fant ingen studier av tilstrekkelig kvalitet til å komme med noen uttalelse om effekten av vaksinen.
Isolasjon og identifikasjon
I 1894 isolerte to bakteriologer, Alexandre Yersin fra Sveits og Kitasato Shibasaburō fra Japan, uavhengig bakterien i Hong Kong som var ansvarlig for pesten i Hong Kong 1894 . Selv om begge etterforskerne rapporterte funnene sine, førte en rekke forvirrende og motstridende uttalelser fra Kitasato til slutt til aksept av Yersin som den viktigste oppdageren av organismen. Yersin kalte det Pasteurella pestis til ære for Pasteur Institute , hvor han jobbet. I 1967 ble den flyttet til en ny slekt og omdøpt til Yersinia pestis til hans ære. Yersin bemerket også at rotter ble påvirket av pest, ikke bare under pestepidemier, men også ofte før slike epidemier hos mennesker, og at pesten av mange lokalbefolkningen ble sett på som en sykdom hos rotter; landsbyboere i Kina og India hevdet at da et stort antall rotter ble funnet døde, fulgte snart pestutbrudd.
I 1898 franske vitenskapsmannen Paul-Louis Simond (som også hadde kommet til Kina for å kjempe den tredje Pandemic) oppdaget rotte-loppe vektor som driver sykdommen. Han hadde bemerket at personer som ble syke ikke trengte å være i nær kontakt med hverandre for å få sykdommen. I Yunnan , Kina, ville innbyggerne flykte fra hjemmene sine så snart de så døde rotter, og på øya Formosa ( Taiwan ) anså innbyggerne at håndtering av døde rotter økte risikoen for å utvikle pest. Disse observasjonene fikk ham til å mistenke at loppen kan være en mellomliggende faktor i smitteoverføringen, siden folk bare fikk pest hvis de var i kontakt med rotter som hadde dødd mindre enn 24 timer før. I et nå klassisk eksperiment demonstrerte Simond hvordan en frisk rotte døde av pesten etter at infiserte lopper hadde hoppet til den fra en rotte som nylig hadde dødd av pesten. Utbruddet spredte seg til Chinatown, San Francisco, fra 1900 til 1904 og deretter til Oakland og East Bay fra 1907 til 1909. Det har vært til stede i gnagere i det vestlige Nord -Amerika siden, som frykt for konsekvensene av utbruddet for handel fikk myndighetene til å skjule de døde av innbyggerne i Chinatown lenge nok til at sykdommen ble overført til utbredte arter av innfødte gnagere i utmark.
Tre hovedstammer gjenkjennes: Y. s. antiqua , som forårsaket en pestepandemi i det sjette århundre; Y. s. medievalis , som forårsaket svartedauden og påfølgende epidemier under den andre pandemibølgen; og Y. s. orientalis , som er ansvarlig for dagens pestutbrudd.
det 21. århundre
15. januar 2018 foreslo forskere ved Universitetet i Oslo og Universitetet i Ferrara at mennesker og deres parasitter var de største bærerne av pesten.
Eldre DNA -bevis
I 2010 slo forskere i Tyskland definitivt fast, ved å bruke PCR -bevis fra prøver hentet fra Black Death -ofre, at Y. pestis var årsaken til den middelalderske Black Death .
I 2011 ble det første genomet til Y. pestis isolert fra Black Death -ofre publisert, og konkluderte med at denne middelalderske stammen var forfedre til de fleste moderne former for Y. pestis .
I 2015 publiserte Cell resultater fra en studie av gamle graver. Plasmider av Y. pestis ble påvist i arkeologiske prøver av tennene til syv personer i bronsealderen, i Afanasievo -kulturen i Sibir, Corded Ware -kulturen i Estland, Sintashta -kulturen i Russland, Unetice -kulturen i Polen og Andronovo -kulturen i Sibir. I 2018 ble fremveksten og spredningen av patogenet under den neolitiske nedgangen (så langt tilbake som 6000 år siden) publisert. Et nettsted i Sverige var kilden til DNA -bevisene, og handelsnettverk ble foreslått som den sannsynlige spredningsveien i stedet for folkevandringer. Det er bevis som tyder på at Y. pestis kan ha sin opprinnelse i Europa i Cucuteni - Trypillia -kulturen , ikke i Asia slik det er vanlig å tro.
DNA -bevis publisert i 2015 indikerer at Y. pestis smittet mennesker for 5000 år siden i bronsealderen Eurasia, men genetiske endringer som gjorde det svært virulent skjedde ikke før for rundt 4000 år siden. Den svært virulente versjonen som kan overføres med lopper gjennom gnagere, mennesker og andre pattedyr ble funnet hos to individer assosiert med Srubnaya -kulturen fra Samara -regionen i Russland for rundt 3800 år siden og en jernalder fra Kapan , Armenia fra rundt 2900 År siden. Dette indikerer at minst to avstamninger av Y. pestis sirkulerte under bronsealderen i Eurasia. Den Y. pestis bakterien har et relativt stort antall nonfunctioning gener og tre "ungainly" plasmider, noe som tyder på en opprinnelse mindre enn 20.000 år siden.
8. september 2016 ble bakterien Y. pestis identifisert fra DNA i tennene som ble funnet på et Crossrail -byggested i London . De menneskelige restene ble funnet å være ofre for London -pesten , som varte fra 1665 til 1666.
I 2021 fant forskere et 5000 år gammelt offer for Y. pestis, verdens eldste kjente, i jeger-samlerester i det moderne latviske og estiske grenseområdet.
arrangementer
I 2008 ble pest ofte funnet i Afrika sør for Sahara og Madagaskar, områder som utgjorde over 95% av de rapporterte tilfellene.
I september 2009 ble Malcolm Casadabans død , professor i molekylær genetikk ved University of Chicago , knyttet til hans arbeid med en svekket laboratoriestamme av Y. pestis . Hemokromatose ble antatt å være en predisponerende faktor for Casadabans død av denne svekkede stammen som ble brukt til forskning.
3. november 2019 ble det diagnostisert to tilfeller av lungepest på et sykehus i Chaoyang -distriktet i Beijing , noe som førte til frykt for et utbrudd. Pasienten var en middelaldrende mann med feber, som hadde klaget over pustevansker i ti dager sammen med sin kone med lignende symptomer. Politiet satt karantene på legevakten på sykehuset, og det ble kontrollert kinesiske nyhetsaggregater. November ble et tredje tilfelle rapportert, i en 55 år gammel mann fra Xilingol League , en av de tolv autonome mongolske regionene i Nord-Kina. Pasienten fikk behandling, og 28 symptomfrie kontakter ble plassert i karantene.
I juli 2020 økte tjenestemenn forhåndsreglene etter at et tilfelle av bubonic pest ble bekreftet i Bayannur , en by i Kinas autonome region Indre Mongolia . Pasienten ble satt i karantene og behandlet. Ifølge China's Global Times ble en andre mistenkt sak også etterforsket, og det ble utstedt et varsel på nivå 3, som gjelder frem til slutten av året. Det forbød jakt og spising av dyr som kunne bære pest, og oppfordret publikum til å rapportere mistenkte tilfeller.
Referanser
Eksterne linker
- Yersinia pestis . Virtuelt museum for bakterier.
- En liste over variantstammer og informasjon om synonymer (og mye mer) er tilgjengelig via NCBI -taksonomien .
- CDCs hjemmeside for Pest
- IDSAs ressursside om Pest : Gjeldende, omfattende informasjon om patogenese, mikrobiologi, epidemiologi, diagnose og behandling
- Pest (Yersinia Pestis)
- Wyndham Lathem snakker om "From Mild to Murderous: How Yersinia pestis Evolved to Cause Pneumonic Plague."

