Influensa A -virus -Influenza A virus
| Influensa A -virus | |
|---|---|
|
|
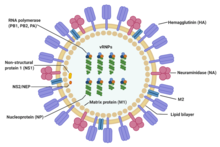
| Struktur av influensa A -virus | |

|
|
| TEM -mikroskop av influensa A -virus | |
|
Virusklassifisering |
|
| (uten rangering): | Virus |
| Rike : | Riboviria |
| Kongedømme: | Orthornavirae |
| Filum: | Negarnaviricota |
| Klasse: | Insthoviricetes |
| Rekkefølge: | Articulavirales |
| Familie: | Orthomyxoviridae |
| Slekt: | Alphainfluenzavirus |
| Arter: |
Influensa A -virus
|
| Undertyper | |
Influensa A -virus forårsakerinfluensahos fugler og noenpattedyr, og er den enesteartenavslekten Alphainfluenzavirusav virusfamilien Orthomyxoviridae . Stammerav alle undertyper av influensa A -virus har blitt isolert fra ville fugler, selv om sykdom er uvanlig. Noenisolaterav influensa A -virus forårsaker alvorlig sykdom både hos husdyr og sjelden hos mennesker. Av og til er virus overføres fra vill vannlevende fugler til fjørfe, og dette kan føre til utbrudd eller gi opphav til menneskelig influensapandemier.
Influensa A-virus er negative , enkelttrådede, segmenterte RNA-virus . De flere undertyper er merket i henhold til et H -nummer (for typen hemagglutinin ) og et N -nummer (for typen neuraminidase ). Det er 18 forskjellige kjente H -antigener (H1 til H18) og 11 forskjellige kjente N -antigener (N1 til N11). H17N10 ble isolert fra fruktflaggermus i 2012. H18N11 ble oppdaget i en peruansk flaggermus i 2013.
Hver virusundertype har mutert seg til en rekke stammer med forskjellige patogene profiler; noen er patogene for en art, men ikke andre, noen er patogene for flere arter.
En filtrert og renset influensa A vaksine for mennesker har blitt utviklet og mange land har hamstret det å tillate en rask administrasjon til befolkningen i tilfelle en fugleinfluensa pandemi . Aviær influensa kalles noen ganger fugleinfluensa, og i fellesskap fugleinfluensa. I 2011 rapporterte forskere oppdagelsen av et antistoff som er effektivt mot alle typer influensa A -virus.
Varianter og undertyper
Influensa type A -virus er RNA -virus kategorisert i undertyper basert på typen to proteiner på overflaten av viralhylsteret:
- H = hemagglutinin , et protein som får røde blodlegemer til å agglutinere .
- N = neuraminidase , et enzym som klyver de glykosidiske bindingene til monosakkarid sialinsyre (tidligere kalt neuramininsyre ).
Hemagglutinin er sentralt for virusets gjenkjenning og binding til målceller, og også for at det deretter infiserer cellen med dets RNA . Neuraminidasen, derimot, er kritisk for den påfølgende frigjøringen av datterviruspartiklene som er opprettet i den infiserte cellen, slik at de kan spre seg til andre celler.
Ulike influensavirus koder for forskjellige hemagglutinin- og neuraminidase -proteiner. For eksempel angir H5N1 -viruset en influensa A -undertype som har et type 5 hemagglutinin (H) protein og et type 1 neuraminidase (N) protein. Det er 18 kjente typer hemagglutinin og 11 kjente typer neuraminidase, så i teorien er 198 forskjellige kombinasjoner av disse proteinene mulige.
Noen varianter er identifisert og navngitt i henhold til isolatet de ligner, og antas dermed å dele slekt (eksempel Fujian influensaviruslignende ); i henhold til deres typiske vert (eksempel humant influensavirus ); i henhold til deres undertype (eksempel H3N2); og i henhold til deres dødelighet (eksempel LP, lav patogen). Så en influensa fra et virus som ligner på isolatet A/Fujian/411/2002 (H3N2) kalles Fujian influensa, menneskelig influensa og H3N2 influensa.
Varianter blir noen ganger navngitt i henhold til arten (verten) der stammen er endemisk eller som den er tilpasset. Hovedvariantene navngitt ved bruk av denne konvensjonen er:
Varianter har også noen ganger blitt navngitt i henhold til deres dødelighet hos fjærfe, spesielt kyllinger:
- Lavpatogen aviær influensa (LPAI)
- Svært patogen aviær influensa (HPAI), også kalt dødelig influensa eller dødsinfluensa
De fleste kjente stammene er utdødde stammer. For eksempel inneholder den årlige influensatypen H3N2 ikke lenger stammen som forårsaket Hong Kong -influensaen .
Årlig influensa
Den årlige influensaen (også kalt "sesonginfluensa" eller "menneskelig influensa") i USA. "resulterer i omtrent 36 000 dødsfall og mer enn 200 000 sykehusinnleggelser hvert år. I tillegg til denne menneskelige bompengene, er influensa årlig ansvarlig for en total kostnad på over $ 10 milliarder dollar i USA" Globalt er tollen av influensavirus estimert til 290 000–645 000 dødsfall årlig, mer enn tidligere estimater.
Den årlig oppdaterte, trivalente influensavaksinen består av hemagglutinin (HA) overflateglykoproteinkomponenter fra influensa H3N2 , H1N1 og B influensavirus .
Målt resistens mot standard antivirale legemidler amantadin og rimantadin i H3N2 har økt fra 1% i 1994 til 12% i 2003 til 91% i 2005.
"Moderne humane H3N2 -influensavirus er nå endemiske hos griser i Sør -Kina og kan sorteres på nytt med aviær H5N1 -virus i denne mellomliggende verten."
FI6 antistoff
FI6 , et antistoff som retter seg mot hemagglutininproteinet, ble oppdaget i 2011. FI6 er det eneste kjente antistoffet som er effektivt mot alle 16 undertyper av influensa A -viruset.
Struktur og genetikk

Influensatype A -virus er veldig like i struktur som influensavirus av type B, C og D. Viruspartikkelen (også kalt virion) er 80–120 nanometer i diameter slik at de minste virionene får en elliptisk form. Lengden på hver partikkel varierer betydelig, på grunn av det faktum at influensa er pleomorf, og kan være i overkant av mange titalls mikrometer, og produsere filamentøse virioner. Forvirring om arten av influensaviruspleomorfien stammer fra observasjonen om at laboratorietilpassede stammer vanligvis mister evnen til å danne filamenter og at disse laboratorietilpassede stammene var de første som ble visualisert ved elektronmikroskopi. Til tross for disse varierte formene, er virionene til alle influensa type A -virus like i sammensetning. De består alle av en viral konvolutt som inneholder to hovedtyper proteiner, pakket rundt en sentral kjerne.
De to store proteiner som finnes på utsiden av viruspartikler er hemagglutinin (HA) og neuraminidase (NA). HA er et protein som formidler binding av virionen til målceller og inntreden av virusgenomet i målcellen. NA er involvert i frigjøring fra de mange ikke-produktive festingsstedene som finnes i slim, samt frigjøring av avkomvirioner fra infiserte celler. Disse proteinene er vanligvis målene for antivirale legemidler. Videre er de også antigenproteinene som en verts antistoffer kan binde til og utløse en immunrespons. Influensatype A -virus er kategorisert i undertyper basert på typen av disse to proteinene på overflaten av viralhylsteret. Det er 16 undertyper av HA og 9 undertyper av NA kjent, men bare H 1, 2 og 3 og N 1 og 2 er ofte funnet hos mennesker.
Den sentrale kjernen i en virion inneholder virusgenomet og andre virale proteiner som pakker og beskytter det genetiske materialet. I motsetning til genomene til de fleste organismer (inkludert mennesker, dyr, planter og bakterier) som består av dobbeltstrenget DNA, består mange virale genomer av en annen enkeltstrenget nukleinsyre kalt RNA. Uvanlig for et virus er influensatype A -virusgenomet imidlertid ikke et enkelt stykke RNA; i stedet består den av segmenterte stykker negativt sanset RNA, hvert stykke inneholder enten ett eller to gener som koder for et genprodukt (protein). Begrepet negativ sans RNA innebærer bare at RNA genomet ikke kan oversettes til protein direkte; det må først transkriberes til RNA med positiv sans før det kan oversettes til proteinprodukter. Den segmenterte arten av genomet tillater utveksling av hele gener mellom forskjellige virusstammer.
Hele influensa A -virusgenomet er 13 588 baser langt og finnes på åtte RNA -segmenter som koder for minst 10, men opptil 14 proteiner, avhengig av stammen. Relevansen eller tilstedeværelsen av alternative genprodukter kan variere:
- Segment 1 koder for RNA -polymerase -underenhet (PB2).
- Segment 2 koder for RNA-polymerase-underenhet (PB1) og PB1-F2-proteinet, som induserer celledød, ved å bruke forskjellige leserammer fra det samme RNA-segmentet.
- Segment 3 koder for RNA-polymerase-underenhet (PA) og PA-X-proteinet, som har en rolle i vertstranskripsjonsavstengning.
- Segment 4 koder for HA (hemagglutinin). Omtrent 500 molekyler hemagglutinin er nødvendig for å lage en virion. HA bestemmer omfanget og alvorlighetsgraden av en virusinfeksjon i en vertsorganisme.
- Segment 5 koder for NP, som er et nukleoprotein.
- Segment 6 koder for NA (neuraminidase). Omtrent 100 molekyler neuraminidase er nødvendig for å lage en virion.
- Segment 7 koder for to matriseproteiner (M1 og M2) ved å bruke forskjellige leserammer fra det samme RNA -segmentet. Omtrent 3000 matriseproteinmolekyler er nødvendig for å lage en virion.
- Segment 8 koder for to forskjellige ikke-strukturelle proteiner (NS1 og NEP) ved å bruke forskjellige leserammer fra det samme RNA-segmentet.
RNA -segmentene i det virale genomet har komplementære basesekvenser i terminalendene, slik at de kan binde seg til hverandre med hydrogenbindinger. Transkripsjon av det virale (-) sansegenomet (vRNA) kan bare fortsette etter at PB2-proteinet binder seg til vertsbegrensede RNA, slik at PA-underenheten kan spalte flere nukleotider etter hetten. Denne vertsavledede hetten og ledsagede nukleotider tjener som primer for viral transkripsjon initiering. Transkripsjon fortsetter langs vRNA til en strekning av flere uracilbaser er nådd, og starter en 'stamming' hvorved det begynnende virale mRNAet er poly-adenylert, og produserer et modent transkripsjon for kjernefysisk eksport og oversettelse av vertsmaskiner.
RNA -syntesen foregår i cellekjernen, mens syntesen av proteiner finner sted i cytoplasma. Når de virale proteiner er satt sammen til virioner, forlater de samlede virionene kjernen og vandrer mot cellemembranen. Vertscellemembranen har flekker av virale transmembranproteiner (HA, NA og M2) og et underliggende lag av M1 -proteinet som hjelper de samlede virionene til å spire gjennom membranen, og frigjør ferdig innhyllede virus i den ekstracellulære væsken.
Undertyper av influensa A -virus anslås å ha divergerte for 2000 år siden. Influensavirus A og B anslås å ha avviket fra en enkelt stamfar for rundt 4000 år siden, mens forfedren til influensavirus A og B og stamfar til influensavirus C anslås å ha avviket fra en felles stamfar for rundt 8000 år siden.
Flere reaktiveringer
Influensavirus er i stand til å gjennomgå mangfoldig reaktivering etter inaktivering av UV -stråling, eller ved ioniserende stråling. Hvis noen av de åtte RNA -strengene som utgjør genomet inneholder skader som forhindrer replikasjon eller uttrykk for et essensielt gen, er viruset ikke levedyktig når det alene infiserer en celle (en enkelt infeksjon). Når to eller flere skadede virus infiserer den samme cellen (multiple infeksjoner), kan imidlertid levedyktige avkomvirus produseres forutsatt at hvert av de åtte genomiske segmentene er tilstede i minst én uskadet kopi. Det vil si at flerhetsreaktivering kan forekomme.
Ved infeksjon induserer influensavirus en vertsrespons som involverer økt produksjon av reaktive oksygenarter, og dette kan skade virusgenomet. Hvis virusoverlevelse vanligvis er sårbar for utfordringer med oksidativ skade under naturlige forhold, er reaktivering av mangfold sannsynligvis selektivt fordelaktig som en slags genomisk reparasjonsprosess. Det har blitt antydet at multiplisitetsreaktivering som involverer segmenterte RNA -genomer kan være lik den tidligste utviklede formen for seksuell interaksjon i RNA -verdenen som sannsynligvis gikk foran DNA -verdenen. (Se også RNA -verdenshypotesen .)
Menneskelig influensavirus
"Menneskelig influensavirus" refererer vanligvis til de undertyper som sprer seg mye blant mennesker. H1N1, H1N2 og H3N2 er de eneste kjente undertyper av influensa A -virus som for tiden sirkulerer blant mennesker.
Genetiske faktorer for å skille mellom "menneskelige influensavirus" og "fugleinfluensavirus" inkluderer:
- PB2: (RNA -polymerase): Aminosyre (eller rest ) posisjon 627 i PB2 -proteinet som kodes av PB2 RNA -genet. Frem til H5N1 hadde alle kjente fugleinfluensavirus en Glu i posisjon 627, mens alle humane influensavirus hadde et lysin .
- HA: (hemagglutinin): Aviær influensa HA binder alfa 2–3 sialinsyre reseptorer, mens human influensa HA binder alfa 2–6 sialinsyre reseptorer. Svineinfluensavirus har evnen til å binde begge typer sialinsyre -reseptorer.
Symptomer på menneskelig influensa inkluderer vanligvis feber, hoste, ondt i halsen , muskelsmerter , konjunktivitt og i alvorlige tilfeller pusteproblemer og lungebetennelse som kan være dødelig. Alvorlighetsgraden av infeksjonen vil i stor grad avhenge av tilstanden til den infiserte persons immunsystem og om offeret har blitt utsatt for belastningen før, og derfor er delvis immun. Oppfølgingsstudier om statins innvirkning på influensavirusreplikasjon viser at forbehandling av celler med atorvastatin undertrykker virusvekst i kultur.
Svært patogen H5N1 fugleinfluensa hos mennesker er langt verre, og dreper 50% av mennesker som fanger den. I ett tilfelle opplevde en gutt med H5N1 diaré etterfulgt av koma raskt uten å utvikle respiratoriske eller influensalignende symptomer.
Influensa A -virusundertyper som er bekreftet hos mennesker, sortert etter antall kjente menneskelige pandemiske dødsfall, er:
- H1N1 forårsaket " spanskesyken " i 1918 og svineinfluensapandemien i 2009
- H2N2 forårsaket " asiatisk influensa " på slutten av 1950 -tallet
- H3N2 forårsaket " Hong Kong -influensa " på slutten av 1960 -tallet
- H5N1 regnes som en global influensapandemisk trussel gjennom spredningen på midten av 2000-tallet
- H7N9 er ansvarlig for en epidemi fra 2013 i Kina og anses av Dr. Michael Greger , forfatter av How Not to Die , for å ha den største pandemiske trusselen om influensa A -virusene
- H7N7 har noe zoonotisk potensial: det har sjelden forårsaket sykdom hos mennesker
- H1N2 er for tiden endemisk hos griser og har sjelden forårsaket sykdom hos mennesker.
- H9N2 , H7N2 , H7N3 , H5N2 , H10N7 og H10N3
- H1N1
- H1N1 var ansvarlig for pandemien i 2009 i både mennesker og griser. En variant av H1N1 var ansvarlig for den spanske influensapandemien som drepte rundt 50 millioner til 100 millioner mennesker over hele verden i løpet av omtrent et år i 1918 og 1919. En annen variant ble kalt en pandemisk trussel i influensapandemien i 2009 . Kontrovers oppsto i oktober 2005, etter at H1N1 -genomet ble publisert i tidsskriftet Science , på grunn av frykt for at denne informasjonen kunne brukes til bioterrorisme .
- H1N2
- H1N2 er endemisk i svinestander og har blitt dokumentert i noen få tilfeller hos mennesker.
- H2N2
- Den asiatiske influensaen, et pandemisk utbrudd av fugleinfluensa H2N2, oppsto i Kina i 1957, og spredte seg over hele verden samme år som en influensavaksine ble utviklet, varte til 1958 og forårsaket mellom én og fire millioner dødsfall.
- H3N2
- H3N2 er for tiden endemisk i både mennesker og griser. Det utviklet seg fra H2N2 ved antigent skift og forårsaket influensapandemien i Hong Kong i 1968 og 1969, som drepte opptil 750 000. En alvorlig form for H3N2 -viruset drepte flere barn i USA i slutten av 2003.
- Den dominerende stammen av årlig influensa i januar 2006 var H3N2. Målt resistens mot standard antivirale legemidler amantadin og rimantadin i H3N2 økte fra 1% i 1994 til 12% i 2003 til 91% i 2005. Menneskelige H3N2 -influensavirus er nå endemiske hos griser i Sør -Kina, hvor de sirkulerer sammen med aviær H5N1 -virus .
- H5N1
 |
- H5N1 er verdens største trussel mot influensapandemi.
- H5N2
- Japans helseministerium sa januar 2006 at fjørfeoppdrettsarbeidere i Ibaraki prefektur kan ha blitt utsatt for H5N2 i 2005. H5N2 -antistofftiterne til sammenkoblede sera på 13 individer økte firedoblet eller mer.
- H5N8
- I februar 2021 rapporterte Russland de første kjente tilfellene av H5N8 hos mennesker. Sju personer ble bekreftet å ha blitt smittet i desember 2020 og har siden kommet seg. Det var ingen indikasjon på smitte fra menneske til menneske.
- H5N9
- En svært patogen stamme av H5N9 forårsaket et mindre influensautbrudd i Ontario og Manitoba , Canada , i 1966 i kalkuner .
- H7N2
- En person i New York i 2003 og en person i Virginia i 2002 ble funnet å ha serologisk bevis på infeksjon med H7N2. Begge kom seg helt.
- H7N3
- I Nord -Amerika ble tilstedeværelsen av aviær influensastamme H7N3 bekreftet på flere fjørfegårder i British Columbia i februar 2004. Fra april 2004 hadde 18 gårder blitt satt i karantene for å stoppe spredningen av viruset. To tilfeller av mennesker med aviær influensa er bekreftet i denne regionen. "Symptomer inkluderte konjunktivitt og mild influensalignende sykdom." Begge ble helt frisk.
- H7N7
- H7N7 har uvanlig zoonotisk potensial. I 2003 i Nederland ble 89 mennesker bekreftet å ha H7N7 -influensavirusinfeksjon etter et utbrudd hos fjørfe på flere gårder. Ett dødsfall ble registrert.
- H7N9
- April 2013 bekreftet Center for Health Protection (CHP) ved Department of Health of Hong Kong ytterligere fire tilfeller i Jiangsu -provinsen i tillegg til de tre tilfellene som opprinnelig ble rapportert 31. mars 2013. Dette viruset har også det største potensialet for en influensapandemi blant alle influensa A -undertyper.
- H9N2
- Lavpatogen aviær influensa A (H9N2) infeksjon ble bekreftet i 1999, i Kina og Hong Kong hos to barn, og i 2003 i Hong Kong hos ett barn. Alle tre kom seg helt.
- H10N7
- I 2004, i Egypt , ble H10N7 rapportert for første gang hos mennesker. Det forårsaket sykdom hos to spedbarn i Egypt. Ett barns far var en fjærfehandler.
H10N3
I mai 2021, i Zhenjiang , ble Kina H10N3 rapportert for første gang hos mennesker. En person ble smittet.
Utvikling
I følge Jeffery Taubenberger :
- "Alle influensa A -pandemier siden [den spanske influensapandemien], og faktisk nesten alle tilfeller av influensa A over hele verden (unntatt menneskelige infeksjoner fra fuglevirus som H5N1 og H7N7), har blitt forårsaket av etterkommere av viruset i 1918, inkludert" drifted " H1N1 -virus og assorterte H2N2- og H3N2 -virus. Sistnevnte er sammensatt av viktige gener fra 1918 -viruset, oppdatert av senere inkorporerte fugleinfluensagener som koder for nye overflateproteiner, noe som gjør 1918 -viruset faktisk til "moren" til alle pandemier. "
Forskere fra National Institutes of Health brukte data fra Influenza Genome Sequencing Project og konkluderte med at hemagglutinin-genet i H3N2 mesteparten av tiden ikke viste noe signifikant overskudd av mutasjoner i de antigeniske områdene, mens et økende utvalg av stammer akkumulert. Dette resulterte i at en av variantene til slutt oppnådde høyere kondisjon, ble dominerende og i et kort intervall med rask evolusjon , raskt feide gjennom befolkningen og eliminerte de fleste andre varianter.
I den kortsiktige utviklingen av influensa A-virus fant en studie fra 2006 at stokastiske eller tilfeldige prosesser er nøkkelfaktorer. Influensa A -virus HA antigent evolusjon ser ut til å være mer preget av punkterte, sporadiske hopp i motsetning til en konstant antigenisk endring. Ved å bruke fylogenetisk analyse av 413 komplette genomer av humant influensa A -virus som ble samlet inn i staten New York, skrev forfatterne av Nelson et al. 2006 var i stand til å vise at genetisk mangfold, og ikke antigen drift, formet den kortsiktige utviklingen av influensa A via tilfeldig migrasjon og sortering. Utviklingen av disse virusene domineres mer av tilfeldig import av genetisk forskjellige virusstammer fra andre geografiske steder og mindre av naturlig seleksjon. I løpet av en gitt sesong er adaptiv evolusjon sjelden og hadde en generelt svak effekt som det fremgår av dataene samlet fra 413 genomene. Filogenetisk analyse avslørte at de forskjellige stammene var avledet fra nylig importert genetisk materiale i motsetning til isolater som hadde sirkulert i New York i tidligere sesonger. Derfor var genstrømmen inn og ut av denne populasjonen, og ikke naturlig seleksjon, viktigere på kort sikt.
Andre dyr
- Se H5N1 for den nåværende epizootien (en epidemi hos ikke -mennesker) og panzootic (en sykdom som rammer dyr av mange arter, spesielt over et stort område) av H5N1 -influensa
- Fugleinfluensa
Høns fungerer som naturlige asymptomatiske bærere av influensa A -virus. Før det nåværende H5N1 -epizootiet, var det påvist at stammer av influensa A -virus ble overført fra villfugler til bare fugler, griser, hester, seler , hvaler og mennesker; og bare mellom mennesker og griser og mellom mennesker og tamfugl; og ikke andre veier som tamfugl til hest.
Vill akvatiske fugler er de naturlige vertene for et stort utvalg influensa A -virus. Noen ganger overføres virus fra disse fuglene til andre arter og kan da forårsake ødeleggende utbrudd hos fjørfe eller forårsake menneskelige influensapandemier.
H5N1 har vist seg å overføres til tigre, leoparder og huskatter som ble matet med ukokt tamfugl (kyllinger) med viruset. H3N8 -virus fra hester har krysset over og forårsaket utbrudd hos hunder. Laboratoriemus har blitt smittet vellykket med en rekke genotyper for fugleinfluensa.
Influensa A -virus sprer seg i luften og i gjødsel , og overlever lenger i kaldt vær. De kan også overføres med forurenset fôr, vann, utstyr og klær; Imidlertid er det ingen bevis på at viruset kan overleve i godt tilberedt kjøtt. Symptomer hos dyr varierer, men virulente stammer kan forårsake død i løpet av få dager. Fugleinfluensa virus at Verdensorganisasjonen for dyrehelse og andre test for å kontrollere fjærfe sykdom inkluderer H5N1 , H7N2 , H1N7 , H7N3 , H13N6 , H5N9 , H11N6, H3N8 , H9N2 , H5N2 , H4N8, H10N7 , H2N2 , H8N4, H14N5, H6N5 og H12N5.
- Kjente utbrudd av svært patogen influensa hos fjørfe 1959–2003
| År | Område | Berørt | Undertype |
|---|---|---|---|
| 1959 | Skottland | Kylling | H5N1 |
| 1963 | England | Tyrkia | H7N3 |
| 1966 | Ontario (Canada) | Tyrkia | H5N9 |
| 1976 | Victoria (Australia) | Kylling | H7N7 |
| 1979 | Tyskland | Kylling | H7N7 |
| 1979 | England | Tyrkia | H7N7 |
| 1983 | Pennsylvania (USA)* | Kylling, kalkun | H5N2 |
| 1983 | Irland | Tyrkia | H5N8 |
| 1985 | Victoria (Australia) | Kylling | H7N7 |
| 1991 | England | Tyrkia | H5N1 |
| 1992 | Victoria (Australia) | Kylling | H7N3 |
| 1994 | Queensland (Australia) | Kylling | H7N3 |
| 1994 | Mexico* | Kylling | H5N2 |
| 1994 | Pakistan* | Kylling | H7N3 |
| 1997 | New South Wales (Australia) | Kylling | H7N4 |
| 1997 | Hong Kong (Kina)* | Kylling | H5N1 |
| 1997 | Italia | Kylling | H5N2 |
| 1999 | Italia* | Tyrkia | H7N1 |
| 2002 | Hong Kong (Kina) | Kylling | H5N1 |
| 2002 | Chile | Kylling | H7N3 |
| 2003 | Nederland* | Kylling | H7N7 |
*Utbrudd med betydelig spredning til mange gårder, noe som resulterer i store økonomiske tap. De fleste andre utbrudd involverte liten eller ingen spredning fra de opprinnelig infiserte gårdene.
Mer enn 400 steinkobbe -dødsfall ble registrert i New England mellom desember 1979 og oktober 1980, på grunn av akutt lungebetennelse forårsaket av influensaviruset, A/Seal/Mass/1/180 (H7N7).
- Svineinfluensa
- Svineinfluensa (eller "griseinfluensa") refererer til en undergruppe av Orthomyxoviridae som skaper influensa og er endemisk hos gris. Arten av Orthomyxoviridae som kan forårsake influensa hos griser er influensa A -virus og influensa C -virus , men ikke alle genotyper av disse to artene infiserer griser. De kjente undertyper av influensa A -virus som skaper influensa og er endemiske hos gris er H1N1, H1N2, H3N1 og H3N2. I 1997 kom H3N2 -virus fra mennesker inn i svinestanden, noe som forårsaket utbredt sykdom blant griser.
- Hestinfluensa
- Hestinfluensa (eller "hesteinfluensa") refererer til varianter av influensa A -virus som påvirker hester. Hestinfluensavirus ble først isolert i 1956. De to hovedtypene av virus kalles equine-1 (H7N7), som vanligvis påvirker muskler i hestens hjerte, og equine-2 (H3N8), som vanligvis er mer alvorlig. H3N8 -virus fra hester har infiserte hunder.
- Hundeinfluensa
- Hundeinfluensa (eller "hundeinfluensa") refererer til varianter av influensa A -virus som påvirker hunder. Hesteinfluensaviruset H3N8 ble funnet å infisere og drepe - med luftveissykdom - greyhound -rasehunder på en racerbane i Florida i januar 2004.
- Flaggermusinfluensa
- Flaggermusinfluensa (eller "flaggermusinfluensa") refererer til H17N10 og H18N11 influensa A -virusstammer som ble oppdaget i sentral- og søramerikanske fruktflaggermus samt et H9N2 -virus isolert fra den egyptiske fruktflaggermusen. Til nå er det uklart om disse flaggermus-avledede virusene sirkulerer hos noen arter som ikke er flaggermus og om de utgjør en zoonotisk trussel. Den første karakteriseringen av H18N11 -undertypen antyder imidlertid at dette flaggermusinfluensaviruset ikke er godt tilpasset noen andre arter enn flaggermus.
- H3N8
- H3N8 er nå endemisk hos fugler, hester og hunder.
Undertype liste
Influensa A -virus har følgende undertyper:
- Influensa A -virus undertype H1N1
- Influensa A -virus undertype H1N2
- Influensa A -virus undertype H2N2
- Influensa A -virus undertype H2N3
- Influensa A -virus undertype H3N1
- Influensa A -virus undertype H3N2
- Influensa A -virus undertype H3N8
- Influensa A -virus undertype H5N1
- Influensa A -virus undertype H5N2
- Influensa A -virus undertype H5N3
- Influensa A -virus undertype H5N6
- Influensa A -virus undertype H5N8
- Influensa A -virus undertype H5N9
- Influensa A -virus undertype H6N1
- Influensa A -virus undertype H6N2
- Influensa A -virus undertype H7N1
- Influensa A -virus undertype H7N2
- Influensa A -virus undertype H7N3
- Influensa A -virus undertype H7N4
- Influensa A -virus undertype H7N7
- Influensa A -virus undertype H7N9
- Influensa A -virus undertype H9N2
- Influensa A -virus undertype H10N3
- Influensa A -virus undertype H10N7
- Influensa A -virus undertype H10N8
- Influensa A -virus undertype H11N2
- Influensa A -virus undertype H11N9
- Influensa A -virus undertype H17N10
- Influensa A -virus undertype H18N11
Se også
Merknader
Videre lesning
- Offisielle kilder
- Fugleinfluensa og influensapandemier fra sentrene for sykdomskontroll og forebygging
- Ofte stilte spørsmål om fugleinfluensa fra Verdens helseorganisasjon
- Informasjon om fugleinfluensa fra Food and Agriculture Organization
- Den amerikanske regjeringens nettsted for aviær influensa
- European Center for Disease Prevention and Control ( ECDC ) Stockholm, Sverige
- Generell informasjon
- "Fugleinfluensaen og du" Plakat i full farge levert av Center for Technology and National Security Policy ved National Defense University , i samarbeid med National Security Health Policy Center
- Spesialnummer om fugleinfluensa fra Nature
- Naturrapporter: Hjemmeside: Fugleinfluensa
- Beigel JH, Farrar J, Han AM, Hayden FG, Hyer R, de Jong MD, Lochindarat S, Nguyen TK, Nguyen TH, Tran TH, Nicoll A, Touch S, Yuen KY (september 2005). "Aviær influensa A (H5N1) infeksjon hos mennesker". New England Journal of Medicine . 353 (13): 1374–85. CiteSeerX 10.1.1.730.7890 . doi : 10.1056/NEJMra052211 . PMID 16192482 .
- Pandemisk influensa: Innenriks beredskapsinnsats Congressional Research Service Report on Pandemic Preparedness.
- En guide til fugleinfluensa og dens symptomer fra BBC Health
-
Mahmoud (2005). Stacey L. Knobler; Alison Mack; Mahmoud, Adel; Stanley M. Lemon (red.). Trusselen om pandemisk influensa: er vi klare? : sammendrag av workshopen / utarbeidet for forum om mikrobielle trusler, styret for global helse . National Academies Press. s. 285. ISBN 0-309-09504-2.
Svært patogent aviær influensavirus er på hver topp ti -liste tilgjengelig for potensielle biovåpenmidler i landbruket
- Mahmoud AA, Institute of Medicine, Knobler S, Mack A (2005). Trusselen om pandemisk influensa: Er vi klare ?: Workshop -sammendrag . Washington, DC: National Academies Press. ISBN 978-0-309-09504-4.
- Lenker til Bird Flu bilder (Hardin MD/Univ of Iowa)
- Kawaoka Y (2006). Influensavirus: Aktuelle emner . Caister Academic Pr. ISBN 978-1-904455-06-6.
- Sobrino F, Mettenleiter T (2008). Animal Virus: Molecular Biology . Caister Academic Pr. ISBN 978-1-904455-22-6.
Eksterne linker
- Influensaforskningsdatabase - Database over influensa genomiske sekvenser og relatert informasjon.
- Helse-EU-portal EUs svar på influensa






