Mitokondrie biogenese - Mitochondrial biogenesis
Mitokondriell biogenese er prosessen der celler øker mitokondrielle antall. Det ble først beskrevet av John Holloszy på 1960-tallet, da det ble oppdaget at fysisk utholdenhetstrening induserte høyere mitokondrieinnhold, noe som førte til større glukoseopptak av muskler. Mitokondrie biogenese aktiveres av mange forskjellige signaler i tider med cellulær stress eller som respons på miljømessige stimuli, for eksempel aerob trening .
Bakgrunn
Evnen for en mitokondrion til å replikere seg selv er forankret i dens evolusjonære historie. Det antas ofte at mitokondrier stammer fra celler som dannet endosymbiotiske forhold med α-protobakterier , de har sitt eget genom for replikasjon. Nyere bevis tyder imidlertid på at mitokondrier kan ha utviklet seg uten symbiose. Mitokondrion er en nøkkelregulator for cellens metabolske aktivitet, og er også en viktig organell i både produksjon og nedbrytning av frie radikaler. Det postuleres at høyere mitokondrie-kopienummer (eller høyere mitokondrie-masse) er beskyttende for cellen.
Mitokondrier produseres fra transkripsjon og translasjon av gener både i kjernegenomet og i mitokondriegenomet . Flertallet av mitokondrieproteinet kommer fra det kjernefysiske genomet, mens det mitokondrie genomet koder for deler av elektrontransportkjeden sammen med mitokondrie rRNA og tRNA . Mitokondriell biogenese øker metabolske enzymer for glykolyse, oksidativ fosforylering og til slutt en større mitokondrie metabolsk kapasitet. Imidlertid, avhengig av tilgjengelige energisubstrater og REDOX-tilstanden til cellen, kan cellen øke eller redusere antall og størrelse på mitokondrier. Kritisk, mitokondrielle tall og morfologi varierer i henhold til celletype og kontekstspesifikk etterspørsel, hvor balansen mellom mitokondrie fusjon / fisjon regulerer mitokondrie distribusjon, morfologi og funksjon.
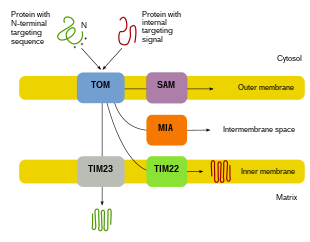
Proteinimport
Siden flertallet av mitokondrieproteinet kommer fra det kjernefysiske genomet, må proteinene målrettes riktig og transporteres inn i mitokondriene for å utføre sine funksjoner. For det første blir mRNA oversatt i cellens cytosol. De resulterende utfoldede forløperproteinene vil da være i stand til å nå sine respektive mitokondrie-rom. Forløperproteiner vil bli transportert til et av fire områder av mitokondriene, som inkluderer den ytre membranen, indre membran, intermembranrom og matrise. Alle proteiner vil komme inn i mitokondriene ved en translokase på den ytre mitokondriale membranen (TOM). Noen proteiner vil ha et N-terminal målsignal, og disse proteinene vil bli oppdaget og transportert inn i matrisen, hvor de deretter blir spaltet og brettet. Andre proteiner kan ha målinformasjon i sekvensene og vil ikke inkludere et N-terminal signal. I løpet av de siste to tiårene har forskere oppdaget over tretti proteiner som deltar i mitokondrieproteinimport. Etter hvert som forskere lærer mer om disse proteinene og hvordan de når de respektive mitokondrielle avdelingene som bruker dem, blir det tydelig at det er mange prosesser som fungerer sammen i cellen for å tillate mitokondrie biogenese.
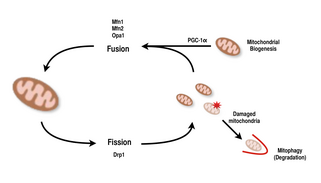
Fusjon og fisjon
Mitokondrier er svært allsidige og er i stand til å endre form gjennom fisjon og fusjonshendelser. Definitivt er fisjon hendelsen av at en enkelt enhet bryter fra hverandre, mens fusjon er hendelsen der to eller flere enheter blir sammen for å danne en helhet. Prosessene med fisjon og fusjon står i motsetning til hverandre og lar mitokondrielle nettverk hele tiden omforme seg selv. Hvis en stimulus induserer en endring i balansen mellom fisjon og fusjon i en celle, kan det endre mitokondrie nettverket betydelig. For eksempel vil en økning i mitokondrie-fisjon skape mange fragmenterte mitokondrier, noe som har vist seg å være nyttig for å eliminere skadede mitokondrier og for å skape mindre mitokondrier for effektiv transport til energikrevende områder. Å oppnå en balanse mellom disse mekanismene gjør det mulig for en celle å ha riktig organisering av sitt mitokondrielle nettverk under biogenese, og kan ha en viktig rolle i muskeltilpasning til fysiologisk stress.
Hos pattedyr er mitokondriell fusjon og fisjon kontrollert av GTPaser av dynaminfamilien. Prosessen med mitokondriell fisjon er ledet av Drp1 , et medlem av den cytosoliske dynaminfamilien. Dette proteinet danner en spiral rundt mitokondriene og samler seg for å bryte fra hverandre organellens ytre og indre membraner. På den annen side styres fusjonsprosessen av forskjellige membranforankrede dynaminproteiner på forskjellige nivåer av mitokondriene. Fusjon på nivået av den ytre mitokondriale membranen medieres av Mfn1 og Mfn2 (Mitofusins 1 og 2), og fusjon på nivået av den indre mitokondriale membranen medieres av Opa1 . Flere forskningsstudier har observert korrelerte økninger mellom mitokondrie respirasjonskapasitet med Mfn1, Mnf2 og Drp1 genuttrykk etter utholdenhetsøvelser. Derfor støttes det at omorganisering av mitokondrie nettverket i muskelceller spiller en viktig rolle som respons på trening.
Regulering
PGC-1α , et medlem av den peroksisomproliferatoraktiverte reseptorgamma (PGC) -familien av transkripsjonelle koaktivatorer , er hovedregulatoren for mitokondriebiogenese. Det er kjent å co-aktivere nukleær respiratorisk faktor 2 (NRF2 / GABPA) , og sammen med NRF-2 koaktiverer nukleær respiratorisk faktor 1 ( NRF1 ). NRF-ene aktiverer i sin tur den mitokondrielle transkripsjonsfaktoren A (tfam) , som er direkte ansvarlig for transkripsjon av kjernekodede mitokondrieproteiner. Dette inkluderer både strukturelle mitokondrieproteiner så vel som de som er involvert i mtDNA-transkripsjon, translasjon og reparasjon . PGC- 1β, et protein som er strukturelt lik PGC-1α , er også involvert i å regulere mitokondriebiogenese, men skiller seg ut ved at det ikke blir økt som respons på trening. Mens det har vært signifikante økninger i mitokondrier funnet i vev der PGC-1α er overuttrykt, da kofaktoren samhandler med disse viktige transkripsjonsfaktorene, er knockoutmus med forstyrret PGC-1α fortsatt levedyktige og viser normal mitokondrie overflod. Dermed er ikke PGC-1α nødvendig for normal utvikling av mitokondrier hos mus, men når de blir utsatt for fysiologisk stress, utviser disse musene redusert toleranse sammenlignet med mus med normale nivåer av PGC-1α. Tilsvarende, i knockoutmus med forstyrret PGC-1β, viste musene for det meste normale nivåer av mitokondriefunksjon med nedsatt evne til å tilpasse seg fysiologisk stress. Imidlertid skapte et dobbelt knockout-eksperiment av PGC-1α / β mus som døde for det meste innen 24 timer av defekter i mitokondrie modning av hjertevev. Disse funnene antyder at mens både PGC-1α og PGC-1β ikke bare etablerer en celles evne til å utføre mitokondrie biogenese, er de sammen i stand til å utfylle hverandre for optimal mitokondrie modning og funksjon i perioder med fysiologisk stress.
AMP-aktivert kinase (AMPK) regulerer også mitokondriell biogenese ved å fosforylere og aktivere PGC-1α ved å registrere en energimangel i muskler. Hos mus med reduserte ATP / AMP-forhold som ville oppstå under trening, har det blitt vist at energiforbruk korrelerer med AMPK-aktivering. AMPK-aktivering fortsatte deretter med å aktivere PGC-1α og NRFs i disse musene, og mitokondriell biogenese ble stimulert.
Aldring
Kapasiteten for mitokondriell biogenese har vist seg å avta med alderen, og en slik nedsatt mitokondriell funksjon har vært assosiert med diabetes og hjerte- og karsykdommer. Aldring og sykdom kan indusere endringer i ekspresjonsnivået til proteiner som er involvert i fisjon og fusjonsmekanismer i mitokondrier, og dermed skape dysfunksjonelle mitokondrier. En hypotese for de skadelige resultatene av aldring er forbundet med tap av telomerer , endesegmentene av kromosomer som beskytter genetisk informasjon mot nedbrytning. Telomertap har også vært assosiert med nedsatt mitokondriell funksjon. Mangel på telomerase revers transkriptase (TERT) , et enzym som spiller en rolle i å bevare telomerer, har blitt korrelert med aktivert p53, et protein som undertrykker PGC-1α. Derfor har tap av telomerer og TERT som følger med aldring vært assosiert med nedsatt mitokondrie biogenese. AMPK-uttrykk har også vist seg å avta med alderen, noe som også kan bidra til å undertrykke mitokondriell biogenese.
Referanser
Videre lesning
- Smith JA, Stallons LJ, Collier JB, Chavin KD, Schnellmann RG (februar 2015). "Undertrykkelse av mitokondriebiogenese gjennom bompengeaktig reseptor 4-avhengig mitogenaktivert proteinkinase-kinase / ekstracellulært signalregulert kinase-signalering i endotoksin-indusert akutt nyreskade" . Journal of Pharmacology and Experimental Therapeutics . 352 (2): 346–57. doi : 10.1124 / jpet.114.221085 . PMC 4293437 . PMID 25503387 .
- Cameron RB, Beeson CC, Schnellmann RG (desember 2016). "Utvikling av terapeutiske midler som induserer mitokondriebiogenese for behandling av akutte og kroniske degenerative sykdommer" . Tidsskrift for medisinsk kjemi . 59 (23): 10411–10434. doi : 10.1021 / acs.jmedchem.6b00669 . PMC 5564430 . PMID 27560192 .
- Whitaker RM, Corum D, Beeson CC, Schnellmann RG (2016). "Mitochondrial Biogenesis as a Pharmacological Target: A New Approach to Acute and Chronic Diseases". Årlig gjennomgang av farmakologi og toksikologi . 56 : 229–49. doi : 10.1146 / annurev-pharmtox-010715-103155 . PMID 26566156 .