Kaliumheptafluorotantalat - Potassium heptafluorotantalate
|
|
| Navn | |
|---|---|
|
IUPAC-navn
Dipalium heptafluorotantalate
|
|
|
Systematisk IUPAC-navn
Dipalium heptafluorotantalum (2-) |
|
| Andre navn
Kaliumheptafluorotantalat (V)
Kaliumfluorotantalat |
|
| Identifikatorer | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.037.245 |
| EF-nummer | |
|
PubChem CID
|
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Eiendommer | |
| K 2 [TaF 7 ] | |
| Molarmasse | 392,13 g / mol |
| Utseende | hvitt fast stoff |
| Tetthet | 4,56 g / ml ved 25 ° C |
| Smeltepunkt | 630 til 820 ° C (1.166 til 1.508 ° F, 903 til 1.093 K) |
| 0,5 g / 100 ml (15 ° C) | |
| Farer | |
| GHS-piktogrammer |
 
|
| GHS Signalord | Fare |
| H301 , H315 , H319 , H331 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301 + 310 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P311 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
| Dødelig dose eller konsentrasjon (LD, LC): | |
|
LD 50 ( median dose )
|
110 mg / kg (Oral: rotte) |
|
Med mindre annet er angitt, blir data gitt for materialer i standardtilstand (ved 25 ° C, 100 kPa). |
|
|
|
|
| Infoboksreferanser | |
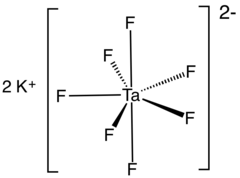
Kalium heptafluorotantalate er en uorganisk forbindelse med formel K- 2 [taF 7 ]. Det er kaliumsaltet av den heptafluorotantalate anion [taF 7 ] 2- . Dette hvite, vannløselige faste stoffet er et mellomprodukt i rensingen av tantal fra malmen og er forløperen til metallet.
Forberedelse
Industriell
Kaliumheptafluorotantalat er et mellomprodukt i den industrielle produksjonen av metallisk tantal. Produksjonen involverer utvasking av tantalmalmer, slik som columbite og tantalite , med flussyre og svovelsyre for å produsere det vannløselige hydrogenpentafluortantalat.
- Ta 2 O 5 + 14 HF → 2 H 2 [taF 7 ] + 5 H 2 O
Denne løsningen blir utsatt for en rekke væske-væske-ekstraksjonstrinn for å fjerne metalliske urenheter (viktigst av alt niob ) før de behandles med kaliumfluorid for å produsere K 2 [TaF 7 ]
Lab-skala
Flussyre er både etsende og giftig, noe som gjør det lite tiltalende å jobbe med; som sådan har det blitt utviklet en rekke alternative prosesser for småskala synteser. Kaliumheptafluorotantalat kan produseres ved både vannfri og våt metode. Den vannfrie metoden innebærer reaksjon av tantaloksid med kaliumbifluorid eller ammoniumbifluorid i henhold til følgende ligning:
- Ta 2 O 5 + 4 KHF 2 + 6 HF → 2 K 2 [taF 7 ] + 5 H 2 O
Metoden ble opprinnelig rapportert av Berzelius .
K 2 [taF 7 ] kan også utfelles fra oppløsninger i fluss-syre, forutsatt at HF-konsentrasjonen er under ca. 42%. Løsninger med høyere konsentrasjoner av HF gir kaliumheksafluorotantalat [KTaF 6 ]. K-saltet kan også utfelles fra en løsning i flussyre av tantalpentaklorid :
- 5 HF + 2 + KF TaCl 5 → K 2 [taF 7 ] + 5 HCl
Struktur
Kaliumheptafluorotantalat finnes i minst to polymorfe . α-K 2 [taF 7 ] er den mest vanlige formen og krystalliserer i den monokline P 2 1 / c romgruppe . Strukturen er sammensatt av [TaF 7 ] 2− enheter sammenkoblet av kaliumioner. [TaF 7 ] 2− polyhedra kan beskrives som monokapte trigonale prismer med kappeatomet plassert på en av de rektangulære overflatene. Kaliumatomer er 9-koordinerte og kan betraktes som forvrengte firkantede prismer .
Ved temperaturer over 230 ° C Her omdannes til β-K 2 [taF 7 ], som er ortorombisk (Romgruppe-: P NMA). Denne strukturen består også av kaliumioner og den komplekse anionen [TaF 7 ] 2− . Strukturen til 7-koordinat [TaF 7 ] 2− enhetene er i det vesentlige uendret. Imidlertid eksisterer kaliumatomene nå i to miljøer der de koordineres med enten 11 eller 8 fluoratomer.
Reaksjoner
K 2 [TaF 7 ] brukes primært til å produsere metallisk tantal ved reduksjon med natrium . Dette skjer ved ca. 800 ° C i smeltet salt og foregår via en rekke potensielle veier.
K 2 [taF 7 ] er utsatt for hydrolyse. For eksempel kan en kokende vandig oppløsning av K- 2 [taF 7 ] gir kalium oxyfluorotantalate (K 2 Ta 2 O 3 F 6 ), kjent som “ Marignac s salt”. For å forhindre hydrolyse og co-utfelling av kaliumoksyfluorotantalat tilsettes et lite overskudd av HF til løsningen.
