Termokjemisk syklus - Thermochemical cycle
Termokjemiske sykluser kombinerer utelukkende varmekilder ( termo ) med kjemiske reaksjoner for å dele vann i dets hydrogen- og oksygenkomponenter . Begrepet syklus brukes fordi bortsett fra vann, hydrogen og oksygen, blir de kjemiske forbindelsene som brukes i disse prosessene kontinuerlig resirkulert.
Hvis arbeid delvis brukes som input, blir den resulterende termokjemiske syklusen definert som en hybrid.
Historie
Dette konseptet ble først postulert av Funk og Reinstrom (1966) som en maksimalt effektiv måte å produsere drivstoff (f.eks. Hydrogen , ammoniakk ) fra stabile og rikelige arter (f.eks. Vann , nitrogen ) og varmekilder. Selv om drivstofftilgjengeligheten knapt ble vurdert før oljekrisen, var effektiv drivstoffproduksjon et problem i viktige nisjemarkeder . Som et eksempel, i det militære logistikkfeltet , er det en nøkkeloppgave å skaffe drivstoff til kjøretøyer på avsidesliggende slagmarker. Derfor ble et mobilproduksjonssystem basert på en bærbar varmekilde (en atomreaktor vurdert) undersøkt med største interesse. Etter oljekrisen ble flere programmer (Europa, Japan, USA) opprettet for å designe, teste og kvalifisere slike prosesser for formål som energiuavhengighet. Atomreaktorer med høy temperatur (1000 ° K) ble fortsatt ansett som de sannsynlige varmekildene. Imidlertid ble optimistiske forventninger basert på innledende termodynamikkstudier raskt moderert av pragmatiske analyser som sammenlignet standardteknologier ( termodynamiske sykluser for elektrisitetsproduksjon, kombinert med elektrolyse av vann ) og av mange praktiske spørsmål (utilstrekkelig temperatur fra selv atomreaktorer, langsom reaktivitet, reaktorkorrosjon , betydelige tap av mellomforbindelser over tid ...). Derfor ble interessen for denne teknologien svakt i løpet av de neste tiårene, eller i det minste ble noen kompromisser (hybridversjoner) vurdert med bruk av elektrisitet som en brøkdel av energitilførselen i stedet for bare varme for reaksjonene (f.eks. Hybrid svovelsyklus ). En gjenfødelse i år 2000 kan forklares med både den nye energikrisen, etterspørsel etter elektrisitet og det raske tempoet i utviklingen av konsentrerte solenergiteknologier hvis potensielt veldig høye temperaturer er ideelle for termokjemiske prosesser, mens den miljøvennlige siden av termokjemiske sykluser tiltrukket finansiering i en periode som var opptatt av et potensielt topp oljeutfall.
Prinsipper
Vannspaltning via en enkelt reaksjon
Tenk på et system som består av kjemiske arter (f.eks. Vannsplitting) i termodynamisk likevekt ved konstant trykk og termodynamisk temperatur T:
- H 2 O ( l ) H 2 ( g ) + 1/2 O 2 ( g ) (1)
Likevekt forskyves bare til høyre hvis energi ( entalpiendring ΔH for vannsplitting) tilføres systemet under strenge betingelser pålagt av termodynamikk :
- en brøkdel må tilveiebringes som arbeid , nemlig Gibbs fri energiendring ΔG av reaksjonen: den består av "edel" energi, dvs. under en organisert tilstand der materie kan styres, for eksempel elektrisitet i tilfelle elektrolyse av vann . Faktisk kan den genererte elektronstrømmen redusere protoner (H + ) ved katoden og oksidere anioner (O 2− ) ved anoden (ionene eksisterer på grunn av den kjemiske polariteten til vann), og gir den ønskede arten.
- den andre må tilføres som varme , dvs. ved å øke den termiske omrøringen av arten, og er per definisjon lik entropien til den absolutte temperaturen T ganger entropiendringen AS av reaksjonen.
- (2)
Derfor, for en omgivelsestemperatur T ° på 298K ( kelvin ) og et trykk på 1 atm ( atmosfære (enhet) ) (ΔG ° og ΔS ° er henholdsvis lik 237 kJ / mol og 163 J / mol / K, i forhold til innledende vannmengde), må mer enn 80% av den nødvendige energien ΔH leveres som arbeid for at vannsplittingen skal fortsette.
Hvis faseoverganger blir forsømt for enkelhets skyld (f.eks. Vannelektrolyse under trykk for å holde vannet i flytende tilstand), kan man anta at ΔH et ΔS ikke varierer betydelig for en gitt temperaturendring. Disse parametrene blir således tatt lik deres standardverdier ΔH ° et ΔS ° ved temperatur T °. Følgelig er arbeidet som kreves ved temperatur T,
- (3)
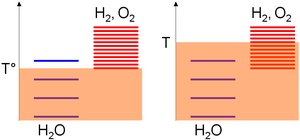
Siden ΔS ° er positiv, fører en temperaturøkning til en reduksjon av det nødvendige arbeidet. Dette er grunnlaget for elektrolyse ved høy temperatur . Dette kan også forklares intuitivt grafisk. Kjemiske arter kan ha forskjellige eksitasjonsnivåer avhengig av den absolutte temperaturen T, som er et mål på termisk omrøring. Sistnevnte forårsaker støt mellom atomer eller molekyler inne i det lukkede systemet slik at energispredning blant eksitasjonsnivåene øker med tiden, og stopper (likevekt) bare når de fleste av artene har lignende eksiteringsnivåer (et molekyl i et høyt opphisset nivå vil raskt komme tilbake til en lavere energitilstand ved kollisjoner) ( Entropy (statistisk termodynamikk) ).
I forhold til den absolutte temperaturskalaen samles eksiteringsnivåene til arten basert på standard entalpiendring av formasjonshensyn ; dvs. deres stabilitet. Ettersom denne verdien er null for vann, men strengt positiv for oksygen og hydrogen, er de fleste eksiteringsnivåene til disse siste artene over vannene. Deretter øker tettheten av eksiteringsnivåene for et gitt temperaturområde monotont med arten entropi. En positiv entropiendring for vannsplitting betyr langt flere eksitasjonsnivåer i produktene. Følgelig
- En lav temperatur (T °), termisk omrøring tillater det meste at vannmolekylene blir eksitert ettersom hydrogen- og oksygenivåer krevde at høyere termisk agitasjon ble betydelig befolket (på det vilkårlige diagrammet kan 3 nivåer fylles for vann mot 1 for oksygen / hydrogen delsystem),
- Ved høy temperatur (T) er termisk omrøring tilstrekkelig for at oksygen / hydrogen-delsystemets eksitasjonsnivåer skal eksiteres (på det vilkårlige diagrammet kan 4 nivåer fylles ut for vann mot 8 for oksygen / hydrogen-delsystemet). I følge de foregående uttalelsene vil systemet således utvikle seg mot sammensetningen der de fleste av eksiteringsnivåene er like, dvs. et flertall av oksygen- og hydrogenslag.
Man kan forestille seg at hvis T var høy nok i likning (3), kunne ΔG bli opphevet, noe som betyr at vannsplitting ville forekomme selv uten arbeid ( termolyse av vann). Selv om det er mulig, vil dette kreve enorme høye temperaturer: å vurdere det samme systemet naturlig med damp i stedet for flytende vann (ΔH ° = 242 kJ / mol; ΔS ° = 44 J / mol / K) vil dermed gi nødvendige temperaturer over 3000K, som gjør reaktordesign og drift ekstremt utfordrende.
Derfor gir en enkelt reaksjon bare en frihetsgrad (T) for å produsere hydrogen og oksygen bare fra varme (selv om bruk av Le Chateliers prinsipp også vil tillate å senke termolysetemperaturen, må det i dette tilfellet tilveiebringes arbeid for å utvinne gassproduktene systemet)
Vanndeling med flere reaksjoner
Tvert imot, som vist av Funk og Reinstrom, gir flere reaksjoner (f.eks. K trinn) ytterligere midler for å tillate spontan vannsplitting uten arbeid takket være forskjellige entropiendringer ΔS ° i for hver reaksjon i. En ekstra fordel sammenlignet med vanntermolyse er at oksygen og hydrogen produseres hver for seg, og unngår komplekse separasjoner ved høye temperaturer.
De første forutsetningene (likning (4) og (5)) for at flere reaksjoner i skal være ekvivalent med vannsplitting er trivielle (jf. Hess lov ):
- (4)
- (5)
Tilsvarende er arbeidet ΔG som kreves av prosessen, summen av hvert reaksjonsarbeid ΔG i :
- (6)
Som likn. (3) er en generell lov, kan den brukes på nytt for å utvikle hver Ag i sikt. Hvis reaksjonene med positive (p indeks) og negative (n indeks) entropiendringer uttrykkes som separate summeringer, gir dette,
- (7)
Bruke lik. (6) for standardbetingelser tillater det å faktorisere ΔG ° i- vilkårene, gi,
- (8)
Vurder nå bidraget fra hver summering i likning. (8): For å minimere ΔG, må de være så negative som mulig:
- : -ΔS ° i er negative, så (TT °) må være så høyt som mulig: Derfor velger man å operere ved maksimal prosesstemperatur T H
- : -ΔS ° i er positive, (TT °) bør være ideelt negativt for å redusere ΔG. Praktisk sett kan man bare sette T lik T ° som minimum prosesstemperatur for å bli kvitt dette plagsomme begrepet (en prosess som krever lavere enn standard temperatur for energiproduksjon er en fysisk absurditet, da det ville trenge kjøleskap og dermed en høyere arbeidsinngang enn utgang). Følgelig blir likning (8),
- (9)
Til slutt kan man trekke ut fra denne siste ligningen forholdet som kreves for et nullarbeidskrav (ΔG ≤ 0)
- (10)
Følgelig kan en termokjemisk syklus med i-trinn defineres som sekvens av i-reaksjoner som tilsvarer vannsplittende og tilfredsstillende ligninger (4), (5) og (10) . Den sentrale punkt å huske i dette tilfelle er at prosesstemperaturen T H kan teoretisk være vilkårlig valgt (1000K som en referanse i de fleste av de tidligere studier, for høytemperatur-atomreaktorer), langt under vanntermo en.
Denne ligningen kan alternativt (og naturlig) avledes via Carnos teorem , som må respekteres av systemet som består av en termokjemisk prosess kombinert med en arbeidsproduserende enhet (kjemiske arter er altså i en lukket sløyfe):
- det kreves minst to varmekilder med forskjellige temperaturer for syklisk drift, ellers vil evig bevegelse være mulig. Dette er trivielt når det gjelder termolyse, ettersom drivstoffet forbrukes via en omvendt reaksjon. Følgelig, hvis det bare er en temperatur (termolyse-en), er maksimal arbeidsgjenoppretting i en brenselcelle det motsatte av Gibbs fri energi til vannsplittende reaksjon ved samme temperatur, dvs. null per definisjon av termolyse. Eller annerledes sagt, et drivstoff er definert av dets ustabilitet, så hvis vannet / hydrogen / oksygen-systemet bare eksisterer som hydrogen og oksygen (likevektstilstand), ville forbrenning (motor) eller bruk i en brenselcelle ikke være mulig.
- endotermiske reaksjoner velges med positive entropiendringer for å bli favorisert når temperaturen øker, og motsatt for de eksoterme reaksjonene.
- maksimal varme-til-arbeid-effektivitet er den av en Carnot-varmemotor med samme prosessbetingelser, dvs. en varm varmekilde ved TH og en kald temperatur ved T °,
- (11)
-
- arbeidseffekten W er den "edle" energien som er lagret i hydrogen- og oksygenproduktene (f.eks. frigitt som elektrisitet under drivstofforbruk i en brenselcelle ). Det tilsvarer således den frie Gibbs energiforandring av vannsplitende ΔG, og er maksimum i samsvar med ligning (3) ved den laveste temperaturen i prosessen (T °) der den er lik ΔG °.
- varmetilførselen Q er varmen som tilveiebringes av den varme kilden ved temperaturen TH til de endotermiske reaksjonene i den termokjemiske syklusen (delsystemet drivstofforbruk er eksoterm ):
- (12)
- Derfor er hvert varmebehov ved temperaturen T H ,
- (1. 3)
- Å erstatte likning (13) i likning (12) gir:
- (14)
Følgelig, ved å erstatte W (Ag °) og Q (lign. (14)) i lign. (11) gir etter omstilling lign. (10) (forutsatt at D s jeg ikke endres vesentlig med temperaturen, dvs. er lik D s ° i )
Ligning (10) har praktiske implikasjoner om minimum antall reaksjoner for en slik prosess i henhold til den maksimale prosesstemperatur TH . Faktisk, en numerisk applikasjon (Ag ° lik til 229 kJ / K for vann betraktet som damp) i tilfellet av de opprinnelig valgte forhold (høy temperatur kjernereaktor med T H og T ° henholdsvis lik 1000K og 298K) gir et minimum verdi rundt 330 J / mol / K for summering av de positive entropiendringene ΔS ° i av prosessreaksjonene.
Denne siste verdien er veldig høy da de fleste av reaksjonene har entropiendringsverdier under 50 J / mol / K, og til og med en forhøyet (f.eks. Vannsplitting fra flytende vann: 163 J / mol / K) er to ganger lavere. Følgelig er termokjemiske sykluser sammensatt av mindre enn tre trinn praktisk talt umulige med de opprinnelig planlagte varmekildene (under 1000K), eller krever "hybrid" -versjoner
Hybrid termokjemiske sykluser
I dette tilfellet blir en ekstra frihetsgrad lagt til via en relativt liten arbeidsinngang W add (maksimalt arbeidsforbruk, likhet (9) med ΔG ≤ W tillegg ), og likhet (10) blir,
- (15)
Hvis W add blir uttrykt som en brøkdel f av prosessvarmen Q (ligning (14)), blir ligning (15) etter omorganisering,
- (16)
Å bruke en arbeidsinngang tilsvarer en brøkdel f av varmetilførselen er ekvivalent i forhold til valget av reaksjonene for å drive en ren lignende termokjemisk syklus, men med en varm kilde med en temperatur økt med samme andel f.
Naturligvis reduserer dette varme-til-arbeid-effektiviteten i samme andel f . Følgelig, hvis man ønsker en prosess som ligner på en termokjemisk syklus som opererer med en 2000K varmekilde (i stedet for 1000K), er maksimal varme-til-arbeid-effektivitet to ganger lavere. Ettersom reell effektivitet ofte er betydelig lavere enn den ideelle, er en slik prosess derfor sterkt begrenset.
Praktisk sett er bruk av arbeid begrenset til viktige trinn som produktseparasjoner, der teknikker som er avhengige av arbeid (f.eks. Elektrolyse) noen ganger kan ha færre problemer enn de som bare bruker varme (f.eks. Destillasjoner )
Spesielt tilfelle: To-trinns termokjemiske sykluser
I henhold til ligning (10) avtar minimumskravet til entropi (riktig begrep) for summeringen av de positive entropiendringene når TH øker. Som et eksempel, utfører den samme numeriske søknad, men med T H lik til 2000K ville gi en to ganger lavere verdi (omkring 140 kJ / mol), som tillater termosykler med bare to reaksjoner. Slike prosesser kan realistisk kobles med konsentrerte solenergiteknologier som Solar Updraft Tower . Som et eksempel i Europa er dette målet for Hydrosol-2- prosjektet (Hellas, Tyskland ( German Aerospace Center ), Spania, Danmark, England) og forskningen fra solavdelingen til ETH Zürich og Paul Scherrer Institute ( Sveits).
Eksempler på reaksjoner som tilfredsstiller høye entropi endringer er metalloksyd dissosiasjon , som produktene har flere eksitasjons- nivåer på grunn av deres gassform (metalldamper og oksygen) enn reaktanten (fast stoff med krystallinsk struktur, slik symmetri dramatisk reduserer antall forskjellige eksiteringsfrekvenser nivåer) . Følgelig kan disse entropiendringene ofte være større enn den vannsplittende, og det kreves derfor en reaksjon med en negativ entropiendring i den termokjemiske prosessen slik at likning (5) blir oppfylt. Videre, forutsatt lignende stabiliteter av reaktanten (ΔH °) for både termolyse og oksyddissosiasjon, forklarte en større entropiendring i det andre tilfellet igjen en lavere reaksjonstemperatur (ligning (3)).
La oss anta to reaksjoner, med positive ( 1 tegn, ved TH ) og negative ( 2 skrift, ved T °) endringer i entropi. En ekstra egenskap kan utledes for å ha TH strengt lavere enn termolysetemperaturen: Standard termodynamiske verdier må være ujevnt fordelt på reaksjonene .
I følge de generelle ligningene (2) (spontan reaksjon), (4) og (5) må man faktisk tilfredsstille,
- (17)
Derfor, hvis ΔH ° 1 er proporsjonal med ΔH ° 2 med en gitt faktor, og hvis ΔS ° 1 og ΔS ° 2 følger en lignende lov (samme proporsjonalitetsfaktor), blir ulikheten (17) brutt (likhet i stedet, så T H tilsvarer vanntermolysetemperaturen).
Eksempler
Hundrevis av slike sykluser er blitt foreslått og undersøkt. Denne oppgaven har blitt lettere av tilgjengeligheten av datamaskiner, slik at en systematisk screening av kjemiske reaksjonssekvenser er basert på termodynamiske databaser. Bare de viktigste "familiene" vil bli beskrevet i denne artikkelen.
sykluser med mer enn 3 trinn eller hybrid
Sykluser basert på svovelkjemien
En fordel med det svovelkjemiske elementet er dens høye kovalens . Faktisk kan den danne opptil 6 kjemiske bindinger med andre elementer som oksygen (f.eks. Sulfater), dvs. et bredt spekter av oksidasjonstilstander . Derfor eksisterer det flere redoksreaksjoner som involverer slike forbindelser. Denne friheten tillater mange kjemiske trinn med forskjellige entropiendringer, og gir dermed flere odds for å oppfylle kriteriene som kreves for en termokjemisk syklus (jf. Prinsipper). De fleste av de første studiene ble utført i USA, som et eksempel ved Kentucky University for sykluser av sulfidbaser. Sulfatbaserte sykluser ble studert i samme laboratorium og også ved Los Alamos National Laboratory og ved General Atomics . Betydelige undersøkelser basert på sulfater (f.eks. FeSO 4 og CuSO 4 ) ble også utført i Tyskland og i Japan. Imidlertid er syklusen som har gitt opphav til de høyeste interessene sannsynligvis den ( svovel-jod-syklusen ) (akronym: SI) oppdaget av General Atomics.
Sykler basert på omvendt Deacon-prosess
Over 973K er Deacon-reaksjonen reversert og gir hydrogenklorid og oksygen fra vann og klor :
- H 2 O + Cl 2 → 2 HCl + 1/2 O 2
Se også
- Jernoksid syklus
- Cerium (IV) oksid-cerium (III) oksidsyklus
- Kobber-klorsyklus
- Hybrid svovelsyklus
- Hydrosol-2
- Svovel-jodsyklus
- Sink sink-oksidsyklus
- UT-3 syklus