Thymocytt - Thymocyte
En tymocytt er en immuncelle som er tilstede i thymus , før den gjennomgår transformasjon til en T -celle . Thymocytter produseres som stamceller i benmargen og når thymus via blodet . Thymopoiesis beskriver prosessen som gjør thymocytter til modne T -celler i henhold til enten negativt eller positivt utvalg. Denne utvelgelsesprosessen er svært viktig for å forme befolkningen av tymocytter til en perifer pool av T -celler som er i stand til å reagere på fremmede patogener, men forblir tolerante overfor kroppens egne antigener. Positiv seleksjon velger celler som er i stand til å binde MHC klasse I eller II molekyler med minst en svak affinitet. Dette eliminerer (ved en prosess som kalles "død ved forsømmelse") de T-cellene som ville være ikke-funksjonelle på grunn av manglende evne til å binde MHC. Negativ seleksjon ødelegger tymocytter med høy affinitet for selvpeptider eller MHC. Dette eliminerer celler som vil lede immunresponsene mot selvproteiner i periferien. Negativ seleksjon er ikke 100% effektiv, og noen autoreaktive T -celler slipper ut og slippes ut i sirkulasjonen. Ytterligere mekanismer for perifer toleranse eksisterer for å dempe disse cellene, men hvis disse mislykkes, kan autoimmunitet oppstå.
Modningsstadier
Thymocytter er klassifisert i en rekke forskjellige modningstrinn basert på uttrykk for celleoverflatemarkører. Det tidligste tymocyttstadiet er det doble negative trinnet (negativt for både CD4 og CD8), som mer nylig har blitt bedre beskrevet som Lineage-negativt, og som kan deles inn i fire understadier. Det neste store trinnet er det doble positive trinnet (positivt for både CD4 og CD8). Det siste stadiet i modning er det eneste positive trinnet (positivt for enten CD4 eller CD8).
Hos mus
| Scene | Definere overflatemarkører | plassering | Betydelige hendelser |
| Dobbel negativ 1 eller ETP (Early T lineage Progenitor) | Avstamning- CD44 + CD25 - CD117 + | cortex | Spredning, tap av B og myeloide potensialer |
| Dobbel negativ 2 | Avstamning-CD44+CD25+CD117+ | cortex | - |
| Dobbel negativ 3 | Avstamning-CD44-CD25+ | cortex | Omorganisering av TCR-beta, betavalg |
| Dobbel negativ 4 | Avstamning-CD44-CD25- | cortex | - |
| Dobbelt positivt | CD4 + CD8 + | cortex | Omorganisering av TCR-alfa, positivt utvalg, negativt utvalg |
| Singelpositiv | CD4+CD8- eller CD4-CD8+ | medulla | Negativt utvalg |
Hos mennesker
Hos mennesker bor sirkulerende CD34+ hematopoietiske stamceller ( HSC ) i benmarg. De produserer forløpere for T -lymfocytter, som frøer thymus (dermed blir thymocytter) og differensierer under påvirkning av hakk og dens ligander.
Tidlige, doble negative tymocytter uttrykker (og kan identifiseres med) CD2 , CD5 og CD7 . Fremdeles i det doble negative stadiet stopper CD34 -uttrykket og CD1 uttrykkes. Uttrykk for både CD4 og CD8 gjør dem dobbelt positive , og modnes til enten CD4+ eller CD8+ celler.
Hendelser under modning
| type: | funksjonell (beta -utvalg) | funksjonell (positivt utvalg) | autoreaktiv (negativt utvalg) |
| plassering: | cortex | cortex | cortex/medulla |
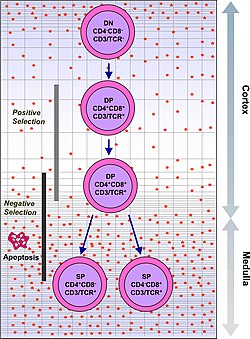 |
For å passere β-seleksjonskontrollpunktet, må β-kjeden til T-celle reseptoren omorganisert av tymocytt beholde de strukturelle egenskapene slik at den kan presenteres på overflaten av tymocytten med pre-TCRα. Dette eliminerer tymocytter med grove defekter introdusert i T -celle reseptoren ved genarrangering. |
For å bli positivt valgt , må tymocytter samhandle med flere celleoverflatemolekyler, MHC , for å sikre reaktivitet og spesifisitet. Positiv seleksjon velger celler med en T -celle reseptor som er i stand til å binde MHC klasse I eller II molekyler med minst en svak affinitet. Dette eliminerer (ved en prosess som kalles "død ved omsorgssvikt") de T-cellene som ville være ikke-funksjonelle på grunn av manglende evne til å binde MHC. |
Negativ seleksjon er aktiv induksjon av apoptose i tymocytter med høy affinitet for selvpeptider eller MHC. Dette eliminerer celler som vil lede immunresponsene mot selvproteiner i periferien. Negativ seleksjon er ikke 100% effektiv, noen autoreaktive T -celler slipper unna thymisk sensur og slippes ut i sirkulasjonen. Ytterligere mekanismer for toleranse som er aktive i periferien, eksisterer for å dempe disse cellene, for eksempel anergi , sletting og regulatoriske T -celler . Hvis disse perifere toleransemekanismene også mislykkes, kan autoimmunitet oppstå. |
Thymus bosetter seg
Thymocytter er til slutt avledet fra hematopoietiske stamceller i benmargen [se hematopoietiske stamceller , hematopoiesis ] som når tymusen gjennom sirkulasjonen. Antallet forfedre som kommer inn i thymus hver dag antas å være ekstremt lite. Derfor, hvilke forfedre som koloniserer thymus er ukjent. For tiden foreslås tidlige lymfoidprogenitorer (ELP) å bosette thymus og er sannsynligvis forløperne til minst noen thymocytter. ELP er Lineage-CD44+ CD25-CD117+ og ligner dermed nær ETP, de tidligste forfedrene i thymus. Forløpere kommer inn i thymus i kortikom-medullær krysset. Molekyler som er kjent for å være viktige for thymusoppføring inkluderer P-selectin (CD62P) og kjemokinreseptorene CCR7 og CCR9 .
Etter thymus -inntreden formerer forfedre seg for å generere ETP -populasjonen. Dette trinnet blir fulgt av generering av DN2-tymocytter som migrerer fra kortikomedullær krysset mot thymuskapsel. DN3 tymocytter genereres ved den subkapsulære sonen.
I tillegg til spredning forekommer differensiering og T -avstamning i DN -tymocyttpopulasjonen. Engasjement, eller tap av alternative avstamningspotensialer (for eksempel myeloid-, B- og NK -avstamningspotensialer), er avhengig av Notch -signalering , og fullføres innen DN3 -stadiet. Etter forpliktelse til T-avstamning, gjennomgår DN3-tymocytter β-seleksjon.
β-utvalg
T -cellers evne til å gjenkjenne fremmede antigener formidles av T -celle reseptoren (TCR), som er et overflateprotein som er i stand til å gjenkjenne korte proteinsekvenser ( peptider ) som presenteres på MHC . Hensikten med tymocyttutvikling er å produsere modne T -celler med et mangfoldig utvalg av funksjonelle T -cellereseptorer, gjennom prosessen med TCR -genarrangement.
I motsetning til de fleste gener, som har en stabil sekvens i hver celle som uttrykker dem, består T -celle reseptoren av en rekke alternative genfragmenter. For å lage en funksjonell T-celle reseptor bruker de doble negative tymocyttene en rekke DNA-interagerende enzymer for å klippe DNA og bringe separate genfragmenter sammen. Resultatet av denne prosessen er at hver T -celle reseptor har en annen sekvens på grunn av forskjellige valg av genfragmenter og feilene som ble introdusert under skjære- og sammenføyningsprosessen (se avsnitt om V (D) J -rekombinasjon for mer informasjon om TCR -omorganisering) . Den evolusjonære fordelen ved å ha et stort antall unike T -celle reseptorer er at hver T -celle er i stand til å gjenkjenne et annet peptid, og gir et forsvar mot raskt utviklende patogener.
Omorganisering av TCR skjer i to trinn. Først omorganiseres TCRβ -kjeden på DN3 -stadiet av T -celleutvikling. TCRβ-kjeden er paret med pre-Tα for å generere pre-TCR. Den cellulære ulempen ved omorganiseringsprosessen er at mange av kombinasjonene av T-celle reseptorgenfragmentene er ikke-funksjonelle. For å eliminere tymocytter som har dannet en ikke-funksjonell T-celle reseptor , får bare celler som har omorganisert betakjeden for å produsere en funksjonell pre-TCR utvikle seg utover DN3-stadiet. Celler som ikke klarer å produsere en funksjonell pre-TCR elimineres ved apoptose . Denne prosessen kalles beta-seleksjonskontrollpunktet. Vellykket beta-utvalg krever at TCRβ produseres, TCRβ er i stand til å koble seg sammen med pre-Tα for å generere pre-TCR, og at pre-TCR kan samhandle på celleoverflaten med TCR-signalproteinene.
I β-seleksjonstrinnet på samme måte som det modne TCR, danner pre-TCR også en immunologisk synapse. Selv om pre-TCR og den peptidbundne MHC-interaksjonen ikke er avgjørende for T-celleutvikling, spiller den en kritisk rolle for å oppmuntre til foretrukket spredning av celler hvis pre-TCR kan binde selv-MHC.
Etter β-utvalg tymocytter genererer CD4+ CD8+ dobbel positive celler, som deretter gjennomgår TCRα omorganisering, noe som resulterer i fullstendig samlet TCR.
Positivt utvalg og slektsengasjement
Thymocytter som passerer β-seleksjon uttrykker en T-celle reseptor som er i stand til å samles på overflaten. Imidlertid vil mange av disse T-cellereseptorene fremdeles være ikke-funksjonelle på grunn av manglende evne til å binde MHC . Det neste store stadiet av tymocyttutvikling er positiv seleksjon, bare for å beholde de tymocyttene som har en T -celle reseptor som er i stand til å binde MHC. T -celle reseptoren krever CD8 som en coreceptor for å binde seg til MHC klasse I, og CD4 som en coreceptor for å binde MHC klasse II. På dette stadiet oppregulerer tymocytter både CD4 og CD8 og blir til dobbel positive celler.
Doble positive tymocytter som har en T -celle reseptor som er i stand til å binde MHC klasse I eller klasse II (selv med svak affinitet) mottar signalering gjennom T -celle reseptoren. Thymocytter som har en T -celle reseptor som ikke er i stand til å binde MHC klasse I eller klasse II gjennomgår apoptose . Noen tymocytter er i stand til å redde mislykket positivt utvalg ved reseptorredigering (omorganisering av den andre T -celle reseptorallelen for å produsere en ny T -celle reseptor).
De doble positive tymocyttene gjennomgår slektsengasjement, og modnes til en CD8+ T -celle (gjenkjenner MHC klasse I) eller en CD4+ T -celle (gjenkjenner MHC klasse II). Linjeforpliktelse skjer på det sene stadiet av positiv seleksjon og fungerer ved nedregulering av både CD4 og CD8 (reduserer signalet fra T -celle reseptoren) og deretter bare oppregulering av CD4. Tymocytter som begynner å motta signal igjen er de som gjenkjenner MHC klasse II, og de blir CD4+ T -celler. Tymocytter som ikke begynner å motta signal igjen er de som gjenkjenner MHC klasse I, og de nedregulerer CD4 og oppregulerer CD8 for å bli CD8+ T -celler. Begge disse tymocyttypene er kjent som enkle positive tymocytter.
Negativt utvalg
Suksess med positiv seleksjon gjør at tymocytten kan gjennomgå en rekke modningsendringer under overgangen til en enkelt positiv T -celle. De eneste positive T -cellene oppregulerer kjemokinreseptoren CCR7, og forårsaker migrasjon fra cortex til medulla. På dette stadiet innebærer nøkkelmodningsprosessen negativ seleksjon, eliminering av autoreaktive tymocytter.
Den viktigste ulempen i en gen-omorganiseringsprosess for T-celle reseptorer er at ved tilfeldig tilfeldighet vil noen arrangementer av genfragmenter skape en T-celle reseptor som er i stand til å binde selvpeptider presentert på MHC klasse I eller MHC klasse II. Hvis T -celler som bærer disse T -cellereseptorene skulle komme inn i periferien, ville de være i stand til å aktivere en immunrespons mot meg selv, noe som resulterer i autoimmunitet . Negativt utvalg er prosessen som er utviklet for å redusere denne risikoen. Under negativ seleksjon induseres alle tymocytter med høy affinitet for binding av selvpeptider presentert på MHC klasse I eller klasse II til å oppregulere BCL2L11 , et protein som driver apoptose. Celler som ikke har høy affinitet for selvantigener overlever negativ seleksjon. På dette stadiet blir noen celler også valgt til å bli regulatoriske T-celler , vanligvis celler som har en mellomliggende affinitet for selvpeptid.
Negativ seleksjon kan forekomme på det dobbelte positive stadiet i cortex. Imidlertid er repertoaret av peptider i cortex begrenset til de som uttrykkes av epitelceller, og doble positive celler er dårlige til å gjennomgå negativ seleksjon. Derfor er det viktigste stedet for negativt utvalg medulla, når cellene er på det eneste positive stadiet. For å fjerne tymocytter som er reaktive mot perifere organer, driver transkripsjonsfaktorene Aire og Fezf2 ekspresjonen av flere perifere antigener, for eksempel insulin, noe som resulterer i sletting av celler som er spesifikke for disse antigenene. Dette gjør at enkelt positive tymocytter kan utsettes for et mer komplekst sett med selvantigener enn det som er tilstede i cortex, og sletter derfor mer effektivt de T-cellene som er autoreaktive.
Enkelt positive tymocytter forblir i medulla i 1-2 uker, og undersøker selvantigener for å teste for autoreaktivitet. I løpet av denne tiden gjennomgår de endelige modningsendringer, og forlater deretter thymus ved hjelp av S1P og CCR7. Ved inntreden i det perifere blodet regnes cellene som modne T -celler, og ikke tymocytter.
Negativ seleksjon er ikke 100% effektiv, noen autoreaktive T -celler slipper unna thymisk sensur og slippes ut i sirkulasjonen. Ytterligere mekanismer for perifer toleranse aktiv i periferien eksisterer for å dempe disse cellene, for eksempel anergi , sletting og regulatoriske T -celler . Hvis disse perifere toleransemekanismene også mislykkes, kan autoimmunitet oppstå.
Thymus-transplantasjon resulterer i at T-celler blir lært å unngå å reagere med donorantigener i stedet, og kan fortsatt reagere med mange selvantigener i kroppen. Autoimmun sykdom er en hyppig komplikasjon etter tymus-transplantasjon, funnet hos 42% av pasientene over 1 år etter transplantasjon. Dette forklares imidlertid delvis med at selve indikasjonen, det vil si fullstendig DiGeorge syndrom (fravær av thymus), øker risikoen for autoimmun sykdom.
Kreft
Thymocytter som får onkogene mutasjoner som tillater ukontrollert spredning kan bli tymiske lymfomer .
Alternative avstamninger
I tillegg til klassiske αβ T -celler (hvis utvikling er skissert ovenfor), utvikler en rekke andre T -linjer seg i thymus, inkludert γδ T -celler og Natural Killer T (NKT) -celler. I tillegg kan andre ikke-T hematopoietiske linjer utvikle seg i thymus, inkludert B-lymfocytter (B-celler), Natural Killer-lymfocytter (NK-celler).), Myeloide celler og dendritiske celler. Thymus er imidlertid ikke en kilde til utvikling av B, NKC eller myeloid (denne uttalelsen er ikke sant for alle B-celler eller NKC). Utviklingen av disse cellene i thymus gjenspeiler den multi-potente naturen til hematopoietiske forfedre som frø thymus. Eldre B-celler og andre APCer kan også finnes i medulla som bidrar til negative seleksjonsprosesser.