Sirkulær dikroisme - Circular dichroism
Sirkulær dikroisme ( CD ) er dikroisme som involverer sirkulært polarisert lys, det vil si differensiell absorpsjon av venstre- og høyrehendt lys . Venstre sirkulær (LHC) og høyre sirkulær (RHC) polarisert lys representerer to mulige spinnvinkelmomenttilstander for et foton, og derfor kalles sirkulær dikroisme også som dikroisme for spinnvinkelmoment. Dette fenomenet ble oppdaget av Jean-Baptiste Biot , Augustin Fresnel og Aimé Cotton i første halvdel av 1800-tallet. Sirkulær dikroisme og sirkulær dobbeltbrytning er manifestasjoner av optisk aktivitet . Det vises i absorpsjonsbåndene til optisk aktive kirale molekyler. CD -spektroskopi har et bredt spekter av applikasjoner på mange forskjellige felt. Spesielt brukes UV -CD for å undersøke den sekundære strukturen til proteiner. UV/Vis CD brukes til å undersøke ladningsoverføringer . Nær-infrarød CD brukes til å undersøke geometrisk og elektronisk struktur ved å undersøke metall d → d overganger. Vibrasjonell sirkulær dikroisme , som bruker lys fra det infrarøde energiområdet, brukes til strukturelle studier av små organiske molekyler, og sist proteiner og DNA.
Fysiske prinsipper
Sirkulær polarisering av lys
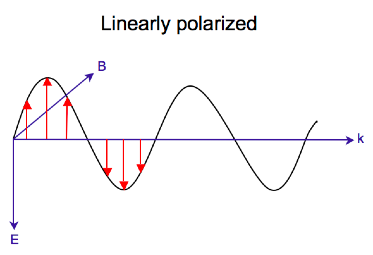
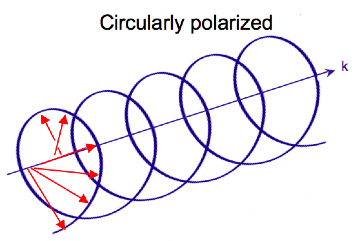
Elektromagnetisk stråling består av et elektrisk og magnetisk felt som svinger vinkelrett på hverandre og på forplantningsretningen, en tverrgående bølge . Mens lineært polarisert lys oppstår når den elektriske feltvektoren bare svinger i ett plan, oppstår sirkulært polarisert lys når retningen til det elektriske feltvektoren roterer rundt dens forplantningsretning mens vektoren beholder konstant størrelse. På et enkelt punkt i rommet vil den sirkulært polariserte vektoren spore en sirkel over en periode av bølgefrekvensen, derav navnet. De to diagrammene nedenfor viser de elektriske feltvektorene til lineært og sirkulært polarisert lys, på et tidspunkt, for en rekke posisjoner; plottet til den sirkulært polariserte elektriske vektoren danner en helix langs forplantningsretningen . For venstre sirkulært polarisert lys (LCP) med forplantning mot observatøren roterer den elektriske vektoren mot klokken . For høyre sirkulært polarisert lys (RCP) roterer den elektriske vektoren med klokken.
Interaksjon mellom sirkulært polarisert lys og materie
Når sirkulært polarisert lys passerer gjennom et absorberende optisk aktivt medium, varierer hastighetene mellom høyre og venstre polarisasjon ( ) så vel som deres bølgelengde ( ) og i hvilken grad de absorberes ( ). Sirkulær dikroisme er forskjellen . Det elektriske feltet til en lysstråle forårsaker en lineær forskyvning av ladning ved interaksjon med et molekyl ( elektrisk dipol ), mens dets magnetfelt forårsaker en sirkulasjon av ladning ( magnetisk dipol ). Disse to bevegelsene tilsammen forårsaker en eksitasjon av et elektron i en spiralformet bevegelse, som inkluderer translasjon og rotasjon og tilhørende operatører . Det eksperimentelt bestemte forholdet mellom rotasjonsstyrken til en prøve og den er gitt av
Rotasjonsstyrken er også bestemt teoretisk,
Vi ser fra disse to ligningene at for å ha ikke-null må de elektriske og magnetiske dipolmomentoperatørene ( og ) transformere som den samme ureduserbare representasjonen . og er de eneste punktgruppene der dette kan skje, noe som bare gjør kirale molekyler CD aktive.
Enkelt sagt, siden sirkulært polarisert lys i seg selv er "kiralt", samhandler det annerledes med kirale molekyler . Det vil si at de to typene sirkulært polarisert lys absorberes i forskjellige omfang. I et CD -eksperiment blir like mengder av venstre og høyre sirkulært polarisert lys med en valgt bølgelengde vekselvis utstrålt til en (chiral) prøve. Den ene av de to polariseringene absorberes mer enn den andre, og denne bølgelengdeavhengige absorpsjonsforskjellen måles, noe som gir prøvens CD-spektrum. På grunn av samspillet med molekylet, sporer lysets elektriske feltvektor en elliptisk bane etter å ha passert gjennom prøven.
Det er viktig at kiraliteten til molekylet kan være konformasjonell snarere enn strukturell. Det er for eksempel et proteinmolekyl med en spiralformet sekundær struktur som kan ha en CD som endres med endringer i konformasjonen.
Delta absorbans
Per definisjon,
hvor (Delta Absorbance) er forskjellen mellom absorbansen til venstre sirkulært polarisert (LCP) og høyre sirkulært polarisert (RCP) lys (dette er det som vanligvis måles). er en funksjon av bølgelengde , så for at en måling skal være meningsfull må bølgelengden den ble utført på være kjent.
Molar sirkulær dikroisme
Det kan også uttrykkes ved å anvende Beers lov , som:
hvor
- og er molar -utryddelseskoeffisientene for LCP- og RCP -lys,
- er molarkonsentrasjonen ,
- er banelengden i centimeter (cm).
Deretter
er den molære sirkulære dikroismen. Denne egenskapen er det som vanligvis menes med stoffets sirkulære dikroisme. Siden er en funksjon av bølgelengde, må en molær sirkulær dikroismeverdi ( ) spesifisere bølgelengden den er gyldig ved.
Ekstrinsiske effekter på sirkulær dikroisme
I mange praktiske anvendelser av sirkulær dikroisme (CD), som diskutert nedenfor, er den målte CD -en ikke bare en iboende egenskap for molekylet, men avhenger snarere av den molekylære konformasjonen. I et slikt tilfelle kan CD -en også være en funksjon av temperatur, konsentrasjon og det kjemiske miljøet, inkludert løsemidler. I dette tilfellet må den rapporterte CD -verdien også spesifisere disse andre relevante faktorene for å være meningsfull.
I ordnede strukturer som mangler todelt rotasjonssymmetri, avhenger optisk aktivitet, inkludert differensialoverføring (og refleksjon) av sirkulært polariserte bølger også av forplantningsretningen gjennom materialet. I dette tilfellet er såkalt ekstrinsisk 3d kiralitet assosiert med den gjensidige orienteringen til lysstråle og struktur.
Molær elliptisitet
Selv om det vanligvis måles, rapporteres de fleste målingene av historiske årsaker i grader av elliptisitet. Molar elliptisitet er sirkulær dikroisme korrigert for konsentrasjon. Molar sirkulær dikroisme og molar elliptisitet,, blir lett omdannet av ligningen:
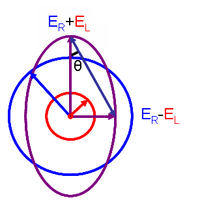
Dette forholdet er avledet ved å definere elliptisiteten til polarisasjonen som:
hvor
- og er størrelsen på de elektriske feltvektorene til henholdsvis høyre-sirkulært og venstre-sirkulært polarisert lys.
Når er lik (når det ikke er noen forskjell i absorbansen av høyre- og venstresirkulært polarisert lys), er 0 ° og lyset er lineært polarisert . Når enten eller er lik null (når det er fullstendig absorbans av det sirkulære polariserte lyset i en retning), er 45 ° og lyset er sirkulært polarisert .
Vanligvis er sirkulær dikroismeeffekt liten, så liten og kan tilnærmes som i radianer . Siden lysets intensitet eller bestråling , er proporsjonal med kvadratet til den elektriske feltvektoren, blir elliptisiteten:
Deretter ved å erstatte I ved å bruke Beers lov i naturlig logaritmeform :
Elliptisiteten kan nå skrives som:
Siden kan dette uttrykket tilnærmes ved å utvide eksponensialene i en Taylor-serie til første orden og deretter kassere vilkårene i sammenligning med enhet og konvertere fra radianer til grader:
Den lineære avhengigheten av oppløst konsentrasjon og sti -lengde fjernes ved å definere molar elliptisitet som,
Ved å kombinere de to siste uttrykkene med Beers lov , blir molar elliptisitet:
Enhetene for molar elliptisitet er historisk sett (deg · cm 2 /dmol). For å beregne molar elliptisitet må prøvekonsentrasjonen (g/L), cellebanelengden (cm) og molekylvekten (g/mol) være kjent.
Hvis prøven er et protein, brukes gjennomsnittlig restvekt (gjennomsnittlig molekylvekt av aminosyrerestene den inneholder) ofte i stedet for molekylvekten, og behandler i hovedsak proteinet som en løsning av aminosyrer. Ved å bruke gjennomsnittlig elliptisitet for rester blir det lettere å sammenligne CD -en med proteiner med forskjellig molekylvekt; bruk av denne normaliserte CD -en er viktig i studier av proteinstruktur.
Gjennomsnittlig elliptisitet av rester
Metoder for estimering av sekundær struktur i spesielt polymerer, proteiner og polypeptider krever ofte at det målte molære elliptisitetsspekteret omdannes til en normalisert verdi, spesielt en verdi uavhengig av polymerlengden. Gjennomsnittlig elliptisitet av rester brukes til dette formålet; det er ganske enkelt den målte molære elliptisiteten til molekylet delt på antall monomerenheter (rester) i molekylet.
Søknad på biologiske molekyler
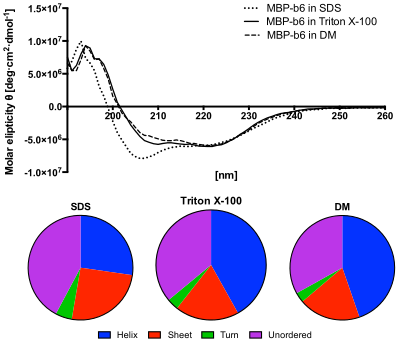
Nedre panel: Innholdet i sekundære strukturer forutsagt fra CD -spektrene ved bruk av CDSSTR -algoritmen. Proteinet i SDS -løsningen viser økt innhold av uordnede strukturer og redusert spiralinnhold.
Generelt vil dette fenomenet bli vist i absorpsjonsbånd av et optisk aktivt molekyl. Som en konsekvens utviser sirkulær dikroisme av biologiske molekyler på grunn av deres dextrorotære og levorotære komponenter. Enda viktigere er at en sekundær struktur også vil gi sine respektive molekyler en distinkt CD. Derfor har alfa -helixen til proteiner og den dobbelte helixen av nukleinsyrer CD -spektralsignaturer som er representative for deres strukturer. CDens evne til å gi en representativ strukturell signatur gjør den til et kraftig verktøy i moderne biokjemi med applikasjoner som finnes i praktisk talt alle studieretninger.
CD er nært knyttet til optisk rotasjonsdispersjon (ORD) teknikk, og regnes generelt som mer avansert. CD måles i eller nær absorpsjonsbåndene til molekylet av interesse, mens ORD kan måles langt fra disse båndene. CDs fordel er tydelig i dataanalysen. Strukturelle elementer skiller seg tydeligere ut siden deres innspilte bånd ikke overlapper mye på bestemte bølgelengder som de gjør i ORD. I prinsippet kan disse to spektrale målingene omdannes gjennom en integrert transformasjon ( Kramers - Kronig -forholdet ), hvis alle absorpsjonene er inkludert i målingene.
Det fjerne UV ( ultrafiolette ) CD-spekteret av proteiner kan avsløre viktige egenskaper ved deres sekundære struktur . CD-spektra kan lett brukes til å estimere brøkdelen av et molekyl som er i alfa-helix- konformasjonen, beta- bladkonformasjonen, beta-turn- konformasjonen eller en annen (f.eks. Tilfeldig spole ) konformasjon. Disse fraksjonelle oppgavene plasserer viktige begrensninger for de mulige sekundære konformasjonene som proteinet kan være i. CD kan generelt ikke si hvor alfa -helixene som oppdages er plassert i molekylet eller til og med fullstendig forutsi hvor mange det er. Til tross for dette er CD et verdifullt verktøy, spesielt for å vise endringer i konformasjon. Den kan for eksempel brukes til å studere hvordan den sekundære strukturen til et molekyl endres som en funksjon av temperaturen eller av konsentrasjonen av denaturerende midler, f.eks. Guanidiniumklorid eller urea . På denne måten kan den avsløre viktig termodynamisk informasjon om molekylet (for eksempel entalpien og Gibbs gratis denatureringsenergi) som ellers ikke lett kan oppnås. Alle som prøver å studere et protein, vil finne CD som et verdifullt verktøy for å bekrefte at proteinet er i sin opprinnelige form før det utføres omfattende og/eller dyre eksperimenter med det. Det er også en rekke andre bruksområder for CD-spektroskopi i proteinkjemi som ikke er relatert til estimering av alfa-helixfraksjoner. Videre har CD -spektroskopi blitt brukt i bio -uorganiske grensesnittstudier. Spesielt har den blitt brukt til å analysere forskjellene i sekundærstrukturen til et konstruert protein før og etter titrering med et reagens.
Nær UV-CD-spekteret (> 250 nm) av proteiner gir informasjon om den tertiære strukturen . Signalene som oppnås i 250–300 nm -regionen skyldes absorpsjon, dipolorientering og naturen til omgivelsene til fenylalanin, tyrosin, cystein (eller SS -disulfidbroer ) og tryptofan -aminosyrer . I motsetning til langt UV-CD kan ikke nær-UV CD-spektret tilordnes noen bestemt 3D-struktur. Nær UV-CD-spektra gir heller strukturell informasjon om arten av de protetiske gruppene i proteiner, f.eks. Hemgruppene i hemoglobin og cytokrom c .
Synlig CD -spektroskopi er en veldig kraftig teknikk for å studere metall -protein -interaksjoner og kan løse individuelle d -d elektroniske overganger som separate bånd. CD -spektra i området for synlig lys produseres bare når et metallion befinner seg i et kiralt miljø, og dermed oppdages ikke frie metallioner i løsningen. Dette har fordelen av å bare observere det proteinbundne metallet, så pH-avhengighet og støkiometrier oppnås lett. Optisk aktivitet i overgangsmetallionkomplekser har blitt tilskrevet konfigurasjons-, konformasjons- og vicinaleffekter. Klewpatinond og Viles (2007) har produsert et sett med empiriske regler for forutsigelse av synlige CD-spektra for Cu 2+ og Ni 2+ kvadrat-plane komplekser som involverer histidin og hovedkjedekoordinering.
CD gir for eksempel mindre spesifikk strukturell informasjon enn røntgenkrystallografi og protein-NMR- spektroskopi, som begge gir atomoppløsningsdata. Imidlertid er CD -spektroskopi en rask metode som ikke krever store mengder proteiner eller omfattende databehandling. Dermed kan CD brukes til å kartlegge et stort antall løsningsmiddelbetingelser , varierende temperatur , pH , saltholdighet og tilstedeværelsen av forskjellige kofaktorer.
CD -spektroskopi brukes vanligvis til å studere proteiner i løsning, og dermed utfyller den metoder som studerer fast tilstand. Dette er også en begrensning ved at mange proteiner er innebygd i membraner i sin opprinnelige tilstand, og løsninger som inneholder membranstrukturer er ofte sterkt spredt. CD måles noen ganger i tynne filmer.
CD -spektroskopi er også utført ved bruk av halvledende materialer som TiO 2 for å oppnå store signaler i UV -bølgelengdeområdet, der de elektroniske overgangene for biomolekyler ofte forekommer.
Eksperimentelle begrensninger
CD har også blitt studert i karbohydrater , men med begrenset suksess på grunn av de eksperimentelle vanskelighetene knyttet til måling av CD -spektra i vakuum ultrafiolett (VUV) område av spekteret (100–200 nm), der de tilsvarende CD -båndene av usubstituerte karbohydrater ligger . Substituerte karbohydrater med bånd over VUV -regionen har blitt målt med hell.
Måling av CD blir også komplisert av det faktum at typiske vandige buffersystemer ofte absorberer i området der strukturelle trekk viser differensiell absorpsjon av sirkulært polarisert lys. Fosfat- , sulfat- , karbonat- og acetatbuffere er generelt uforenlige med CD med mindre de er ekstremt fortynnede, f.eks. I området 10–50 mM. TRIS-buffersystemet bør unngås helt når du utfører CD med langt UV-stråling. Borat- og Oniumforbindelser brukes ofte for å etablere det passende pH -området for CD -eksperimenter. Noen eksperimenter har erstattet kloridion med fluor fordi fluor absorberer mindre i fjern UV, og noen har jobbet i rent vann. En annen, nesten universell, teknikk er å minimere oppløsning av løsningsmidler ved å bruke kortere banelengdeceller når du arbeider i fjern UV, 0,1 mm banelengder er ikke uvanlige i dette arbeidet.
I tillegg til måling i vandige systemer kan CD, spesielt langt UV-CD, måles i organiske løsningsmidler, f.eks. Etanol, metanol, trifluoretanol (TFE). Sistnevnte har fordelen å indusere strukturdannelse av proteiner, indusere beta-ark i noen og alfa-helixer i andre, som de ikke ville vise under normale vandige forhold. De fleste vanlige organiske løsningsmidler som acetonitril , THF , kloroform , diklormetan er imidlertid inkompatible med langt UV-CD.
Det kan være av interesse å merke seg at protein -CD -spektraene som brukes i estimering av sekundær struktur, er relatert til π til π* orbitale absorpsjoner av amidbindinger som forbinder aminosyrene. Disse absorpsjonsbåndene ligger delvis i det såkalte vakuum ultrafiolette (bølgelengder mindre enn omtrent 200 nm). Bølgelengdeområdet av interesse er faktisk utilgjengelig i luft på grunn av den sterke absorpsjonen av lys av oksygen ved disse bølgelengdene. I praksis måles disse spektrene ikke i vakuum, men i et oksygenfritt instrument (fylt med ren nitrogengass ).
Når oksygen er eliminert, er kanskje den nest viktigste tekniske faktoren ved arbeid under 200 nm å designe resten av det optiske systemet for å ha lave tap i denne regionen. Kritisk i denne forbindelse er bruken av aluminiserte speil hvis belegg er optimalisert for lavt tap i dette området av spekteret.
Den vanlige lyskilden i disse instrumentene er en høytrykks, kortbue xenonlampe . Vanlige xenonbue lamper er uegnet for bruk i lav UV. I stedet må det brukes spesialkonstruerte lamper med konvolutter laget av syntetisk smeltet silisium av høy renhet .
Lys fra synkrotronkilder har en mye høyere fluks ved korte bølgelengder, og har blitt brukt til å spille inn CD ned til 160 nm. I 2010 ble CD -spektrofotometeret ved elektronlagringsringen ISA ved Universitetet i Aarhus i Danmark brukt til å ta opp CD -spektre i solid state ned til 120 nm. På kvantemekanisk nivå er funksjonstettheten til sirkulær dikroisme og optisk rotasjon identisk. Optisk roterende spredning og sirkulær dikroisme deler det samme kvanteinformasjonsinnholdet .
Se også
Referanser
Eksterne linker
- Circular Dichroism spectroscopy av Alliance Protein Laboratories, en kommersiell tjenesteyter
- En introduksjon til sirkulær dikroismespektroskopi av Applied Photophysics, en utstyrsleverandør
- En animert, trinn-for-trinn-opplæring om sirkulær dikroisme og optisk rotasjon av prof Valev.
























![{\ displaystyle [\ theta]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1456b03b038385e3bc52344dbf1a9bfbc41b4cf)
![[\ theta] = 3298.2 \, \ Delta \ varepsilon. \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66e42a40570e3d3cb312c0eadd95d59170dc258)











![{\ displaystyle [\ theta] = {\ frac {100 \ theta} {Cl}} \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec21d26e0b12e81313ef0b42bbb5ec4f63369c3d)
![[\ theta] = 100 \, \ Delta \ varepsilon \ left (\ frac {\ ln 10} {4} \ right) \ left (\ frac {180} {\ pi} \ right) = 3298.2 \, \ Delta \ varepsilon \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/88756c2cb3877d28ff0932ef432b0a5e4861ab58)