Organokopperforbindelse - Organocopper compound
Organokopperforbindelser i organometallisk kjemi inneholder kjemiske bindinger fra karbon til kobber . Organokopperkjemi er vitenskapen om organokopperforbindelser som beskriver deres fysiske egenskaper, syntese og reaksjoner. De er reagenser i organisk kjemi .
Den første organokobber- Forbindelsen, den eksplosive kobber (I) acetylid Cu 2 C 2 (Cu-C = C-Cu), ble syntetisert ved Rudolf Christian Böttger i 1859 ved å føre acetylen- gass gjennom kobber (I) klorid -løsning:
- C 2 H 2 + 2 CuCl → Cu 2 C 2 + 2 HCl
Struktur og liming
Organokobberforbindelser har forskjellig struktur og reaktivitet, men organokopperforbindelser er i stor grad begrenset i oksidasjonstilstander til kobber (I), noen ganger betegnet Cu + . Som metallsentrum ad 10 er det relatert til Ni (0), men på grunn av dets høyere oksidasjonstilstand, engasjerer det seg i mindre pi-tilbakebinding. Organiske derivater av Cu (II) og Cu (III) påkalles som mellomprodukter, men sjelden isolert eller til og med observert. Når det gjelder geometri, vedtar kobber (I) symmetriske strukturer, i tråd med det sfæriske elektroniske skallet. Vanligvis er en av tre koordineringsgeometrier vedtatt: lineær 2-koordinat, trigonal 3-koordinat og tetraedral 4-koordinat. Organokobberforbindelser danne komplekser med en rekke forskjellige myke ligander slik som alkylphosphines (R 3 P), tioetere (R- 2 S) og cyanid (CN - ).
Enkle komplekser med CO-, alken- og Cp-ligander
Kobber (I) salter har lenge vært kjent for å binde CO, om enn svakt. Et representativt kompleks er CuCl (CO), som er polymer. I motsetning til klassiske metallkarbonyler er ikke pi-tilbakebinding sterk i disse forbindelsene.

Alkener binder seg til kobber (I), men igjen generelt svakt. Bindingen av etylen til Cu i proteiner har stor betydning i plantebiologien så mye at etylen blir klassifisert som et plantehormon . Dens tilstedeværelse, oppdaget av Cu-proteinet, påvirker modning og mange andre utviklingstrekk.
Selv om kobber ikke danner metallocen , kan halv-sandwich-komplekser produseres. Et slikt derivat er (η-cyklopentadienyl trietylfosfin) kobber.
Alkyl- og aryl-kobberforbindelser
Alkyl og aryl kobber (I) forbindelser
Kobberhalogenider reagerer med organolitiumreagenser for å gi organokopperforbindelser. Området var banebrytende av Henry Gilman , som rapporterte metylkopper i 1936. Dermed fremstilles fenylkopper ved omsetning av fenyllitium med kobber (I) bromid i dietyleter . Grignard-reagenser kan brukes i stedet for organolitiumforbindelser. Gilman undersøkte også dialkylcuprates. Disse oppnås ved å kombinere to ekvivalente RLi med Cu (I) salter. Alternativt blir disse kobberene fremstilt fra oligomere nøytrale organokopperforbindelser ved behandling med en ekvivalent organolitiumreagens.
Forbindelser av typen [CuR n ] ( n -1) - er reaktive mot oksygen og vann og danner kobber (I) oksyd . De pleier også å være termisk ustabile, noe som kan være nyttig i visse koblingsreaksjoner. Til tross for eller på grunn av disse vanskelighetene blir organokopperreagenser ofte generert og konsumert in situ uten forsøk på å isolere dem. De brukes i organisk syntese som alkyleringsreagenser fordi de viser større funksjonell gruppetoleranse enn tilsvarende Grignard- og organolitiumreagenser. Den elektronegativitet av kobber er mye høyere enn dens nærmeste nabo i gruppe 12 elementer , sink , som tyder på redusert nukleofiliteten for sine karbon ligander.
Kobbersalter reagerer med terminale alkyner for å danne acetylidene .
Alkylhalogenider reagerer med organokopperforbindelser med inversjon av konfigurasjonen. På den annen side fortsetter reaksjoner av organisk kobberforbindelse med alkenylhalogenider med opprettholdelse av subtratets konfigurasjon.
Organokopperforbindelser kobles sammen med arylhalogenider:
Strukturer
Alkyl- og aryl-kobberkomplekser aggregerer både i krystallinsk form og i oppløsning. Aggregering er spesielt tydelig for ladningsneutrale organokopperforbindelser, dvs. arter med den empiriske formelen (RCu), som vedtar sykliske strukturer. Siden hvert kobbersenter krever minst to ligander, er den organiske gruppen en broligand . Denne effekten er illustrert av strukturen til mesitylcopper, som er en pentamer. En syklisk struktur er også sett for Cuch 2 SiMe 3 , først 1: 1 organokobber- forbindelsen som skal analyseres ved hjelp av røntgen- krystallografi (1972 av Lappert). Denne forbindelsen er relativt stabil fordi de store trimetylsilylgruppene gir sterisk beskyttelse. Det er en tetramer som danner en 8-leddet ring med vekslende Cu-C-bindinger. I tillegg danner de fire kobberatomene en plan Cu 4- ring basert på tre-senter to-elektronbindinger . Kobber til kobber bindingslengde er 242 pm sammenlignet med 256 pm i bulk kobber. I pentamesitylpentacopper dannes en 5-leddet kobberring , i likhet med (2,4,6-trimetylfenyl) gull, og pentafluorfenylcopper er en tetramer.
Litiumdimetylcuprat er en dimer i dietyleter og danner en 8-leddet ring med to litiumatomer som forbinder to metylgrupper. Tilsvarende danner litiumdifenylcuprat et dimereterat, [{Li (OEt 2 )} (CuPh 2 )] 2 , i fast tilstand.
Alkyl og aryl kobber (III) forbindelser
Involveringen av den ellers sjeldne Cu (III) oksidasjonstilstanden er demonstrert i konjugattilsetningen av Gilman-reagenset til en enone : I et såkalt NMR- eksperiment med hurtig injeksjon ved -100 ° C, Gilman-reagenset Me 2 CuLi ( stabilisert av litiumjodid ) ble introdusert til cykloheksenon ( 1 ) som muliggjorde påvisning av kobber-alken- pi-kompleks 2 . Ved påfølgende tilsetning av trimetylsilylcyanid dannes Cu (III) -arten 3 (ubestemt stabil ved den temperaturen) og ved å øke temperaturen til -80 ° C konjugataddisjonsproduktet 4 . I henhold til en medfølgende in silico eksperimenter Cu (III) mellomprodukt har en firkantet plan molekylær geometri med cyano -gruppen i cis-orientering i forhold til den cykloheksenyl metin gruppe og anti-parallell med den metin proton. Med andre ligander enn cyanogruppen forutsier denne studien stabile Cu (III) forbindelser ved romtemperatur .
Reaksjoner av organokuprater
Tverrkoblingsreaksjoner
Forut for utviklingen av palladium -katalysert krysskoblingsreaksjoner , kobber var det foretrukne katalysatoren for nesten et århundre. Palladium gir en raskere, mer selektiv reaksjon. Imidlertid har kobber de siste årene gjenoppstått som et syntetisk nyttig metall på grunn av lavere kostnader og fordi det er et miljøvennlig metall.
Reaksjoner av R- 2- CuLi med alkylhalogenider R'-X dannelse av koblingsproduktet:
- R 2 CuLi + R'X → RR' + cur + LiX
Den reaksjonsmekanisme omfatter oksydativ addisjon (OA) av alkylhalogenidet til Cu (I), som danner et plant Cu (III) mellomprodukt, fulgt av reduktiv eliminasjon (RE). Det nukleofile angrepet er det hastighetsbestemmende trinnet. Ved erstatning av jodid foreslås en enkelt-elektronoverføringsmekanisme (se figur).
Mange elektrofiler deltar i denne reaksjonen. Den omtrentlige rekkefølgen av reaktivitet, som begynner med den mest reaktive, er som følger: syreklorider > aldehyder > tosylater ~ epoksider > jodider > bromider > klorider > ketoner > estere > nitriler >> alkener
Generelt er OA-RE-mekanismen analog med den for palladiumkatalyserte tverrkoblingsreaksjoner. En forskjell mellom kobber og palladium er at kobber kan gjennomgå enkeltelektronoverføringsprosesser.
Koblingsreaksjoner
Oksidativ kobling er koblingen av kobberacetylider til konjugerte alkyner i Glaser-koblingen (for eksempel i syntesen av cyklooktadekanonona ) eller til arylhalogenider i Castro-Stephens-koblingen .
Reduktiv kobling er en koblingsreaksjon av arylhalogenider med en støkiometrisk ekvivalent av kobbermetall som forekommer i Ullmann-reaksjonen . I et eksempel på en dagens tverrkoblingsreaksjon som kalles dekarboksylativ kobling , fortrenger en katalytisk mengde Cu (I) en karboksylgruppe som danner arylkopper (ArCu) mellomproduktet. Samtidig omdanner en palladiumkatalysator et arylbromid til organopalladium-mellomproduktet (Ar'PdBr), og ved transmetallering dannes biarylen fra ArPdAr '.
Redoks-nøytral kobling er koblingen av terminale alkyner med halo-alkyner med et kobbersalt (I) i Cadiot-Chodkiewicz-koblingen . Termisk kobling av to organokopperforbindelser er også mulig.
Kullokrasjon
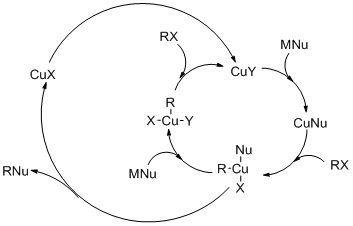
Carbocupration er en nukleofil tilsetning av organokopperreagenser (R-Cu) til acetylen eller terminale alkyner, noe som resulterer i en alkenyl-kobberforbindelse (RC = C-Cu). Det er et spesielt tilfelle av karbometalering og også kalt Normant-reaksjonen .
Figur: Katalytisk syklus for karbocupration for syntesen av Aldol, Baylis-Hillman Type Products
Syntetiske applikasjoner
- Den Chan-Lam kopling muliggjør dannelsen av aryl-karbon-bindinger hetoroatom. Det innebærer kobling av borsyrer , stannaner eller siloksaner med NH- eller OH-holdige substrater.
- Ullmann-reaksjon involverer kobbermedierte reaksjoner av arylhalogenider. To typer Ullmann-reaksjoner er gjenkjent:
- Klassisk kobberfremmet syntese av symmetriske biarylforbindelser)
- Kobberfremmet nukleofil aromatisk erstatning.
- Sonogashira koblingsreaksjon , som benytter både kobber og palladium, medfører kobling av aryl- og / eller vinylhalogenider med terminale alkyner.
Reduksjonsmidler
Kobberhydrider er spesialreagenser som av og til brukes som reduksjonsmiddel . Det mest kjente kobberhydridet kalles Stryker's reagens , en klyngeforbindelse med formelen [( PPh 3 ) CuH] 6 . Det reduserer alken α, β-umettede karbonylforbindelser .
Buchwald-reaksjonen er en kobberkatalysert asymmetrisk reduksjon av aktiverte alkener. Reagenset genereres in situ fra kobber (I) NHC- kompleks. Hydridekvivalenter tilveiebringes av en silan .
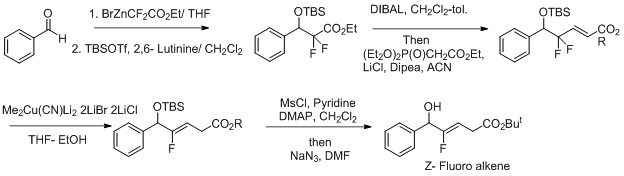
Syntese av Z-fluor-alken-dipeptidisosterer. Andre anstrengelser for å gjøre dette til en mer selektiv reaksjon inkluderer bruken av oksidasjonsreduksjonsbetingelser for reaksjonen. Fluor virker som en forlatende gruppe, og det forbedrer regioselektivitet i transformasjonen av Z-fluoralken.
Cu-alkyleringsreaksjon
Generelt foregår alkyleringsreaksjonen av organokopperreagenser via gamma-alkylering. Cis-gamma-angrep forekommer bedre i cykloheksylkarbamat på grunn av steriske stoffer. Reaksjonen er rapportert å være gunstig i eteriske løsningsmidler. Denne metoden viste seg å være meget effektiv for oksidativ kobling av aminer og alkyl, inkludert tertbutyl og arylhalogenider.
Vicinal funksjonaliseringsreaksjoner
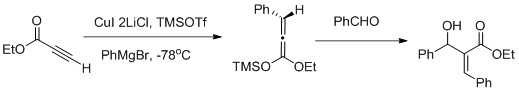
Vicinal funksjonalisering ved bruk av en Carbocupration-Mukaiyama aldol reaksjonssekvens
Muller og samarbeidspartnere rapporterte en vicinal funksjonalisering av α, β-acetylenestere ved bruk av en Carbocupration / Mukaiyama aldol reaksjons sekvens (som vist i fig ovenfor) karbocupration favoriserer dannelsen av Z-aldol.
Videre lesning
- Yao, B .; Liu, Y .; Zhao, L .; Wang, D .; Wang, M. (2014). "Designing a Cu (II) −ArCu (II) −ArCu (III) −Cu (I) Catalytic Cycle: Cu (II) -Catalysated Oxidative Arene C − H Bond Azidation with Air as an Oxidant under Ambient conditions". J. Org. Chem . 79 (22): 11139–11145. doi : 10.1021 / jo502115a . PMID 25350606 .
- Yamamoto, Y .; Yamammoto, S .; Yatagai, H .; Maruyama, K (1980). "Lewis-syreformidlede reaksjoner av organokopperreagens. Et bemerkelsesverdig forbedret regioselektivt gamma-angrep av allylhalider og direkte alkylering av allylalkoholer via RCu.BF 3 ". JACS . 102 (7): 2318–2325. doi : 10.1021 / ja00527a032 .





![Et Cu (III) mellomprodukt preget av NMR. [11]](https://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/CopperIII_intermediate_by_RI_NMR.png/300px-CopperIII_intermediate_by_RI_NMR.png)
![{\ displaystyle [{\ ce {R}} {-} {\ color {Blue} {\ ce {Cu}}} {\ ce {-R}}] ^ {-} {\ ce {Li +}} \ { \ xrightarrow {\ color {Red} {\ ce {R'-X}}}} \ \ left [{\ ce {R}} {-} {\ overset {{\ displaystyle \ color {Red} {\ ce { R}} '} \ på toppen |} {\ undersett {| \ på toppen {\ displaystyle \ color {Red} {\ ce {X}}}} {\ color {Blue} {\ ce {Cu}}}}} {\ ce {-R}} \ right] ^ {-} {\ ce {Li +}} {\ ce {-> R}} {-} {\ color {Blue} {\ ce {Cu}}} + {\ ce {R}} {-} {\ color {Red} {\ ce {R '}}} + {\ ce {Li}} {-} {\ color {Red} {\ ce {X}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d7db6776d965a97de00837677a94c6fd3d1df2a)