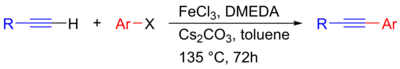Sonogashira kobling - Sonogashira coupling
| Sonogashira -kobling | |
|---|---|
| Oppkalt etter | Kenkichi Sonogashira |
| Reaksjonstype | Koblingsreaksjon |
| Identifikatorer | |
| Organisk kjemiportal | sonogashira-kobling |
| RSC ontologi ID | RXNO: 0000137 |
| Eksempler og relaterte reaksjoner | |
| Lignende reaksjoner | Kobberfri Sonogashira-kobling |
Den Sonogashira reaksjon er et kryss-koblingsreaksjon anvendes i organisk syntese for å danne karbon-karbon-bindinger . Den anvender en palladium -katalysator , så vel som kobber ko-katalysator for å danne en karbon-karbon-bindingen mellom en terminal alkyn , og en aryl eller vinyl halogenid .
| Sonogashira -reaksjonen |
|---|
- R 1 : aryl
- R 2 : aryl eller vinyl
- X: I, Br, Cl eller OTf
Sonogashira-krysskoblingsreaksjonen har blitt brukt på en lang rekke områder, på grunn av dens brukbarhet ved dannelse av karbon-karbonbindinger. Reaksjonen kan utføres under milde betingelser, for eksempel ved romtemperatur, i vandige medier og med en mild base, noe som har tillatt bruk av Sonogashira krysskoblingsreaksjon ved syntese av komplekse molekyler. Applikasjonene inkluderer legemidler, naturlige produkter, organiske materialer og nanomaterialer. Spesifikke eksempler inkluderer dets anvendelse i syntesen av tazarotene , som er en behandling for psoriasis og akne , og ved fremstilling av SIB-1508Y, også kjent som Altinicline , en nikotinisk reseptor- agonist .
Historie
Alkynyleringsreaksjonen av arylhalogenider ved bruk av aromatiske acetylener ble rapportert i 1975 i tre uavhengige bidrag fra Cassar, Dieck og Heck samt Sonogashira , Tohda og Hagihara. Alle reaksjonene anvender palladiumkatalysatorer for å gi de samme reaksjonsproduktene. Imidlertid utføres protokollene til Cassar og Heck utelukkende ved bruk av palladium og krever tøffe reaksjonsforhold (dvs. høye reaksjonstemperaturer). Bruken av kobber-kokatalysator i tillegg til palladiumkomplekser i Sonogashiras prosedyre gjorde det mulig å utføre reaksjonene under milde reaksjonsbetingelser med gode utbytter. En rask utvikling av Pd/Cu-systemene fulgte og muliggjorde utallige syntetiske applikasjoner, mens Cassar-Heck-forholdene var igjen, kanskje urettferdig, alt annet enn glemt. Reaksjonens bemerkelsesverdige nytte kan bevises av mengden forskning som fremdeles gjøres for å forstå og optimalisere dets syntetiske evner, samt benytte prosedyrene for å fremstille forskjellige forbindelser av syntetisk, medisinsk eller materiell/industriell betydning. Blant krysskoblingsreaksjonene følger det i antall publikasjoner rett etter Suzuki og Heck-reaksjonen, og et søk etter begrepet "Sonogashira" i Scifinder gir over 1500 referanser for tidsskriftpublikasjoner mellom 2007 og 2010.
Sonogashira -reaksjonen har blitt så kjent at alle reaksjoner som bruker moderne organometallisk katalysator for å koble alkynemotiver, kalles en variant av "Sonogashira -reaksjon" , til tross for at disse reaksjonene ikke utføres under sanne Sonogashira -reaksjonsbetingelser.
Mekanisme
Den reaksjonsmekanisme er ikke klart forstått, men de lærebok mekanismen dreier seg om en palladium-syklus som er i overensstemmelse med den "klassiske" krysskopling mekanisme, og en kobber syklus, som er mindre kjent.
Palladiumsyklusen
- Palladium prekatalysatoren arter aktiveres under reaksjonsbetingelser for å danne en reaktiv Pd- 0 -forbindelse, A . Den eksakte identiteten til den katalytiske arten avhenger sterkt av reaksjonsbetingelsene. Med enkle fosfiner, for eksempel PPh 3 (n = 2), og ved store fosfiner (dvs. P ( o -Tol)
3) det ble demonstrert at monoligerte arter (n = 1) dannes. Noen resultater peker videre på dannelsen av anioniske palladiumarter, [L 2 Pd 0 Cl] - , som kan være de virkelige katalysatorene i nærvær av anioner og halogenider. - Den aktive Pd- 0 katalysatoren er involvert i oksydativ addisjon takt med aryl eller vinyl halogenid substrat for å produsere Pd II arter B . I likhet med diskusjonen ovenfor avhenger strukturen av de anvendte ligandene. Dette trinnet antas å være det hastighetsbegrensende trinnet i reaksjonen.
- Kompleks B reagerer med kobberacetylid, kompleks F , i et transmetalleringstrinn , noe som gir kompleks C og regenererer kobberkatalysatoren.
- Strukturen til kompleks C avhenger av egenskapene til ligandene. For at den lette reduktive eliminasjonen skal skje, må substratmotivene være i nærheten, dvs. cis-orientering, så det kan være trans-cis isomerisering involvert. Ved reduktiv eliminering blir produktet tolan utvist fra komplekset og den aktive Pd -katalytiske art regenereres.
Kobbersyklusen
- Kobbersyklusen er ikke helt godt beskrevet. Det er foreslått at nærvær av en base, fører til dannelse av en π-alkyn-komplekset E . Dette øker surheten til terminalprotonen og fører til dannelse av kobberacetylid, kompleks F , ved deprotonering.
- Acetylid F blir deretter involvert i trans reaksjon med palladium mellomprodukt B .
Mekanismen til en kobberfri Sonogashira-variant
Selv om det er gunstig for reaksjonens effektivitet, er bruken av kobbersalter i "klassisk" Sonogashira -reaksjon ledsaget av flere ulemper, for eksempel påføring av miljøvennlige reagenser, dannelse av uønsket alkyne -homokobling ( Glaser -sideprodukter ) og nødvendigheten av streng oksygenekskludering i reaksjonsblandingen. Således, med sikte på å ekskludere kobber fra reaksjonen, ble det gjort store anstrengelser for utviklingen av Cu-fri Sonogashira-reaksjon. Langs utviklingen av nye reaksjonsbetingelser fokuserte mange eksperimentelle og beregningsstudier på belysning av reaksjonsmekanisme. Inntil nylig var den eksakte mekanismen som den cu-frie reaksjonen oppstår under debatt, med kritiske mekanistiske spørsmål som ikke er besvart. Det ble påvist i 2018 av Košmrlj et al. at reaksjonen fortsetter langs de to sammenkoblede Pd 0 /Pd II katalytiske syklusene.
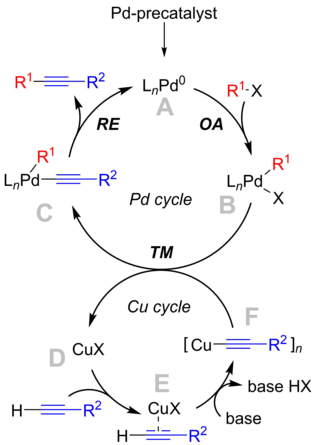
| Mekanisme for den Cu-frie Sonogashira-reaksjonen. |
|---|
- I likhet med den opprinnelige mekanisme, Pd 0 begynner syklusen med den oksidative tilsetning av arylhalogenidet eller triflatet med Pd- 0 -katalysator, som danner kompleks B og aktiverende arylhalogenid substrat for reaksjonen.
- Acetylen aktiveres i den andre, Pd II -medierte syklusen. Fenylacetylen ble vist å danne Pd monoacetylidkompleks D så vel som Pd bisacetylidkompleks F under milde reaksjonsbetingelser.
- Både aktiverte arter, nemlig komplekser B og F , er involvert i trans trinn, som danner kompleks C og regenererende D .
- De resulterende produktene av reduktiv eliminering , disubstituert alkyneprodukt så vel som regenererte Pd 0 katalytiske arter fullfører Pd 0 katalytiske syklus.
Det ble demonstrert at aminer er konkurransedyktige mot fosfinene og kan også delta som ligander L i de beskrevne reaksjonsartene. Avhengig av konkurransehastigheten mellom amin og fosfiner, forventes et dynamisk og komplekst samspill når man bruker forskjellige koordinative baser.
Reaksjonsbetingelser
Sonogashira -reaksjonen kjøres vanligvis under milde forhold. Krysskoblingen utføres ved romtemperatur med en base, typisk et amin, for eksempel dietylamin , som også fungerer som løsningsmiddel. Reaksjonsmediet må være grunnleggende for å nøytralisere hydrogenhalogenidet som produseres som biproduktet av denne koblingsreaksjonen, så alkylaminforbindelser som trietylamin og dietylamin brukes noen ganger som løsningsmidler , men også DMF eller eter kan brukes som løsningsmiddel. Andre baser som kaliumkarbonat eller cesiumkarbonat brukes av og til. I tillegg er formelt nødvendig avluftede forhold for Sonogashira -koblingsreaksjoner fordi palladium (0) kompleksene er ustabile i luften, og oksygen fremmer dannelsen av homokoblede acetylener. Nylig muliggjør utvikling av luftstabile organopalladiumkatalysatorer denne reaksjonen i den omgivende atmosfæren. I tillegg til det, utvikler RM Al-Zoubi og co-works vellykket metode med høy regioselektivitet for 1,2,3-trihaloareneresivater med gode til høye utbytter under omgivelsesforhold.
Katalysatorer
Vanligvis er to katalysatorer nødvendig for denne reaksjonen: et nullvalent palladiumkompleks og et kobber (I) halidsalt. Vanlige eksempler på palladiumkatalysatorer inkluderer de som inneholder fosfinligander som [Pd (PPh
3)
4] . En annen vanlig palladiumkilde er [ Pd (PPh
3)
2Cl
2] , men komplekser som inneholder bidentate fosfinligander , slik som [Pd ( dppe ) Cl
2] , [Pd ( dppp ) Cl
2] , og [Pd (dppf) Cl
2] har også blitt brukt. Ulempen med slike katalysatorer er behovet for høye belastninger av palladium (opptil 5 mol %), sammen med en større mengde kobberkatalysator. Pd II- komplekser er faktisk pre-katalysatorer siden de må reduseres til Pd (0) før katalyse kan begynne. Pd II -komplekser viser generelt større stabilitet enn Pd 0 -komplekser og kan lagres under normale laboratorieforhold i flere måneder. Pd II -katalysatorer reduseres til Pd 0 i reaksjonsblandingen med et amin , en fosfinligand eller en annen reaktant i blandingen som tillater reaksjonen å fortsette. For eksempel kan oksidasjon av trifenylfosfin til trifenylfosfinoksid føre til dannelse av Pd 0 in situ når [Pd (PPh)
3)
2Cl
2] brukes.
Kobber (I) salter, slik som CuI , reagerer med det terminale alkynet og produserer et kobber (I) acetylid, som fungerer som en aktivert art for koblingsreaksjonene. Cu (I) er en ko-katalysator i reaksjonen, og brukes til å øke reaksjonshastigheten.
Arylhalogenider og pseudohalider
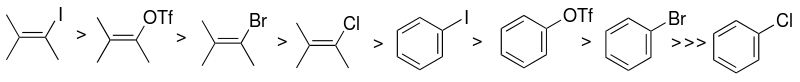
Valget av arylhalogenid eller pseudohalidsubstrat (sp 2 -karbon) er en av faktorene som hovedsakelig påvirker reaktiviteten til Sonogashira katalytiske system. Reaktiviteten til halogenider er høyere mot jod, og vinylhallider er mer reaktive enn analoge arylhalogenider.
Aryltriflater kan også brukes i stedet for arylhalogenider.
Arenediazonium -forløpere
Arenediazoniumsalter er blitt rapportert som et alternativ til arylhalogenider for Sonogashira -koblingsreaksjonen. Gull (I) klorid har blitt brukt som ko-katalysator kombinert med palladium (II) klorid i koblingen av arenediazoniumsalter med terminale alkyner, en prosess utført i nærvær av bis-2,6-diisopropylfenyldihydroimidazoliumklorid (IPr NHC) (5 mol%) for in situ å generere et NHC-palladiumkompleks og 2,6-di-tert-butyl-4-metylpyridin (DBMP) som base i acetonitril som løsningsmiddel ved romtemperatur. Denne koblingen kan utføres fra aniliner ved dannelse av diazoniumsaltet etterfulgt av in situ Sonogashira -kobling, hvor aniliner transformeres til diazoniumsalt og videre omdannes til alkyn ved kobling med fenylacetylen.
Alkyner
Ulike aromatiske alkyner kan anvendes for å gi ønskede disubstituerte produkter med tilfredsstillende utbytte. Alifatiske alkyner er generelt mindre reaktive.
Baser
På grunn av basens avgjørende rolle må spesifikke aminer tilsettes i overkant eller som løsningsmiddel for at reaksjonen skal fortsette. Det har blitt oppdaget at sekundære aminer som piperidin, morfolin eller diisopropylamin spesielt kan reagere effektivt og reversibelt med trans - RPdX (PPh
3)
2komplekser ved å erstatte en PPh
3ligand. Likevektskonstanten for denne reaksjonen er avhengig av R, X, en faktor for grunnleggende, og aminets steriske hindring. Resultatet er konkurranse mellom aminet og alkynegruppen for denne ligandutvekslingen, og derfor blir aminet generelt tilsatt i overkant for å fremme foretrukket substitusjon.
Reaksjonsvariasjoner
Kobberfri Sonogashira-kobling
Mens en kobberkatalysator tilsettes reaksjonen for å øke reaktiviteten, kan tilstedeværelsen av kobber resultere i dannelse av alkynedimerer. Dette fører til det som er kjent som Glaser -koblingsreaksjonen, som er en uønsket dannelse av homokoblingsprodukter av acetylenderivater ved oksidasjon . Som et resultat, når du kjører en Sonogashira-reaksjon med en kobber-katalysator, er det nødvendig å kjøre reaksjonen i en inert atmosfære for å unngå uønsket dimerisering. Kobberfrie variasjoner av Sonogashira-reaksjonen er utviklet for å unngå dannelse av homokoblingsproduktene. Det er andre tilfeller hvor bruk av kobber bør unngås, for eksempel koblingsreaksjoner som involverer substrater som potensielle kobberligander, for eksempel porfyriner med fri base .
Omvendt Sonogashira -kobling
I en invers Sonogashira -kobling er reaktantene en aryl- eller vinylforbindelse og et alkynylhalogenid.
Katalysatorvarianter
Sølvkatalyse
I noen tilfeller kan støkiometriske mengder sølvoksyd brukes i stedet for CuI for kobberfrie Sonogashira-koblinger.
Nikkel katalysatorer
Nylig har en nikkelkatalysert Sonogashira-kobling blitt utviklet som muliggjør kobling av ikke-aktiverte alkylhalogenider til acetylen uten bruk av palladium, selv om en kobberkatalysator fortsatt er nødvendig. Det har også blitt rapportert at gull kan anvendes som en heterogen katalysator, som ble demonstrert i koblingen av fenylacetylen og iodbenzen med et Au / administrerende direktør 2 -katalysator. I dette tilfellet skjer katalyse heterogent på Au -nanopartiklene, med Au (0) som det aktive stedet. Selektivitet til den ønskede krysskoblingsproduktet ble også funnet å bli forbedret ved å bærere slik som CEO 2 og La 2 O 3 . I tillegg har jernkatalyserte Sonogashira-koblinger blitt undersøkt som relativt billige og giftfrie alternativer til palladium. Her foreslås FeCl 3 å fungere som overgangsmetallkatalysator og Cs 2 CO 3 som basen, og dermed teoretisk gå gjennom en palladiumfri og kobberfri mekanisme.
| Palladiumfri Sonogashira-reaksjon katalysert av jern |
|---|
Selv om den kobberfrie mekanismen har vist seg å være levedyktig, har forsøk på å inkorporere de forskjellige overgangsmetallene nevnt ovenfor som rimeligere alternativer til palladiumkatalysatorer vist en dårlig resultatrekord på grunn av kontaminering av reagensene med spormengder palladium, noe som tyder på at disse teoretiserte veiene er ekstremt usannsynlige, om ikke umulige, å oppnå.
Studier viste at organiske og uorganiske utgangsmaterialer også kan inneholde nok ( ppb -nivå) palladium for koblingen.
Gull og Palladium co-katalyse
En svært effektiv gull- og palladium -kombinert metode for Sonogashira -koblingen av et bredt spekter av elektronisk og strukturelt forskjellige aryl- og heteroarylhalogenider er rapportert. Den ortogonale reaktiviteten til de to metallene viser høy selektivitet og ekstrem funksjonell gruppetoleranse i Sonogashira -kobling. En kort mekanistisk studie avslører at gull-acetylid-mellomproduktet går inn i palladiumkatalytisk syklus ved transmetaleringstrinnet.
Dendrimeriske palladiumkomplekser
Spørsmålene om gjenvinning av den ofte dyre katalysatoren etter produktdannelse utgjør en alvorlig ulempe for store anvendelser av homogen katalyse. Strukturer kjent som metallodendrimere kombinerer fordelene med homogene og heterogene katalysatorer, ettersom de er oppløselige og godt definert på molekylnivå, og likevel kan de gjenvinnes ved utfelling, ultrafiltrering eller ultrasentrifugering. Noen nylige eksempler kan bli funnet om bruk av dendritiske palladiumkompleks-katalysatorer for den kobberfrie Sonogashira-reaksjonen. Således har flere generasjoner bidentat fosfin palladium (II) polyamino dendritiske katalysatorer blitt anvendt solubilisert i trietylamin for kobling av aryljodider og bromider ved 25-120 ° C, og av arylklorider, men i meget lave utbytter. De dendrimeriske katalysatorene kan vanligvis gjenvinnes ved enkel nedbør og filtrering og gjenbrukes opptil fem ganger, med redusert aktivitet produsert ved nedbrytning av dendrimer og ikke ved palladiumutvaskning. Disse dendrimeriske katalysatorene viste en negativ dendritisk effekt; det vil si at katalysatoreffektiviteten reduseres når dendrimer -generasjonen øker. Den resirkulerbare polymere fosfinliganden vist nedenfor er hentet fra ringåpningsmetatese-polymerisering av et norbornenderivat, og har blitt brukt i den kobber-katalyserte Sonogashira-reaksjonen av metylpiodobenzoat og fenylacetylen ved bruk av Pd (dba)
2· CHCl
3som en palladiumkilde. Til tross for utvinning ved filtrering, reduserte polymer katalytisk aktivitet med omtrent 4-8% i hvert resirkuleringsforsøk.
Nitrogen ligander
Pyridiner og pyrimidiner har vist gode komplekseringsegenskaper for palladium og har blitt anvendt i dannelsen av katalysatorer egnet for Sonogashira -koblinger. Dipyrimidyl-palladiumkomplekset vist nedenfor har blitt anvendt i den kobberfrie koblingen av jod-, brom- og klorbenzen med fenylacetylen ved bruk av N-butylamin som base i THF-løsningsmiddel ved 65 ° C. Videre har alle strukturelle trekk ved dette komplekset vært preget av omfattende røntgenanalyse, som verifiserer den observerte reaktiviteten.
Mer nylig har dipyridylpalladiumkomplekset blitt oppnådd og blitt brukt i den kobberfrie Sonogashira-koblingsreaksjonen av aryljodider og bromider i N-metylpyrrolidinon (NMP) ved bruk av tetra-n-butylammoniumacetat (TBAA) som base ved romtemperatur. Dette komplekset har også blitt brukt til kobling av aryljodider og bromider i tilbakeløpende vann som løsningsmiddel og i nærvær av luft, ved bruk av pyrrolidin som base og TBAB som tilsetningsstoff, selv om dets effektivitet var høyere i N-metylpyrrolidinon (NMP) som løsningsmiddel.
N -heterocykliske karben (NHC) palladiumkomplekser
N -heterocykliske karbener (NHCs) har blitt en av de viktigste ligander ved overgangsmetallkatalyse. Suksessen til normale NHC-er tilskrives i stor grad deres overlegne σ-donerende evner sammenlignet med fosfiner, som er enda større hos unormale NHC-kolleger. Anvendt som ligander i palladiumkomplekser, bidro NHCs sterkt til stabilisering og aktivering av prekatalysatorer og har derfor funnet anvendelse på mange områder av organometallisk homogen katalyse, inkludert Sonogashira -koblinger.
| Et eksempel på palladium (II) avledet kompleks med normal NHC -ligand. | Effektiv i PEPPSI-katalysator for Cu-fri Sonogashira-reaksjon i vann. |
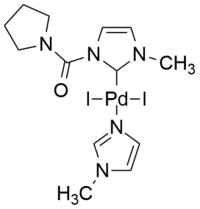
Interessante eksempler på unormale NHC er basert på den mesoioniske 1,2,3-triazol-5-ylidenstrukturen. En effektiv, kationisk palladiumkatalysator av PEPPSI- type, dvs. i PEPPSI ( i intern p yridine- e nhanced p recatalyst p reparation s tabilization and i nitiation) ble demonstrert for effektivt å katalysere den kobberfrie Sonogashira-reaksjonen i vann som det eneste løsningsmidlet, under aerobe forhold, i fravær av kobber, aminer, fosfiner og andre tilsetningsstoffer.
Søknader i syntese
Sonogashira -koblinger brukes i en lang rekke syntetiske reaksjoner, først og fremst på grunn av deres suksess med å legge til rette for følgende utfordrende transformasjoner:
Alkynyleringsreaksjoner
Koblingen av en terminal alkyn og en aromatisk ring er den sentrale reaksjonen når man snakker om anvendelser av den kobberfremmede eller kobberfrie Sonogashira-reaksjonen. Listen over tilfeller der den typiske Sonogashira -reaksjonen ved bruk av arylhalogenider har vært stor, og det er vanskelig å velge illustrerende eksempler. En nylig bruk av denne metoden er vist nedenfor for kobling av jodert fenylalanin med en terminal alkyn avledet fra d -biotin ved bruk av en in situ -generert Pd (0) art som katalysator, noe som tillot fremstilling av alkynelinket fenylalaninderivat for bioanalytiske applikasjoner. Det er også eksempler på at koblingspartnerne begge er festet til allylharpikser, med Pd (0) -katalysatoren som bevirker spaltning av substratene og påfølgende Sonogashira -kobling i løsning.
Naturlige produkter
Mange metabolitter som finnes i naturen inneholder alkyn- eller enyne -enheter, og derfor har Sonogashira -reaksjonen funnet hyppig nytte i syntesene. Flere av de nyeste og lovende anvendelsene av denne koblingsmetoden mot total syntese av naturlige produkter brukte utelukkende den typiske kobber-katalyserte reaksjonen.
Et eksempel på koblingen av et aryljodid til et arylacetylen kan sees i reaksjonen av den joderte alkoholen og tris (isopropyl) silylacetylen, som ga alkyn, et mellomprodukt i den totale syntesen av benzindenoazepinalkaloid bulgaramin.
Det finnes andre nylige eksempler på bruk av aryljodider for fremstilling av mellomprodukter under typiske Sonogashira betingelser, som etter ringslutning, utbytte naturlige produkter som benzylisoquinoline eller indol-alkaloider Et eksempel er syntesen av benzylisoquinoline alkaloider (+) - ( S ) -laudanosin og (-)-( S ) -xylopinin. Syntesen av disse naturlige produktene innebar bruk av Sonogashira krysskobling for å bygge karbonryggraden i hvert molekyl.
Enyner og enediynes
1,3-enyn-gruppen er en viktig strukturell enhet for biologisk aktive og naturlige forbindelser. Det kan stammer fra vinylsystemer og terminale acetylener ved å bruke en stereospesifikk prosedyre som opprettholder konfigurasjon, for eksempel Sonogashira-reaksjonen. Vinyljodider er de mest reaktive vinylhalogenidene til Pd 0 oksidativ tilsetning, og deres bruk er derfor hyppigst for Sonogashira krysskoblingsreaksjoner på grunn av de vanligvis mildere betingelsene som brukes. Noen eksempler inkluderer:
- Koblingen av 2-iod-prop-2-enol med et bredt spekter av acetylener.
- Fremstilling av en alk-2-ynylbuta-1,3-diener fra krysskoblingen av et diiodid og fenylacetylen, som vist nedenfor.
Legemidler
Allsidigheten til Sonogashira -reaksjonen gjør det til en mye brukt reaksjon ved syntese av en rekke forbindelser. En slik farmasøytisk anvendelse er syntesen av SIB-1508Y, som er mer kjent som Altinicline . Altiniklin er en nikotinisk acetylkolinreseptoragonist som har vist potensial i behandlingen av Parkinsons sykdom, Alzheimers sykdom, Tourettes syndrom, Schizofreni og oppmerksomhetsunderskudd hyperaktivitetsforstyrrelse (ADHD). Fra 2008 har Altinicline gjennomgått kliniske fase II -studier.
Sonogashira krysskoblingsreaksjonen kan brukes ved syntese av imidazopyridinderivater.

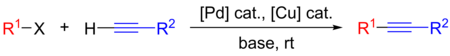
![Mekanisme for den Cu-frie Sonogashira-reaksjonen. [13] [14]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/642px-Cu-free-mechanism.png)