Kaliumheksakloroplatinat - Potassium hexachloroplatinate
|
|

|
|
| Identifikatorer | |
|---|---|
|
3D -modell ( JSmol )
|
|
| ECHA InfoCard |
100.037.239 |
|
PubChem CID
|
|
| RTECS -nummer | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
| Egenskaper | |
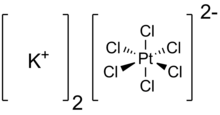
| K 2 PtCl 6 | |
| Molar masse | 485,99 g/mol |
| Utseende | oransje til gult fast stoff |
| Tetthet | 3,344 g / cm 3 |
| Smeltepunkt | 250 ° C (482 ° F; 523 K) (brytes ned) |
| 0,89 g / 100 ml H 2 O (ved 25 ° C) | |
|
Løselighetsprodukt ( K sp )
|
7,48 × 10 −6 |
| Farer | |
| Sikkerhetsdatablad | Oxford MSDS |
|
EU -klassifisering (DSD) (utdatert)
|
Giftig (T) |
| Flammepunkt | 250 ° C (482 ° F; 523 K) |
| Relaterte forbindelser | |
|
Andre anioner
|
Kaliumtetrakloroplatinat |
|
Med mindre annet er angitt, gis data for materialer i standardtilstand (ved 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Infobox -referanser | |
Kalium hexachloroplatinate er den uorganiske forbindelsen med formel K- 2 PtCl 6 . Det er et gult fast stoff som er et eksempel på et relativt uløselig kaliumsalt. Saltet inneholder heksakloroplatinat (IV) dianion, som har oktaedrisk koordinasjonsgeometri .
Utfellingen av denne forbindelsen fra oppløsninger av heksakloroplatinsyre ble tidligere brukt for bestemmelse av kalium ved gravimetrisk analyse . Det er også nyttig som et mellomprodukt i gjenvinning av platina fra avfall.
Reaksjoner
Ved hjelp av saltmetatesereaksjoner, er kalium hexachloroplatinate omdannes til en rekke forskjellige kvaternære ammonium- og beslektede lipofile salter. Disse omfatter tetrabutylammonium- salt (NBu 4 ) 2 PtCl 6 , kjent som Lukevics katalysator .
Reduksjon av kalium hexachloroplatinate med hydrazin -dihydroklorid gir den tilsvarende tetrachloroplatinate salt .
Referanser
- ^ Grinberg, AA; Sibirskaya, VV (1967). "Løselighet av heksammin- og heksahaloplatina (IV) -komplekser". Zhurnal Neorganicheskoi Khimii . 12 : 2069–2071.
- ^ John Rumble (18. juni 2018). CRC Handbook of Chemistry and Physics (99 utg.). CRC Press. s. 5–189. ISBN 1138561630.
- ^ GF Smith; JL Gring (1933). "Separasjon og bestemmelse av alkalimetallene ved bruk av perklorsyre. V. perklorsyre og klorplatinsyre ved bestemmelse av små mengder kalium i nærvær av store mengder natrium". J. Am. Chem. Soc. 55 (10): 3957–3961. doi : 10.1021/ja01337a007 .
- ^ George B. Kauffman, Larry A. Teter "Recovery of Platinum from Laboratory Residues" Uorganiske synteser, 1963, bind 7, s. 232-236. doi : 10.1002/9780470132388.ch61
- ^ Iovel, IG; Goldberg, YS; Shymanska, MV; Lukevics, E. (1987). "Kvaternære oniumheksakloroplatinater: nye hydrosilyleringskatalysatorer". Organometallics . 6 (7): 1410–1413. doi : 10.1021/om00150a007 .CS1 maint: bruker forfatterparameter ( lenke )
- ^ George B. Kauffman, Dwaine A. Cowan (1963). "Cis - og trans -Dichlorodiammineplatinum (II)". cis- og trans-diklorodiammin Platinum (II) . Uorganiske synteser. 7 . s. 239–245. doi : 10.1002/9780470132388.ch63 . ISBN 9780470132388.CS1 maint: bruker forfatterparameter ( lenke )
- ^ Keller, RN; Moeller, T. (1963). "Kaliumtetrachloroplatinate (II)". Inorg. Synth. 7 : 247–250. doi : 10.1002/9780470132333.ch79 .
