Pyruvat dehydrogenase - Pyruvate dehydrogenase
| pyruvat dehydrogenase (acetyl-overførende) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Krystallografisk struktur av pyruvatdehydrogenase (PDH). PH er en seks -domenedimer med α (blå), α '(gul), β (rød) og β' (teal) regioner angitt med de forskjellige fargene. Tiaminpyrofosfat (TPP) er vist i grå kule- og pinneform, to magnesiumioner i lilla som gjennomgår metallligering med TPP, og to kaliumioner i oransje.
| |||||||||
| Identifikatorer | |||||||||
| EF -nr. | 1.2.4.1 | ||||||||
| CAS -nr. | 9014-20-4 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz -visning | ||||||||
| BRENDA | BRENDA -oppføring | ||||||||
| ExPASy | NiceZyme utsikt | ||||||||
| KEGG | KEGG -oppføring | ||||||||
| MetaCyc | metabolsk vei | ||||||||
| PRIAM | profil | ||||||||
| PDB -strukturer | RCSB PDB PDBe PDBsum | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
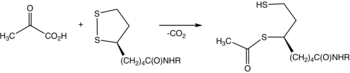
Pyruvat dehydrogenase er et enzym som katalyserer reaksjonen av pyruvat og et lipoamid for å gi acetylert dihydrolipoamid og karbondioksid . Omdannelsen krever koenzymet tiaminpyrofosfat .
Pyruvat -dehydrogenase opptrer vanligvis som en komponent, referert til som E1, i pyruvat -dehydrogenase -komplekset (PDC). PDC består av andre enzymer, referert til som E2 og E3. Til sammen transformerer E1-E3 pyruvat , NAD + , koenzym A til acetyl-CoA , CO 2 og NADH. Konverteringen er avgjørende fordi acetyl-CoA deretter kan brukes i sitronsyresyklusen for å utføre cellulær respirasjon . For å skille mellom dette enzymet og PDC, kalles det systematisk pyruvatdehydrogenase (acetyloverførende) .
Mekanisme
Tiaminpyrofosfatet (TPP) omdannes til et ylid ved deprotonering. Yliden angriper ketongruppen av pyruvat. Det resulterende addukt dekarboksylater . Den resulterende 1,3-dipol acetylerer reduktivt lipoamid-E2.
Når det gjelder detaljer, avslørte biokjemiske og strukturelle data for E1 en mekanisme for aktivering av TPP-koenzym ved å danne den konserverte hydrogenbindingen med glutamatrester (Glu59 i human E1) og ved å pålegge en V-konformasjon som bringer N4'-atomet til aminopyrimidinet til intramolekylær hydrogenbinding med tiazolium C2 -atomet. Denne unike kombinasjonen av kontakter og konformasjoner av TPP fører til dannelse av det reaktive C2-karbanionen, til slutt. Etter at kofaktoren TPP dekarboksylater pyruvat, blir acetyldelen et hydroksyetylderivat kovalent festet til TPP.
Struktur
E1 er et multimerisk protein. Mammalian E1s, inkludert human E1, er tetrameriske, sammensatt av to α- og to β- subenheter. Noen bakterielle E1-er, inkludert E1 fra Escherichia coli , består av to like underenheter, som hver er like stor som summen av molekylmasser av α- og β- underenheter.
.
Aktiv side
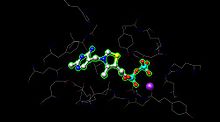
E1 har to katalytiske steder, som hver gir tiaminpyrofosfat ( TPP ) og magnesiumion som kofaktorer. Α- subenheten binder magnesiumion og pyrofosfatfragment mens β-subenheten binder pyrimidinfragment av TPP og danner sammen et katalytisk sete ved grensesnittet til underenheter.
Det aktive stedet for pyruvatdehydrogenase (bilde opprettet fra PDB : 1NI4 ) holder TPP gjennom metallligering til et magnesiumion (lilla kule) og gjennom hydrogenbinding til aminosyrer. Mens det finnes mer enn 20 aminosyrer på det aktive stedet, deltar aminosyrene Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 og His 263 faktisk i hydrogenbinding for å holde TPP og pyruvat (ikke vist her) på det aktive stedet. Aminosyrene er vist som ledninger, og TPP er i kule- og pinneform. Det aktive stedet hjelper også i overføringen av acylen på TPP til et lipoamid som venter på E2.
Regulering
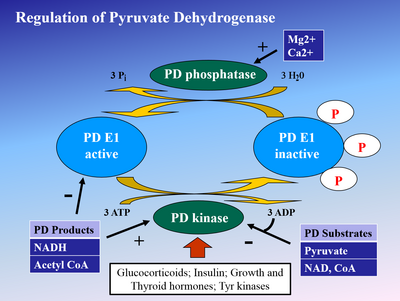
Fosforylering av E1 med pyruvat dehydrogenase kinase (PDK) inaktiverer E1 og deretter hele komplekset. PDK inhiberes av dikloreddiksyre og pyruvat , noe som resulterer i en høyere mengde aktivt, ufosforylert PDH. Fosforylering reverseres av pyruvat dehydrogenase fosfatase , som stimuleres av insulin , PEP og AMP , men inhiberes konkurransedyktig av ATP , NADH og Acetyl-CoA .
Patologi
Pyruvat dehydrogenase er målrettet mot et autoantigen kjent som anti-mitokondrielle antistoffer (AMA), noe som resulterer i progressiv ødeleggelse av de små gallegangene i leveren, noe som fører til primær biliær cirrhose . Disse antistoffene ser ut til å gjenkjenne oksidert protein som er forårsaket av inflammatoriske immunresponser. Noen av disse inflammatoriske responsene kan være relatert til glutenfølsomhet, ettersom over 50% av pasientene med akutt leversvikt i en studie viste et nonmitokondrielt autoantistoff mot vevstransglutaminase . Andre mitokondriale autoantigener inkluderer oksoglutaratdehydrogenase og forgrenet alfa-ketosyre dehydrogenase-kompleks , som er antigener som gjenkjennes av anti-mitokondriale antistoffer .
Pyruvat -dehydrogenase (PDH) -mangel er en medfødt degenerativ metabolsk sykdom som skyldes en mutasjon av pyruvat -dehydrogenasekomplekset (PDC) på X -kromosomet. Selv om feil er identifisert i alle 3 enzymer i komplekset, er E1-α-underenheten hovedsakelig synderen. Feil i sitronsyresyklusen på grunn av PDH -mangel fratar kroppen energi og fører til en unormal opphopning av laktat. PDH -mangel er en vanlig årsak til melkesyreacidose hos nyfødte og gir ofte sløvhet, dårlig fôring, takypné og dødsfall.
Eksempler
Menneskelige proteiner som har pyruvatdehydrogenaseaktivitet inkluderer:
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Relaterte enzymer
Hos bakterier eksisterer det en form for pyruvatdehydrogenase (også kalt pyruvatoksidase, EC 1.2.2.2) som knytter oksidasjonen av pyruvat til acetat og karbondioksid til reduksjonen av ferrocytokrom. I E. coli er dette enzymet kodet av kopper B -genet, og proteinet har en flavinkofaktor. Dette enzymet øker effektiviteten av veksten av E. coli under aerobe forhold.
Se også
Referanser
- Ochoa S (1954). "Enzymiske mekanismer i sitronsyresyklusen". Fremskritt innen enzymologi og beslektede områder innen molekylærbiologi . Fremskritt innen enzymologi og beslektede emner for biokjemi . Fremskritt innen ensymologi - og beslektede områder innen molekylærbiologi. 15 . s. 183–270. doi : 10.1002/9780470122600.ch5 . ISBN 9780470122600. PMID 13158180 .
- Scriba P, Holzer H (1961). "Gewinnung von alphaHydroxyathyl-2-tiaminpyrophosphat mit Pyruvatoxydase aus Schweineherzmuskel". Biochem. Z . 334 : 473–486.
- Perham RN (2000). "Svingende armer og svingende domener i multifunksjonelle enzymer: katalytiske maskiner for flertrinnsreaksjoner". Årlig gjennomgang av biokjemi . 69 (1): 961–1004. doi : 10.1146/annurev.biochem.69.1.961 . PMID 10966480 .
Eksterne linker
- Pyruvat+Dehydrogenase-E1 ved US National Library of Medicine Medical Subject Headings (MeSH)
- http://www.brookscole.com/chemistry_d/templates/student_resources/shared_resources/animations/pdc/pdc.html
- PDBe-KB gir en oversikt over all strukturinformasjon som er tilgjengelig i PDB for humanpyruvatdehydrogenase (lipoamid) alfa 1.
- PDBe-KB gir en oversikt over all strukturinformasjon som er tilgjengelig i PDB for human pyruvat dehydrogenase (lipoamid) beta.
|
ATP
ADP
ATP
ADP
+ +
2 × 3-fosfoglyserat 2 × 2-fosfoglyserat 2 × fosfoenolpyruvat ADP
ATP
2 × Pyruvat |