Roussins røde salt - Roussin's red salt

|
|
|
|
| Navn | |
|---|---|
|
IUPAC navn
kaliumtetranitrosyl-di-μ-sulfidodiiron ( Fe - Fe ) (2–)
|
|
| Andre navn
Ferrat (2-), tetranitrosyldi-mu-tioxodi-, (Fe-Fe), dikalium
|
|
| Identifikatorer | |
|
3D -modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| Fe 2 N 4 K 2 O 4 S 2 | |
| Molar masse | 374,04 g/mol |
| Utseende | Mørkerøde krystaller |
|
Med mindre annet er angitt, gis data for materialer i standardtilstand (ved 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Infobox -referanser | |
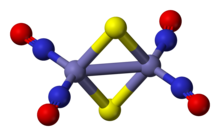
Roussin Red Salt er den uorganiske forbindelsen med formel K- 2 [Fe 2 S 2 (NO) 4 ]. Dette metallnitrosylet ble først beskrevet av Zacharie Roussin i 1858, noe som gjorde det til en av de første syntetiske jern-svovelklyngene .
Struktur og binding
Roussin røde saltanionet er en kant-delte bitetrahedron, karakterisert ved at et par Fe (NO) 2 enheter er shuntet med et par av sulfid ligander. Fe- NO- bindingene er lineære og indikerer at NO fungerer som en tre elektrondonor. Den diamagnetiske forbindelsen følger 18-elektron-regelen . Den mørkerøde fargen på komplekset tilskrives en rekke ladningsoverføringsinteraksjoner mellom jernkjernen og nitrosylligander.
Syntese
Den franske kjemikeren Z. Roussin tilberedte først dette saltet mens han undersøkte reaksjoner mellom nitroprussidion ([Fe (CN) 5 NO] 2− ) og svovel. Saltet kan fremstilles ved omsetning av sulfidsalter med jernnitrosylhalogenider:
- Fe 2 I 2 (NO) 4 + 2Li 2 S → Li 2 Fe 2 S 2 (NO) 4 + 2LiI
For å få "esterne" alkyleres saltet:
- Li 2 Fe 2 S 2 (NO) 4 + 2 RX → Fe 2 (SR) 2 (NO) 4 + 2 LiX
Estere kan også lett fremstilles fra reaksjonen av Fe 2 I 2 (NO) 4 med tiol .
Forekomst og potensielle applikasjoner
Det finnes i naturen som dets "estere" med formelen Fe 2 (SR) 2 (NO) 4 , hvor "R" er en hvilken som helst alkylgruppe [1]. I tillegg diskuteres Roussins røde salt innen mikrobiologi og matvitenskap på grunn av dets mutagene egenskaper.
Esterderivatet blir undersøkt som nitrogenoksidgivere innen biologi og medisin. På grunn av relativt lav toksisitet og god stabilitet Roussins røde salt. Fotolyse av forbindelsen induserer frigjøring av NO, og sensibiliserer derved målceller for eksponering for stråling [2].
Se også
Referanser
- ^ Butler, Anthony R. (juli 1982). "Kjemikeren Z. Roussin (1827-94)". Journal of Chemical Education . 59 (7): 549. Bibcode : 1982JChEd..59..549B . doi : 10.1021/ed059p549 .
- ^ Roussin, ML (1858). "Recherches sur les nitrosulfures doubles de fer (nouvelle classe de sels)" . Ann. Chim. Fys . 52 : 285–303.
- ^ Thomas, JT; Robertson, JH; Cox, EG (1. september 1958). "Krystallstrukturen til Roussins røde etylester". Acta Crystallographica . 11 (9): 599–604. doi : 10.1107/S0365110X58001602 .
- ^ Jaworska, Maria; Stasicka, Zofia (2005). "Struktur og UV-Vis-spektroskopi av jern-svovel-dinukleære nitrosylkompleksene [Fe 2 S 2 (NO) 4 ] 2− og [Fe 2 (SR) 2 (NO) 4 ]". New Journal of Chemistry . 29 (4): 604. doi : 10.1039/B409519G .
- ^ Butler, Anthony R. (juli 1982). "Kjemikeren Z. Roussin (1827-94)". Journal of Chemical Education . 59 (7): 549. Bibcode : 1982JChEd..59..549B . doi : 10.1021/ed059p549 .
- ^ Hans Reihlen, Adolf v. Friedolsheim (1927). "Über komplexe Stickoxydverbindungen und das sogenannte einwertige Eisen" . Justus Liebigs Annalen der Chemie . 457 : 71–82. doi : 10.1002/jlac.19274570103 .
- ^ TB Rauchfuss; TD Weatherill (1982). "Roussins røde salt revidert: reaktivitet av Fe2 (μ-E) 2 (NO) 42- (E = S, Se, Te) og relatert". Uorganisk kjemi . 21 (2): 827–830. doi : 10.1021/ic00132a071 .
- ^ Greenwood, NN; & Earnshaw, A. (1997). Elementets kjemi (2. utgave), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4 .
