Selektiv glukokortikoidreseptormodulator - Selective glucocorticoid receptor modulator
| Selektiv glukokortikoidreseptormodulator | |
|---|---|
| Narkotika klasse | |
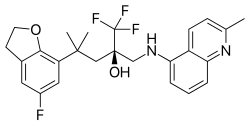
Kjemisk struktur av mapracorat , en av de lengst utviklede SEGRA -ene.
| |
| Klasse -identifikatorer | |
| Synonymer | SEGRM; SEGRA; SEGRAM; DIGRA |
| Bruk | Potensielt atopisk dermatitt , glaukom , grå stær , øyeinfeksjoner og andre |
| Biologisk mål | Glukokortikoidreseptor |
| Kjemisk klasse | Steroidal ; ikke -steroide |
| I Wikidata | |
Selektive glukokortikoidreseptormodulatorer ( SEGRM ) og selektive glukokortikoidreseptoragonister ( SEGRA ), tidligere kjent som dissosierte glukokortikoidreseptoragonister ( DIGRA ), er en klasse med eksperimentelle legemidler designet for å dele mange av de ønskelige antiinflammatoriske , immunsuppressive eller anticancer- egenskapene til klassiske glukokortikoide medisiner, men med færre bivirkninger som hudatrofi . Selv om prekliniske bevis på SEGRAMs antiinflammatoriske effekter kulminerer, er effekten av disse SEGRAMs for kreft i stor grad ukjent.
Selektive glukokortikoidreseptoragonister (SEGRA) er historisk og typisk steroide i struktur mens selektive glukokortikoidreseptormodulatorer (SEGRM) vanligvis er ikke -steroide . Den kombinerte forkortelsen for selektiv glukokortikoidreseptoragonist og -modulator er SEGRAM . En rekke slike ligander er utviklet og blir evaluert i preklinisk og klinisk testing.
SEGRAM oppnår sin selektivitet ved bare å utløse en delmengde av glukokortikoide reseptormekanismer .
Historie
Syntetiske steroider med SEGRA-lignende egenskaper ble allerede oppdaget på slutten av 1990-tallet. I løpet av 2000 -tallet ble mange potensielle SEGRAM syntetisert, de fleste av dem hadde ikke -steroide strukturer. I in vitro -studier på cellemodeller binder disse SEGRAM -molekylene seg til glukokortikoidreseptoren med en affinitet som ligner på deksametason , et sterkt glukokortikoid, og med en evne til å undertrykke produksjonen av inflammatoriske mediatorer som interleukin 6 og prostaglandin E2 . Videre kan en bestemt SEGRAM in vitro fremme apoptose ved prostatakreft og leukemi .
In vivo-studier på mus og rotter viste at en topisk administrert SEGRAM hemmet peroksidaseaktivitet og dannelse av ødem , begge indikatorer på antiinflammatorisk aktivitet, sammenlignbart med prednisolon . Systemisk administrering hos mus eller rotter indikerer at SEGRAM kan redusere akutte infeksjoner , revmatoid artritt , astma og kolitt . Det mangler bevis for in vivo om bestemte SEGRAM kan fremkalle lignende effekter enn klassisk glukokortikoid i kreftpatologier. Gjeldende prekliniske tester viser at SEGRAMs som er tilgjengelige så langt, ville fremkalle færre bivirkninger eller minst færre alvorlige bivirkninger enn klassiske glukokortikoider. For eksempel var hudatrofi hos rotter signifikant mindre uttalt enn under prednisolon i en studie som brukte SEGRAM Mapracorat , og metabolske effekter som vektøkning eller økning av blodsukker var praktisk talt ikke -eksisterende.
Virkningsmekanismen

Både ikke-selektive glukokortikoider og selektive glukokortikoidreseptoragonister virker ved å binde seg til og aktivere glukokortikoidreseptoren (GR). I motsetning til glukokortikoider, som aktiverer GR for å arbeide gjennom (minst) to signaltransduksjonsveier , aktiverer SEGRAMs GR på en slik måte at den bare opererer gjennom en av de to viktigste mulige veiene.
I fravær av glukokortikoider, befinner GR seg i cytosolen i en inaktiv tilstand sammensatt med varmesjokkproteiner (HSP) og immunofiliner . Binding av glukokortikoider til GR aktiverer reseptoren ved å forårsake en konformasjonsendring i GR og dermed en dissosiasjon av de bundne HSP -ene. Den aktiverte GR kan deretter regulere genuttrykk via en av to veier:
- Transaktivering
- Den første (direkte) banen kalles transaktivering, hvorved den aktiverte GR dimererer , translokeres til kjernen og binder seg til spesifikke DNA -sekvenser kalt glukokortikoidresponselementer (GRE). GR/DNA -komplekset rekrutterer andre proteiner som transkriberer nedstrøms DNA til mRNA og til slutt protein . Eksempler på glukokortikoid-responsive gener inkluderer de som koder for anneksin A1 , TSC22D3 (også kjent som GILZ), angiotensinkonverterende enzym , nøytralt endopeptidase og andre antiinflammatoriske proteiner.
- Transresjon
- Den andre (indirekte) banen kalles transrepresjon , der aktivert monomer GR binder seg til andre transkripsjonsfaktorer som NF-KB og AP-1 og forhindrer disse i å oppregulere uttrykket av målgenene. Disse målgenene koder for proteiner som cyklooksygenase , NO-syntase , fosfolipase A2 , tumornekrosefaktor , transformerende vekstfaktor beta , ICAM-1 og en rekke andre proinflammatoriske proteiner.
Derfor kommer de antiinflammatoriske effektene av glukokortikoider fra både transaktivering og transrepresjon. Derimot har studier på rotter og mus vist at de fleste bivirkningene av glukokortikoider, for eksempel diabetogen aktivitet, osteoporose , samt hudatrofi, hovedsakelig skyldes transaktivering. Et selektivt glukokortikoid som er i stand til å transpresse seg uten transaktivering, bør bevare mange av de ønskelige terapeutiske antiinflammatoriske effektene og minimere disse spesielle uønskede bivirkningene.
Innledende bevis på at transpresjon alene kan være tilstrekkelig for en antiinflammatorisk respons ble gitt ved å innføre en punktmutasjon i GR hos mus som forhindret GR i å dimere og binde seg til DNA og derved blokkere transaktivering. Samtidig forstyrret ikke denne mutasjonen transrepresjon. Selv om GR er avgjørende for overlevelse, er disse musene fortsatt levedyktige. Da disse musene ble behandlet med det syntetiske glukokortikoiddeksametason, var det imidlertid ingen forhøyelse av glukose. Disse deksametason-behandlede musene var resistente mot en inflammatorisk stimulans. Derfor reagerte disse musene på de antiinflammatoriske effektene av deksametason, men var resistente mot minst noen av bivirkningene.
På samme måte som glukokortikoider, binder SEGRAM til og aktiverer GR. I motsetning til glukokortikoider aktiverer SEGRAM imidlertid selektivt GR på en slik måte at de gir en forbedret terapeutisk fordel. Vanligvis, for spesifikke betennelsesbaserte sykdommer, bør SEGRAMs sterkere transrepresse enn transaktivere, eller enda bedre transrepresse og ikke transaktivere. Denne typen selektiv GR -aktivering bør resultere i færre bivirkninger enn de forventede bivirkningene som oppstår ved kronisk behandling med klassiske glukokortikoider.
Kliniske studier
Kliniske fase II-studier med en av kandidatforbindelsene, mapracorat (kodenavn BOL-303242-X og ZK 245186), startet sommeren 2009. Den ene var en dobbeltblind dosefunnstudie for en salve mot atopisk dermatitt utført av Intendis , en del fra Bayer HealthCare Pharmaceuticals spesialisert på dermatologi . En fase III -studie startet i november 2010, og evaluerte en oftalmisk suspensjon for behandling av betennelse etter grå stær kirurgi, utført av Bausch & Lomb .
En fase II-studie med et annet dissosiert glukokortikoid fosdagrocorat (PF-04171327) (en fosfatester- prodrug av dagrocorat (PF-00251802)) for revmatoid artritt ble startet i 2011 av Pfizer .
Resultatene av disse kliniske studiene er ennå ikke offentliggjort, og ingen SEGRAM er ennå godkjent for klinisk bruk.
Potensielle applikasjoner
Ved kroniske inflammatoriske sykdommer som atopisk dermatitt (hud), revmatoid artritt (ledd), ... er bivirkningene av kortikosteroider problematiske på grunn av den nødvendige langsiktige behandlingen. Derfor blir SEGRAMs undersøkt som en alternativ lokal behandling. Systemisk langtidsbehandling av betennelser med kortikosteroider kan særlig forårsake metabolske bivirkninger, noe som gjør utviklingen av orale SEGRAM til et interessant mål. Det gjenstår å se om selektive reseptoragonister eller modulatorer faktisk forårsaker signifikant færre bivirkninger enn klassiske kortikoider i kliniske applikasjoner.
Fordelaktige atrofiske effekter
Merk at de atrofiske effektene av glukokortikoider ikke alltid er en ulempe. Behandlingen av hyperproliferative sykdommer som psoriasis gjør bruk av denne egenskapen. SEGRAMs vil sannsynligvis være mindre effektive under slike forhold. Nylige fremskritt har vist at den tidligere streben mot en total separasjon av GR-transrepresjon og transaktivering ved bruk av SEGRAMs fortjener å bli nyansert ettersom de antiinflammatoriske genene stimulert av GR-transaktivering, som GILZ og DUSP1 , ser ut til å spille en viktig rolle. Likevel vil den mer selektive naturen til disse SEGRAMene fortsatt redusere antallet GR-medierte bivirkninger, og fortjener ytterligere klinisk testing.
Kjemi
Tidlige SEGRA -er var syntetiske steroider. Et eksempel er RU 24858, en av de første forbindelsene av denne typen som ble publisert. Mange nyere SEGRA har et annet rammeverk, selv om likheten med steroider fortsatt kan sees i molekyler som benzopyranokinolin A 276575 eller i oktahydrofenantren-2,7-diol-derivater. Alle disse forbindelsene har vist seg å ha SEGRA -egenskaper i mobil- eller dyremodeller.
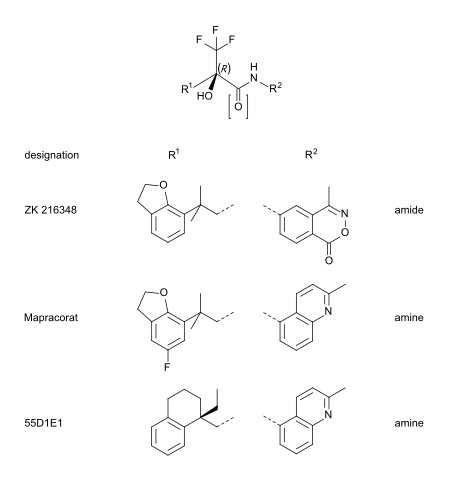
Mapracorat er en av en rekke trifluoropropanolaminer og -amider som er mindre åpenbart steroidlignende i strukturen. Andre typiske eksempler på denne gruppen er ZK 216348 og 55D1E1. Den voluminøse, bisykliske aromatiske substituenter (R 1 og R 2 ) står for den strukturelle likhet med corticoider. Den R konformasjon av det asymmetriske karbonatom ser ut til å være avgjørende for GR affinitet.
Liste over SEGRM
- Dagrocorat (PF-00251802, PF-251802)
- Fosdagrocorat (PF-04171327, PF-4171327)
- Mapracorat (BOL-303242-X, ZK-245186)
Se også
- Selektiv reseptormodulator
- Selektiv androgenreseptormodulator
- Selektiv østrogenreseptormodulator
- Selektiv progesteronreseptormodulator
Referanser