Pi-stabling (kjemi) - Pi-Stacking (chemistry)
I kjemi , pi stabling (også kalt π-π stabling ) refererer til attraktive, ikke-kovalente interaksjoner mellom aromatiske ringer, siden de inneholder n-bindinger . Disse interaksjonene er viktige i nukleobase- stabling i DNA- og RNA- molekyler, proteinfolding , malrettet syntese , materialvitenskap og molekylær gjenkjenning , selv om noen undersøkelser antyder at pi-stabling kanskje ikke kan brukes i noen av disse applikasjonene. Til tross for intens eksperimentell og teoretisk interesse, er det ingen enhetlig beskrivelse av faktorene som bidrar til interaksjoner med pi-stabling.
Bevis for pi-stabling
Den benzen -dimer er det prototypiske system for undersøkelse av pi stabling, og er eksperimentelt bundet av 8-12 kJ / mol (2-3 kcal / mol) i gassfasen med en separasjon av 4,96 Å mellom midtpunktene til massen for T-formet dimer. Den lille bindingsenergien gjør bensendimeren vanskelig å studere eksperimentelt, og selve dimeren er bare stabil ved lave temperaturer og er utsatt for klynger.
Andre bevis for pi-stabling kommer fra bestemmelse av røntgenkrystallstruktur . Vinkelrett og forskjøvet parallellkonfigurasjon kan observeres i krystallstrukturene til mange enkle aromatiske forbindelser. Lignende forskjøvede parallelle eller vinkelrette geometrier ble observert i en undersøkelse av høyoppløselige røntgenproteinkrystallstrukturer i Proteindatabanken . Analyse av de aromatiske aminosyrene fenylalanin, tyrosin, histidin og tryptofan indikerer at dimerer av disse sidekjedene har mange mulige stabiliserende interaksjoner på avstander større enn den gjennomsnittlige van der Waals-radien.
Geometriske konfigurasjoner
De foretrukne geometriene til benzen-dimeren har blitt modellert på et høyt teorinivå med MP2-R12 / A-beregninger og meget store motpunktskorrigerte aug-cc-PVTZ-basissett. De to mest stabile konformasjonene er parallellforskyvede og T-formede, som i det vesentlige er isoenergiske. I kontrast maksimerer sandwichkonfigurasjonen overlapping av pi-systemet, noe som destabiliserer interaksjonen. Sandwichkonfigurasjonen representerer et energisk sadelpunkt, som er i samsvar med den relative sjeldenheten til denne konfigurasjonen i røntgenkrystalldata.
De relative bindingsenergiene til disse tre geometriske konfigurasjonene av benzen-dimeren kan forklares med en balanse mellom kvadrupol / kvadrupol og London dispersjonskrefter . Mens benzen ikke har et dipolmoment, har det et sterkt kvadrupolmoment . Den lokale C-H-dipolen betyr at det er positiv ladning på atomene i ringen og en tilsvarende negativ ladning som representerer en elektronsky over og under ringen. Kvadrupolmomentet er reversert for heksafluorbenzen på grunn av fluorens elektronegativitet. Benzen-dimeren i sandwichkonfigurasjonen er stabilisert av London-dispersjonskrefter, men destabilisert av frastøtende kvadrupol / kvadrupol-interaksjoner. Ved å motregne en av benzenringene reduserer den parallelle forskjøvede konfigurasjonen disse frastøtende interaksjonene og stabiliseres. Den store polariserbarheten av aromatiske ringer fører til spredte interaksjoner som et viktig bidrag til stablingseffekter. Disse spiller en viktig rolle for interaksjoner av nukleobaser, for eksempel i DNA . Den T-formede konfigurasjonen har gunstige kvadrupol / kvadrupol-interaksjoner, ettersom den positive kvadrupolen til den ene benzenringen samhandler med den negative kvadrupolen til den andre. Benzenringene er lengst fra hverandre i denne konfigurasjonen, så de gunstige kvadrupol / kvadrupol-interaksjonene kompenserer åpenbart for reduserte dispersjonskrefter .
Substituerende effekter
Evnen til å finjustere interaksjoner med pi-stabling vil være nyttig i mange syntetiske anstrengelser. Et eksempel vil være å øke bindingsaffiniteten til en liten molekyl-inhibitor til en enzymlomme som inneholder aromatiske rester. Effektene av heteroatomer og substituenter på interaksjoner med pi-stabling er vanskelig å modellere og et spørsmål om debatt.
Elektrostatisk modell
En tidlig modell for rollen som substituenter i interaksjoner med pi-stabling ble foreslått av Hunter og Sanders. De brukte en enkel matematisk modell basert på sigma- og pi-atomladninger, relative orienteringer og van der Waals-interaksjoner for å kvalitativt bestemme at elektrostatikk er dominerende i substituenteffekter. I henhold til deres modell reduserer elektronuttrekkende grupper den negative kvadrupolen i den aromatiske ringen og favoriserer derved parallelle fordrevne og sandwichkonformasjoner. I motsetning til dette øker elektrondonasjonsgrupper den negative kvadrupolen, noe som kan øke interaksjonsstyrken i en T-formet konfigurasjon med riktig geometri. Basert på denne modellen foreslo forfatterne et sett med regler som styrer pi-stabling-interaksjoner som var frem til mer sofistikerte beregninger ble brukt.
Eksperimentelle bevis for Hunter – Sanders-modellen ble levert av Siegel et al. ved bruk av en serie substituerte syn- og anti-1,8-di- o- tolylnaftalener. I disse forbindelsene "arylgruppene" forsiden "i en stablet geometri på grunn av sterisk trengsel, og barrieren mot epimerisering ble målt ved kjernemagnetisk resonansspektroskopi . Forfatterne rapporterte at arylringer med elektronuttrekkende substituenter hadde høyere rotasjonsbarrierer. Tolkningen av dette resultatet var at disse gruppene reduserte elektrondensiteten til de aromatiske ringene, noe som tillot gunstigere interaksjoner med sandwich-pi-stabling og dermed en høyere barriere. Med andre ord resulterte de elektronuttrekkende gruppene i "mindre ugunstige" elektrostatiske interaksjoner i grunntilstanden.
Hunter et al. anvendt en mer sofistikert kjemisk dobbeltmutantsyklus med en hydrogenbundet "glidelås" til spørsmålet om substituenteffekter i pi-stablingsinteraksjoner. Denne teknikken har blitt brukt til å studere en rekke ikke-kovalente interaksjoner. Den enkle mutasjonen, i dette tilfellet å endre en substituent på en aromatisk ring, resulterer i sekundære effekter slik som en endring i hydrogenbindingsstyrken . Den doble mutasjonen kvantifiserer disse sekundære interaksjonene, slik at selv en svak interaksjon av interesse kan dissekeres fra matrisen. Resultatene deres indikerer at flere elektronuttakende substituenter har mindre frastøtende interaksjoner med pi-stabling. Tilsvarende var denne trenden nøyaktig invertert for interaksjoner med pentafluorfenylbenzen, som har et kvadrupolmoment som er lik i størrelse, men motsatt i tegnet som benzen. Resultatene gir direkte bevis for Hunter – Sanders-modellen. Stablingsinteraksjonene målt med dobbeltmutantmetoden var imidlertid overraskende små, og forfatterne bemerker at verdiene kanskje ikke kan overføres til andre systemer.
I en oppfølgingsstudie beskrev Hunter et al. verifisert til en første tilnærming at samhandlingsenergiene til de samvirkende aromatiske ringene i en dobbel mutantsyklus domineres av elektrostatiske effekter. Forfatterne bemerker imidlertid at direkte interaksjoner med ringsubstituentene, diskutert nedenfor, også gir viktige bidrag. Faktisk kan samspillet mellom disse to faktorene resultere i den kompliserte substituent- og geometryavhengige oppførselen til pi-stablingsinteraksjoner.
Direkte interaksjonsmodell
Hunter-Sanders-modellen har blitt kritisert av en rekke forskningsgrupper som tilbyr motstridende eksperimentelle og beregningsmessige bevis for interaksjoner med pi-stabling som ikke primært styres av elektrostatiske effekter.
Det tydeligste eksperimentelle beviset mot elektrostatisk substituenteffekt ble rapportert av Rashkin og Waters. De brukte meta- og parasubstituerte N-benzyl-2- (2-fluorfenyl) -pyridiniumbromider, som stabler i en parallell fortrengt konformasjon, som et modellsystem for interaksjoner med pi-stabling. I deres system forbyr en metylenlinker gunstige T-formede interaksjoner. Som i tidligere modeller, ble den relative styrken av pi-stabling-interaksjoner målt ved NMR som rotasjonshastigheten rundt biarylbindingen, ettersom pi-stabling-interaksjoner forstyrres i overgangstilstanden. Parasubstituerte ringer hadde små rotasjonsbarrierer som økte med stadig mer elektronuttrekkende grupper, i samsvar med tidligere funn. Imidlertid hadde metasubstituerte ringer mye større rotasjonsbarrierer til tross for at de hadde nesten identiske elektrontettheter i den aromatiske ringen. Forfatterne forklarer dette avviket som direkte interaksjon mellom kanten av hydrogenatomer i den ene ringen og de elektronegative substituentene på den andre ringen. Denne påstanden støttes av kjemiske forskyvningsdata for den aktuelle protonen.
Mye av de detaljerte analysene av de relative bidragene til faktorer i pi-stabling er blitt bekreftet av beregning. Sherill og Sinnokrot rapporterte et overraskende funn ved bruk av teori på høyt nivå om at alle substituerte benzen-dimerer har gunstigere bindingsinteraksjoner enn en benzen-dimer i sandwichkonfigurasjonen. Senere beregningsarbeid fra Sherill-gruppen avslørte at substituenteffektene for sandwichkonfigurasjonen er additiv, noe som peker på en sterk innflytelse av dispersjonskrefter og direkte interaksjoner mellom substituenter. Det ble bemerket at interaksjoner mellom substituerte benzener i den T-formede konfigurasjonen var mer komplekse. Til slutt argumenterer Sherill og Sinnokrot i sin gjennomgangsartikkel om at enhver fremtoning av en trend basert på elektrondonering eller uttak av substituenter kan forklares med bytte-frastøting og dispersjonsbetingelser.
Houk og Wheeler gir også overbevisende beregningsbevis for viktigheten av direkte interaksjon i pi-stabling. I analysen av substituerte benzen-dimerer i en sandwichkonformasjon, var de i stand til å rekapitulere funnene sine ved hjelp av en svært enkel modell der den substituerte benzen, Ph-X, ble erstattet av H – X. Bemerkelsesverdig resulterte denne råmodellen i den samme trenden i relative interaksjonsenergier, og korrelerte sterkt med verdiene beregnet for Ph – X. Dette funnet antyder at substituenteffekter i benzen-dimeren skyldes direkte interaksjon av substituenten med den aromatiske ringen, og at pi-systemet til den substituerte benzen ikke er involvert. Dette sistnevnte punktet blir utvidet nedenfor.
Oppsummert ser det ut til at de relative bidragene til elektrostatikk, spredning og direkte interaksjoner til substituenteffektene som sees i pi-stabling-interaksjoner, er svært avhengige av geometri og eksperimentell design. Mangelen på enighet i saken kan ganske enkelt gjenspeile kompleksiteten i saken.
Krav om aromatisitet
Den konvensjonelle forståelsen av pi-stabling innebærer quadrupole-interaksjoner mellom delokaliserte elektroner i p-orbitaler. Med andre ord, aromatisitet bør være nødvendig for at denne interaksjonen skal skje. Imidlertid har flere grupper gitt motsatt bevis, og setter spørsmålstegn ved om pi-stabling er et unikt fenomen, eller om det strekker seg til andre nøytrale molekyler med lukket skall.
I et eksperiment som ikke er forskjellig fra andre nevnt ovenfor, konstruerte Paliwal og medforfattere en molekylær torsjonsbalanse fra en arylester med to konformasjonstilstander. Den brettede tilstanden hadde en veldefinert pi-stablingsinteraksjon med en T-formet geometri, mens den utfoldede tilstanden ikke hadde noen aryl – aryl-interaksjoner. NMR-kjemiske forskyvninger av de to konformasjonene var forskjellige og kunne brukes til å bestemme forholdet mellom de to tilstandene, som ble tolket som et mål på intramolekylære krefter. Forfatterne rapporterer at en preferanse for brettet tilstand ikke er unik for arylestere. For eksempel favoriserte cykloheksylesteren brettet tilstand mer enn fenylesteren, og tert-butylesteren favoriserte brettet tilstand med en preferanse som er større enn den som er vist av enhver arylester. Dette antyder at aromatisitet ikke er et strengt krav for gunstig interaksjon med en aromatisk ring.
Andre bevis for ikke-aromatiske pi-stablingsinteraksjoner inkluderer kritiske studier i teoretisk kjemi, som forklarer de underliggende mekanismene for empiriske observasjoner. Grimme rapporterte at samhandlingsenergiene til mindre dimerer bestående av en eller to ringer er veldig like for både aromatiske og mettede forbindelser. Dette funnet er av særlig relevans for biologien, og antyder at bidrag fra pi-systemer til fenomener som stablede nukleobaser kan bli overvurdert. Imidlertid ble det vist at en økt stabiliserende interaksjon sees for store aromatiske dimerer. Som tidligere nevnt, er denne interaksjonsenergien avhengig av geometri. Faktisk er store aromatiske dimerer bare stabilisert i forhold til deres mettede kolleger i en sandwichgeometri, mens energiene deres er like i en T-formet interaksjon.
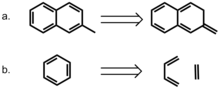
En mer direkte tilnærming til modellering av aromatisitetsrollen ble tatt av Bloom og Wheeler. Forfatterne sammenlignet interaksjonen mellom benzen og enten 2-metylnaftalen eller dens ikke-aromatiske isomer, 2-metylen-2,3-dihydronaftalen. Sistnevnte forbindelse gir et middel for å bevare antall p-elektroner mens det imidlertid fjerner effekten av delokalisering. Overraskende nok er samhandlingsenergiene med benzen høyere for den ikke-aromatiske forbindelsen, noe som tyder på at pi-bindingslokalisering er gunstig i interaksjoner med pi-stabling. Forfatterne vurderte også en homodesmotisk disseksjon av benzen i etylen og 1,3-butadien og sammenlignet disse interaksjonene i en sandwich med benzen. Beregningen deres indikerer at samhandlingsenergien mellom benzen og homodesmotisk benzen er høyere enn for en benzen-dimer i både sandwich- og parallellforskyvede konformasjoner, og igjen fremhever gunstigheten til lokaliserte pi-bindingsinteraksjoner. Disse resultatene antyder sterkt at aromatisitet ikke er nødvendig for interaksjoner med pi-stabling i denne modellen.
Selv i lys av disse bevisene konkluderer Grimme med at pi-stabling faktisk eksisterer. Han advarer imidlertid om at mindre ringer, spesielt de i T-formede konformasjoner, ikke oppfører seg vesentlig annerledes enn deres mettede kolleger, og at begrepet bør spesifiseres for større ringer i stablet konformasjon som ser ut til å utvise en samarbeidende pi-elektroneffekt.
applikasjoner
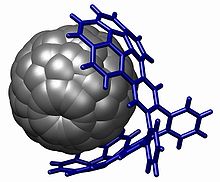
En kraftig demonstrasjon av stabling finnes i Buckycatcher . Denne molekylære pinsetten er basert på to konkave buckybowls med perfekt passform for ett konveks fullerenmolekyl . Kompleksering skjer ganske enkelt ved å fordampe en toluenoppløsning som inneholder begge forbindelsene. I løsning måles en assosiasjonskonstant på 8600 M −1 basert på endringer i NMR kjemiske skift .
Pi-stabling er utbredt i proteinkrystallstrukturer, og bidrar også til interaksjonen mellom små molekyler og proteiner. Som et resultat er pi – pi og kation – pi interaksjoner viktige faktorer i rasjonell legemiddelutforming. Et eksempel er den FDA-godkjente acetylkolinesterase (AChE) -hemmeren takrin som brukes til behandling av Alzheimers sykdom . Tacrine er foreslått å ha en pi-stabling interaksjon med den indoliske ringen til Trp84, og denne interaksjonen har blitt utnyttet i den rasjonelle utformingen av nye AChE-hemmere.
Tilsetning i farmakologiske aktive forbindelser
Flere varianter av pi-koordinert fenyler har også blitt testet ved hjelp av overgangsmetaller som for stabling η 6 -phenyltropanes , ved hjelp av cyklopentadienyl- og trikarbonyl på plass av en benzen. Som i tilfellet med trikarbonyl doblet forbindelsens affinitet for det tiltenkte ligandstedet (posisjonert på grunn av resulterende elektrostatisk påvirkning som er mer befordrende for målet).
I supramolekylær montering
π-systemer er viktige byggesteiner i supramolekylær montering på grunn av deres allsidige ikke-kovalente interaksjoner med forskjellige funksjonelle grupper. Et bemerkelsesverdig eksempel på anvendelse av π – π-interaksjoner i supramolekylær montering er syntesen av katenan . Den største utfordringen for syntesen av katenan er å sammenkoble molekyler på en kontrollert måte. Stoddart og medarbeidere utviklet en serie systemer som bruker de sterke π – π-interaksjonene mellom elektronrike benzenderivater og elektronfattige pyridiniumringer. [2] Catanene ble syntetisert ved å reagere bis (pyridinium) ( A ), bisparafenylen-34-krone-10 ( B ) og 1, 4-bis (brommetyl) benzen ( C ) (fig. 2). Interaksjonen π – π mellom A og B ledet dannelsen av et sammenlåst malmellomprodukt som ble ytterligere syklisert ved substitusjonsreaksjon med forbindelse C for å generere [2] katenanproduktet.
Se også
- Ikke-kovalent interaksjon
- Dispersjon (kjemi)
- Interaksjon mellom kation – pi
- Interkalering (biokjemi)
- Intercalation (kjemi)
Referanser
Eksterne linker
- Luo, R; Gilson, HS; Potter, MJ; Gilson, MK (2001). "Det fysiske grunnlaget for nukleinsyrebase stabling i vann" . Biophys J . 80 (1): 140–8. Bibcode : 2001BpJ .... 80..140L . doi : 10.1016 / S0006-3495 (01) 76001-8 . PMC 1301220 . PMID 11159389 .
- Larry Wolf (2011): π-π (π-Stacking) interaksjoner: opprinnelse og modulering