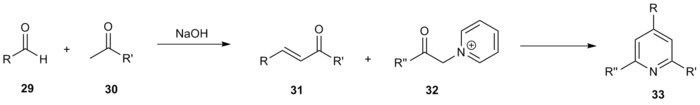Kröhnke pyridinsyntese - Kröhnke pyridine synthesis
| Kröhnke pyridinsyntese | |
|---|---|
| Oppkalt etter | Fritz Kröhnke |
| Reaksjonstype | Ringdannende reaksjon |
| identifikatorer | |
| RSC ontologi ID | RXNO: 0000420 |
Den Kröhnke pyridin syntese er reaksjonen i organisk syntese mellom α-pyridinium-metylketon salter og α, p-umettede karbonylforbindelser som brukes til å generere svært funksjonaliserte pyridiner . Pyridiner forekommer mye i naturlige og syntetiske produkter, så det er stor interesse for ruter for syntese av dem. Metoden er oppkalt etter Dr. Fritz Kröhnke.
innhold
Reaksjonsutvikling
Oppdagelse
I sitt arbeid ved University of Giessen , Kröhnke observert kondensasjon av α-pyridinium-metyl- keton salter 1 med a, p-umettet karbonylgruppe forbindelser 2 via en Michael-reaksjon ved behandling med ammoniumacetat til dannelse av 2,4,6-trisubstituerte pyridiner i høy gir under milde reaksjonsbetingelser. De foreslåtte mellomprodukter, 1, 5-dikarbonylforbindelse 3 , er ikke blitt isolert. Siden oppdagelsen har Kröhnke-syntesen hatt bred anvendbarhet for fremstilling av di-, tri- og tetrapyridinderivater, noe som viser en rekke fordeler i forhold til relaterte reaksjoner som Hantzsch pyridinsyntese .
Mekanisme
Mekanismen til Kröhnke pyridinsyntesen begynner med enolisering av a-pyridiniummetylketon 4 etterfulgt av 1,4-tilsetning til a, ß-umettet keton 5 for å danne Michael-addukt 6 , som umiddelbart tautomeriseres til 1,5-dikarbonyl 7 . Tilsetning av ammoniakk til 7 fulgt av dehydrering via 8 genererer imin- mellomproduktet 9. Imin-mellomproduktet deprotoneres deretter til enamin 10 og sykliseres med karbonylen for å generere mellomprodukt 11 . Den pyridinium kation fjernes deretter for å danne hydroksy-dienamine 12 . Aromatisering av 12 via påfølgende tap av vann genererer den ønskede pyridin heterocyklus 13 .
Reagenssyntese og reaksjonsbetingelser
Utgangsmaterialene for Kröhnke-syntesen er ofte trivielle å tilberede, og gir utlån til bekvemmeligheten og det brede omfanget av metoden. Fremstilling av a-pyridiniummetylketonsaltene kan lett oppnås ved behandling av det tilsvarende a-brommetylketon med pyridin. De a, ß-umettede ketonene er ofte tilgjengelige kommersielt eller kan fremstilles ved bruk av et antall kjente metoder. I tillegg kan Mannich-baser også brukes som Michael-aksepterer for ordningen, og ytterligere diversifisere omfanget av utgangsmaterialer som kan innarbeides i Kröhnke-ordningen.
Reaksjonsbetingelsene for Kröhnke-syntesen er generelt lett, og reaksjonene fortsetter ofte i høye utbytter med reaksjonstemperaturer som vanligvis ikke overstiger 140 ° C. Kröhnke-syntesen blir vanligvis utført i enten iseddik eller metanol, men den kan også gjøres under vandige forhold, og nyere under løsningsmiddelfrie forhold.
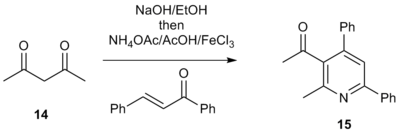
1,3-dikarbonylforbindelser har også vist seg å være levedyktige startmaterialer i stedet for a-pyridiniummetylketon-saltene. For eksempel gir behandling av 1,3-diketon 14 med base i etanol etterfulgt av ammoniumacetat, eddiksyre, den tilsvarende enonen og en Lewis-syre 3-acyltriarylpyridiner av form 15 . Disse acylpyridinene er attraktive mellomprodukter fordi de har et elektrofilt håndtak som gjør det mulig å innlemme ytterligere funksjonalitet i molekylet. Dette muliggjør enkel konstruksjon av komplekse polyaryl-systemer, en attraktiv metode for bibliotekssyntese av medikamentelle mål som inneholder funksjonaliserte pyridindeler.
Fordeler fremfor andre metoder
Kröhnke-syntesen for fremstilling av pyridiner har en rekke kortfattede fordeler i forhold til andre metoder. I motsetning til Hantzsch-syntesen, krever ikke Kröhnke-metoden oksidasjon for å generere det ønskede produktet, siden a-pyridiniummetylketonen allerede har riktig oksidasjonstilstand.
En annen fordel med den Kröhnke syntese er dens høye atom økonomi . For eksempel krever Chichibabin-syntesen 2 ekvivalenter umettet startmateriale. I tillegg er biproduktene fra Kröhnke-syntesen vann og pyridin, noe som gjør det mulig å opparbeide og rense protokoller. I motsetning til sammenlignbare metoder for pyridinsyntese, har Kröhkne-syntesen fordel av å være en høyytende pottesyntese, som til slutt muliggjør forkortelse av syntetiske veier og forenkler kombinasjonsbibliotekskatalogiseringen ytterligere.
Omfang og begrensninger
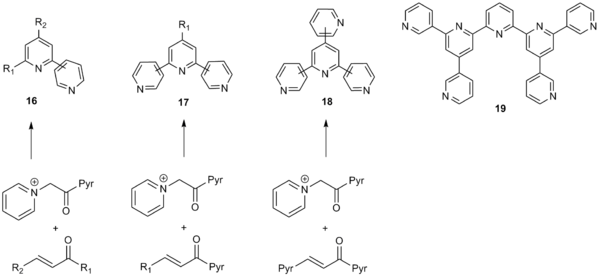
Det brede omfanget av Kröhnke pyridinsyntese har gjort den spesielt nyttig for syntese av poly arylsystemer inkludert pyridyl-, tienyl- og furanyl- grupper. Metoden tåler et bredt utvalg av arylsubstituenter på både a-pyridiniummetylketonfragmentet og a, ß-umettede karbonylforbindelser, og kan således brukes til å generere en bred katalog av poly-arylsystemer. I tillegg tolereres elektronuttrekkende grupper og elektrongivende grupper på de innkommende arylsubstituenter. Kröhnke-syntesen kan også benytte alkyl- og vinylsubstituenter som gir moderert til godt utbytte også. På grunn av det brede omfanget har Kröhnke-metoden sett vidt anvendelig for syntese av bipyridiner ( 16 ), terpyridiner ( 17 ), quaterpyridiner ( 18 ) og til og med opp til septipyridiner ( 19 ) som vist nedenfor.
Variasjoner og kombinatoriske studier
Kröhnke-metoden er omtalt i en løsningsmiddelfri syntese av triarylpyridiner som foregår via en homokobling av to diarylsubstituerte a, ß-umettede karbonylforbindelser. Denne strategien tilbyr et lett middel for fremstilling av pyridnyl-arylsystemer som er viktige fragmenter av mange nyttige medisinske stillaser.
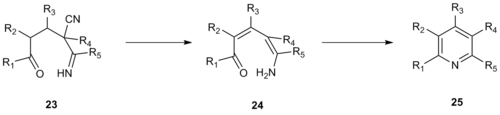
I 1992 utviklet Robinson og medarbeidere en lignende pyridinsyntese ved bruk av enamino- nitriler som et av de tre-karbonfragmentene i stedet for et a-pyridiniummetylketon. Denne forbedring øker reaktiviteten til systemet og tillater dannelse av fullstendig substituerte pyridiner, mens bruk av a-pyridiniummetylketon krever at 3- eller 5--stillingen på det resulterende pyridin er usubstituert. Kröhnke-kondensering av enamino nitril 20 med enon 21 ga smeltet pyridin 22 .
Mekanismen for denne reaksjonen av Kröhnke-type forløper sannsynligvis via et vinylogøst cyanamid 23 som gjennomgår eliminering av hydrocyansyre , deprotonering for å danne enamin 24 og syklisering for å danne mellomprodukt 25 , som deretter dehydratiseres for å danne det ønskede pyridinprodukt.
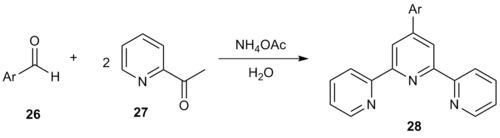
En ren Kröhnke-metode med én potte i vandige medier genererer 4'-aryl-2,2 ': 6', 2 '' - terpyridiner. Reaksjon av arylaldehyd 26 med to ekvivalenter 2-acetylpyridin ( 27 ) ga terpyridiner med form 28 .
I tillegg til variasjoner på den opprinnelige metoden, har en rekke kombinatoriske studier med Kröhnke-syntesen og dens variasjoner blitt brukt for å syntetisere store biblioteker med sterkt funksjonaliserte pyridiner. Janda og medarbeidere benyttet den generelle Kröhnke-reaksjonsordningen for å generere et 220 sammensatt bibliotek. Forskjellige metylketoner 29 og aldehyder 30 ble koplet via aldolkondensasjon å gi enones av formen 31 . Disse forbindelsene ble deretter omsatt med forskjellige a-pyridiniummetylketoner 32 for å gi det ønskede tresubstituerte pyridin 33 .
I 2009 utviklet Tu og kolleger en 3-fragment, en-pott kombinatorisk strategi for å utvikle 3-cyanoterpyridiner 34 og 1-amino-2-acylterpyridiner 35 . Disse kombinatoriske variasjonene av Kröhnke-reaksjonen gir en effektiv syntetisk strategi for poly arylpyridin-stillaser. Denne metodikken vil også være fordelaktig for biologiske analyser og screeningseksperimenter.
Syntetiske applikasjoner på ligander og biologisk aktive molekyler
Kröhnke-metodikken er også blitt anvendt for å generere en rekke interessante metallbindende ligander siden polypyridylkomplekser som bipyridin (bipy) er blitt brukt mye som ligander. Kröhnke-syntesen ble brukt til å fremstille en familie av tetrahydrokinolinbaserte N, S-type ligander. 2-tiofenyllacetofenon ( 36 ) ble omsatt med jodgass og pyridin i kvantitativt utbytte for å generere acylmetylpyridiniumjodid 37 . Reaksjon med en chiral syklisk a, ß-umettet keton avledet fra 2 - (+) - caren ga den ønskede N, S-type ligand 38 .
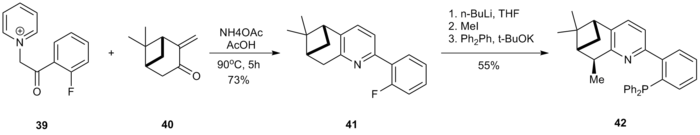
Nye, chirale P, N-ligander er blitt fremstilt ved bruk av Kröhnke-metoden. a-pyridiniumacylketonsalt 39 ble syklisert med pinocarvonderivat 40 for å generere pyridin 41 . Den benzyliske posisjonen på 41 ble metylert og etterfølgende SnAr-reaksjon med kaliumdifenylfosfid for å generere ligand 42 .
Kröhnke-reaksjonen har også hatt anvendeligheten til syntesen av en rekke biologisk aktive forbindelser i tillegg til de som er katalogisert i kombinatoriske studier. Kelly og kolleger utviklet en rute til cyclo-2,2 ′: 4 ′, 4 ′ ′: 2 ′ ′, 2 ′ ′ ′: 4 ′ ′ ′, 4 ′ ′ ′ ′: 2 ′ ′ ′ ′, 2 ′ ′ ′ ′ ′: 4 ′ ′ ′ ′ ′, 4-sexipyridin ved å bruke Kröhnke-reaksjonene som det viktigste makrosykliseringstrinnet . Polypyridinkompleks 43 ble behandlet med N-Bromosuccinimid i vått tetrahydrofuran etterfulgt av pyridin for å generere acylmetylpyridiniumsalt 44 som deretter kan gjennomgå makrosykliseringen under standardbetingelser for å gi det ønskede produkt 45 . Kröhnke-metoden i denne syntesen var avgjørende på grunn av svikt i andre sykliseringsteknikker som Glaser-koblingen eller Ullmann-koblingen .
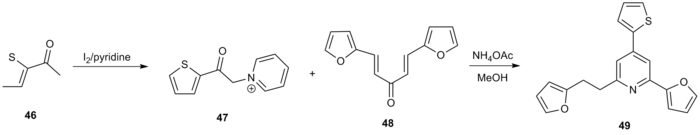
En annen bruk av Kröhnke pyridinsyntese var generering av et antall 2,4,6-trisubstituerte pyridiner som ble undersøkt som potensielle topoisomerase 1-hemmere. 2-acetyltiofen ( 46 ) ble behandlet med jod og pyridin for å generere a-pyridiniumacylketon 47 . Reaksjon med Michael acceptor 48 under standardbetingelser ga funksjonalisert pyridin 49 i 60% totalutbytte.
Til syvende og sist tilbyr Kröhnke pyridinsyntese en lett og grei tilnærming til syntesen av en bred bredde av funksjonaliserte pyridiner og poly aryl-systemer. Kröhnke-metodikken er brukt på en rekke strategier mot interessante ligander og biologisk relevante molekyler. I tillegg gir Kröhnke-reaksjonen og dens variasjoner en rekke fordeler enn alternative metoder til pyridinsyntese, alt fra en-pott, organisk løsemiddelfri variasjon til høy atomøkonomi.
Se også
- Hantzsch pyridinsyntese
- Gattermann – Skita syntese
- Chichibabin pyridinsyntese
- Omorganisering av kiamician-Dennstedt
- Bönnemann syklisering
referanser
- ^ Zecher, W .; Kröhnke, F. Ber. 1961, 94, 690-697.
- ^ Kröhnke, F.; Zecher, W. Angewandte Chemie International Edition på engelsk 1962, bind 1, side 626–632. doi : 10.1002 / anie.196206261
- ^ Potts, KT; Cipullo, MJ; Ralli, P .; Theodoridis, GJ Am. Chem. Soc. 1981, 103, 3584-3586.
- ^ Kelly, TR; Lee, YJ; Mears, RJJ Org. Chem. 1997, 62, 2774-2781
- ^ Kröhnke, F.; Zecher, W .; Angew. Chem. 1963, 75, 189
- ^ Kröhnke, F. Syntese. 1976, 1, 1-24
- ^ Rehberg, RW; Kröhnke, F. Justus Liebigs Ann. Chem.1968, 91, 717
- ^ Hantzsch, A. (1881). "Kondensasjonsprodukter fra Aldehydammoniak und Ketonartigen Verbindungen". Chemische Berichte 14 (2): 1637
- ^ Chichibabin, AEJ prakt. Chem. 1924, 107, 122
- ^ Kürti László, Barbara Czakó. Strategiske anvendelser av navngitte reaksjoner i organisk syntese. Elsevier Inc .: Burlington, Massachusetts.
- ^ Kröhnke, F.; Kröck, FW; Chem Ber. 1971, 104, 1645
- ^ Adib, M.; Tahermansouri, H .; Koloogani, SA; Mohammadi, B .; Bijanzadej, HR Tetrahedron Lett.2006, 47, 5957-5960
- ^ Robinson et. al. J. Org. Chem. 1992, 57, 7352
- ^ Tu, S.; Jia, R.; Jiang, B .; Zhang, J .; Zhang, Y .; Yao, C.; Ji, S. Tetrahedron, 2007, 63, 381-388
- ^ Janda, KD; Wirsching, P .; Fujimori, TJ Comb. Chem.2003, 5, 625-631
- ^ Tu, S.; Jiang, B .; Hao, W .; Wang, X .; Shi, FJ Comb. Chem. 2009, 11, 846-850
- ^ Chelucci, G. et al. J. Mol. Catal. A: Chemical, 2003, 191, 1-8
- ^ Andrei V. Malkov, Marco Bella, Irena G. Stara, P. Kocovsky "Modulær pyridin-type P, N-ligander avledet fra monoterpener: anvendelse i asymmetrisk Heck-tillegg" Tetrahedron Lett. 2001, 42, 3045-3048. doi : 10.1016 / S0040-4039 (01) 00369-0
- ^ Kelly, TJ Org. Chem. 1997, 62, 2774-2781
- ^ Lee, E.-S. Med. Chem. Lett. 2004, 14, 1333-1337