Okazaki -fragmenter - Okazaki fragments
Okazaki -fragmenter er korte sekvenser av DNA -nukleotider (ca. 150 til 200 basepar lange i eukaryoter ) som syntetiseres diskontinuerlig og senere kobles sammen av enzymet DNA -ligase for å skape den hengerende strengen under DNA -replikasjon . De ble oppdaget på 1960 -tallet av de japanske molekylærbiologene Reiji og Tsuneko Okazaki , sammen med hjelp fra noen av deres kolleger.
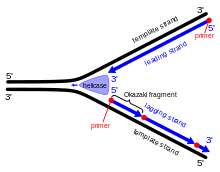
Under DNA -replikasjon vikles den dobbelte helixen ut, og de komplementære trådene skilles av enzymet DNA -helikase , og danner det som kalles DNA -replikasjonsgaffelen . Etter denne gaffelen begynner DNA -primase og DNA -polymerase å virke for å skape en ny komplementær streng. Fordi disse enzymene bare kan fungere i 5 'til 3' -retningen, replikeres de to uviklede malstrengene på forskjellige måter. En streng, den ledende strengen , gjennomgår en kontinuerlig replikasjonsprosess siden malstrengen har 3 'til 5' retning, slik at polymerasen som samler den ledende tråden, kan følge replikasjonsgaffelen uten avbrudd. Den forsinkende strengen kan imidlertid ikke opprettes kontinuerlig fordi malstrengen har 5 'til 3' retning, noe som betyr at polymerasen må arbeide bakover fra replikasjonsgaffelen. Dette forårsaker periodiske brudd i prosessen med å lage den hengerende strengen. Primasen og polymerasen beveger seg i motsatt retning av gaffelen, så enzymene må gjentatte ganger stoppe og starte på nytt mens DNA -helikasen bryter trådene fra hverandre. Når fragmentene er laget, kobler DNA -ligase dem til en enkelt, kontinuerlig streng. Hele replikasjonsprosessen regnes som "semi-diskontinuerlig" siden en av de nye strengene dannes kontinuerlig og den andre ikke.
I løpet av 1960 -årene utførte Reiji og Tsuneko Okazaki eksperimenter som involverte DNA -replikasjon i bakterien Escherichia coli . Før denne tiden ble det ofte antatt at replikasjon var en kontinuerlig prosess for begge tråder, men funnene som involverte E. coli førte til en ny modell for replikasjon. Forskerne fant at det var en diskontinuerlig replikasjonsprosess ved å puls-merke DNA og observere endringer som pekte på ikke-sammenhengende replikasjon.
Eksperimenter
Arbeidet til Kiwako Sakabe, Reiji Okazaki og Tsuneko Okazaki ga eksperimentelle bevis som støtter hypotesen om at DNA -replikasjon er en diskontinuerlig prosess. Tidligere var det allment akseptert at replikasjonen var kontinuerlig i både 3 'til 5' og 5 'til 3' retninger. 3 'og 5' er spesifikt nummererte karbonatomer på deoksyribosering i nukleinsyrer, og refererer til orienteringen eller retningen av en streng. I 1967 antydet Tsuneko Okazaki og Toru Ogawa at det ikke finnes noen mekanisme som viser kontinuerlig replikasjon i 3 'til 5' retning, bare 5 'til 3' ved bruk av DNA -polymerase , et replikasjonsenzym. Teamet antok at hvis diskontinuerlig replikasjon ble brukt, kunne korte DNA -strenger , syntetisert ved replikeringspunktet, festes i 5 'til 3' retning til den eldre strengen.
For å skille replikasjonsmetoden som ble brukt av DNA eksperimentelt , denaturerte teamet pulsmerkede nylig replikerte områder av Escherichia coli- kromosomer, og ekstraherte DNA. Et stort antall radioaktive korte enheter betydde at replikasjonsmetoden sannsynligvis var diskontinuerlig. Hypotesen ble ytterligere understøttet av oppdagelsen av polynukleotid -ligase , et enzym som linker kort DNA-trådene sammen.
I 1968 samlet Reiji og Tsuneko Okazaki ytterligere bevis på gryende DNA -tråder. De antok at hvis diskontinuerlig replikasjon, som involverer korte DNA -kjeder som er knyttet sammen av polynukleotidligase, er mekanismen som brukes i DNA -syntese, vil "nylig syntetiserte korte DNA -kjeder akkumuleres i cellen under forhold der funksjonen til ligase er midlertidig svekket." E. coli ble infisert med bakteriofag T4 som produserer temperaturfølsom polynukleotidligase. Cellene infisert med T4 -fagene akkumulerte et stort antall korte, nysyntetiserte DNA -kjeder, som forutsagt i hypotesen, når de ble utsatt for høye temperaturer. Dette eksperimentet støttet videre Okazakis 'hypotese om diskontinuerlig replikasjon og kobling av polynukleotidligase. Det motbeviste oppfatningen om at det også ble produsert korte kjeder under ekstraksjonsprosessen.
Okazakis -eksperimentene ga omfattende informasjon om replikasjonsprosessen av DNA og eksistensen av korte, nysyntetiserte DNA -kjeder som senere ble kjent som Okazaki -fragmenter.
Stier
To veier er blitt foreslått for å behandle Okazaki -fragmenter: den korte klaffbanen og den lange klaffbanen.
Kort klaffebane
I den korte klaffbanen i eukaryoter blir den forsinkende DNA -strengen grunnet i korte intervaller. Bare i den korte banen er nukleasen FEN1 involvert. Pol δ møter ofte det nedstrøms primede Okazaki -fragmentet og forskyver RNA/DNA -initiator -primeren til en 5 'klaff. FEN1 5'-3'-endonukleasen gjenkjenner at 5'-klaffen forskyves, og den kløyver og danner et substrat for ligering. I denne metoden fjernes Pol a-syntetisert primer. Studier viser at i FEN1 foreslår en 'sporing; modell der nukleasen beveger seg fra 5' -klaffen til basen for å preforme spaltning. Pol δ behandler ikke en nukleaseaktivitet for å spalte den fortrengte klaffen. FEN1 kløver den korte klaffen umiddelbart etter at de dannes. Spaltningen inhiberes når 5'-enden av DNA-klaffen er blokkert enten med en komplementær primer eller en biotinkonjugert streptavidindel. DNA -ligase forsegler nicket laget av FEN1, og det skaper en funksjonell kontinuerlig dobbel streng av DNA. PCNA simulerer enzymatiske funksjoner til proteiner for både FEN1 og DNA ligase. Interaksjonen er avgjørende for å skape riktig ligering av den henger DNA -strengen. Sekvensiell strengforskyvning og spaltning av henholdsvis Pol δ og FEN1 bidrar til å fjerne hele initiator -RNA før ligering. Mange forskyvninger må finne sted, og det er nødvendig med spaltningsreaksjoner for å fjerne initiator -primeren. Klaffen som opprettes og behandles, og den modnes av den korte klaffbanen.
Lang klaffebane
I noen tilfeller varer FEN1 i bare en kort periode og kobles fra replikasjonskomplekset. Dette forårsaker en forsinkelse i spaltningen at klaffene som forskyves av Pol δ blir lange. Når RPA når en lang nok lengde, kan den binde seg stabilt. Når de RPA -bundne klaffene blir refaktorisert til FEN1 -spaltning som krever en annen nuklease for behandling, har dette blitt identifisert som en alternativ nuklease, DNA2. DNA2 har defekter i DEN1 -overuttrykket. DNA2 viste å jobbe med FEN1 for å behandle lange klaffer. DNA2 kan dissosiere RPA fra en lang klaff, det gjør dette ved å bruke en mekanisme som FEN1. Den binder klaffen og tråder 5 'enden av klaffen. Nukleasen spalter klaffen og gjør den for kort til å binde seg til RPA, klaffen er for kort betyr at den er tilgjengelig for FEN1 og ligering. Dette er kjent som metoden for lang klaff. DNA2 kan fungere som FEN1 som en sikkerhetskopi for nukleaseaktivitet, men det er ikke en effektiv prosess.
Alternativ vei
Inntil nylig var det bare to kjente veier for å behandle Okazaki -fragmenter. Gjeldende undersøkelser har imidlertid konkludert med at en ny vei for Okazaki -fragmentering og DNA -replikasjon eksisterer. Denne alternative banen involverer enzymene Pol δ med Pif1 som utfører samme prosess for fjerning av klaff som Pol δ og FEN1.
Enzymer involvert i fragmentdannelse
Primase
Primase legger RNA -primere til den etterfølgende strengen, noe som tillater syntese av Okazaki -fragmenter fra 5 'til 3'. Imidlertid skaper primase RNA -primere med en mye lavere hastighet enn den der DNA -polymerase syntetiserer DNA på den ledende tråden. DNA -polymerase på den forsinkende strengen må også resirkuleres kontinuerlig for å konstruere Okazaki -fragmenter etter RNA -primere. Dette gjør hastigheten til lagring av strandsyntese mye lavere enn hastigheten på den ledende tråden. For å løse dette fungerer primase som et midlertidig stoppsignal, som kort stopper progresjonen til replikasjonsgaffelen under DNA -replikasjon. Denne molekylære prosessen forhindrer den ledende tråden i å overhalte den hengerenden.
DNA -polymerase δ
Nytt DNA blir laget i denne fasen av enzymer som syntetiserer DNA i 5 'til 3' retning. DNA -polymerase er avgjørende for både den ledende tråden som er laget som en kontinuerlig streng og en hengerstreng som er laget i små biter i DNA -syntese. Denne prosessen skjer for forlengelse av det nysyntetiserte fragmentet og utvisning av RNA- og DNA -segmentet. Syntese skjer i 3 faser med to forskjellige polymeraser, DNA-polymerase α-primase og DNA-polymerase δ. Denne prosessen starter med at polymerase α-primase forskyves fra RNA og DNA-primeren ved hjelp av replikeringseffekten for klemmelaster, denne effekten leder glideklemmen inn på DNA. Etter dette begynner DNA -polymerase δ å gå inn i sin holoenzymform som deretter begynner syntesen. Synteseprosessen vil fortsette til 5' -enden av det forrige Okazaki -fragmentet har kommet. Når den kom, fortsetter Okazaki -fragmentbehandlingen å koble det nylig syntetiserte fragmentet til den hengerende strengen. Den siste funksjonen til DNA -polymerase δ er å tjene som et supplement til FEN1/RAD27 5 'flap -endonukleaseaktivitet. Rad27-p-allelen er dødelig i de fleste kombinasjoner, men var levedyktig med rad27-p-polymerasen og exo1. Både rad27-p-polymerase og exo1 viser sterke synergistiske økninger i CAN 1-duplikasjonsmutasjoner. Den eneste grunnen til at denne mutasjonen er levedyktig, er på grunn av dobbeltstrengede reparasjonsgener RAD50, RAD51 og RAD52. RAD27/FEN1 skaper hakk mellom tilstøtende Okazaki-fragmenter ved å minimere mengden av strengutvisning i den hengerende strengen.
DNA -ligase I
Under lagringstrandsyntese kobler DNA -ligase I Okazaki -fragmentene, etter at RNA -primerne ble erstattet med DNA -nukleotider med DNA -polymerase δ. Okazaki-fragmenter som ikke er ligert kan forårsake dobbelt-strengbrudd, som spalter DNA. Siden bare et lite antall dobbeltstrengede brudd tolereres, og bare et lite antall kan repareres, kan nok ligeringsfeil være dødelig for cellen.
Videre forskning impliserer den supplerende rollen som det prolifererende celle -nukleære antigenet (PCNA) til DNA -ligase I -funksjonen ved å forbinde Okazaki -fragmenter. Når PCNA -bindingsstedet på DNA -ligase I er inaktivt, er DNA -ligase I's evne til å koble Okazaki -fragmenter alvorlig svekket. Således følger en foreslått mekanisme: etter at et PCNA-DNA-polymerase δ-kompleks syntetiserer Okazaki-fragmenter, frigjøres DNA-polymerasen δ. Deretter binder DNA -ligase I til PCNA, som klemmes til hakkene i den hengerstrengen, og katalyserer dannelsen av fosfodiesterbindinger.
Klaff endonuklease 1
Klaffendonuklease 1 ( FEN1 ) er ansvarlig for behandling av Okazaki -fragmenter . Det fungerer med DNA -polymerase for å fjerne RNA -primeren til et Okazaki -fragment og kan fjerne 5' -ribonukleotid- og 5' -klaffene når DNA -polymerase fortrenger strengene under lagring av strengsyntese. Fjerning av disse klaffene innebærer en prosess som kalles nick -oversettelse og skaper et nick for ligering. Således er FEN1s funksjon nødvendig for Okazaki -fragmentets modning for å danne en lang kontinuerlig DNA -streng. På samme måte, under reparasjon av DNA -basen, blir det skadede nukleotidet forflyttet til en klaff og deretter fjernet av FEN1.
Dna2 endonuklease
Dna2-endonuklease har ikke en spesifikk struktur og egenskapene deres er ikke godt karakterisert, men kan omtales som enkeltstrenget DNA med frie ender (ssDNA). Dna2 -endonuklease er avgjørende for å spalte lange DNA -klaffer som forlater FEN1 under Okazaki -prosessen. Dna2 endonuklease er ansvarlig for fjerning av initiator -RNA -segmentet på Okazaki -fragmenter. Dna2 -endonuklease har også en sentral rolle i mellomproduktene som dannes under forskjellige DNA -metabolisme og er funksjonell i vedlikehold av telomer.
Dna2 -endonuklease blir aktiv når et terminal RNA -segment fester seg ved 5' -enden, fordi det translokerer i 5 'til 3' -retningen. I nærvær av et enkeltstrenget DNA-bindende protein RPA blir DNA 5'-klaffene for lange, og hakkene passer ikke lenger som substrat for FEN1. Dette forhindrer FEN1 i å fjerne 5′-klaffene. Dermed er Dna2s rolle å redusere 3' -enden av disse fragmentene, noe som gjør det mulig for FEN1 å kutte klaffene, og Okazaki -fragmentets modning mer effektiv. Under Okazaki -prosessen er Dna2 -helikase og endonuklease uatskillelige. Dna2 Endonuklease er ikke avhengig av den 5'-tailed gaffelstrukturen av aktiviteten. Uproduktiv binding har vært kjent for å skape blokker for FEN1 -spaltning og sporing. Det er kjent at ATP reduserer aktivitet, men fremmer frigjøring av 3'-ende-etiketten. Studier har antydet at en ny modell av Dna2 Endonuklease og FEN1 er delvis ansvarlig for modning av Okazaki -fragment.
Biologisk funksjon
Nysyntetisert DNA, ellers kjent som Okazaki -fragmenter, er bundet av DNA -ligase, som danner en ny DNA -streng. Det er to tråder som dannes når DNA blir syntetisert. Den ledende strengen syntetiseres kontinuerlig og forlenges under denne prosessen for å avsløre malen som brukes for den hengerende strengen (Okazaki -fragmenter). Under prosessen med DNA -replikasjon blir DNA- og RNA -primere fjernet fra DNA -lagringstrengen for å la Okazaki -fragmenter binde seg til. Siden denne prosessen er så vanlig, vil Okazaki -modning finne sted rundt en million ganger under en ferdigstillelse av DNA -replikasjon. For at Okazaki -modning skal skje, må RNA -primere lage segmenter på fragmentene som skal ligeres. Dette brukes som en byggestein for syntese av DNA i den hengerstrengen. På malstrengen vil polymerase syntetisere i motsatt retning fra replikasjonsgaffelen. Når malen blir diskontinuerlig, vil den opprette et Okazaki -fragment. Defekter i modning av Okazaki -fragmenter kan potensielt føre til at trådene i DNAet brytes og forårsaker forskjellige former for kromosomavvik. Disse mutasjonene i kromosomene kan påvirke utseendet, antall sett eller antall individuelle kromosomer. Siden kromosomer er fikset for hver spesifikke art, kan det også endre DNA og forårsake defekter i slekten til denne arten.
Forskjeller i prokaryoter og eukaryoter
Okazaki -fragmenter er til stede i både prokaryoter og eukaryoter . DNA -molekyler i eukaryoter skiller seg fra de sirkulære molekylene til prokaryoter ved at de er større og vanligvis har flere replikasjonsopprinnelser. Dette betyr at hvert eukaryotisk kromosom består av mange replikerende enheter av DNA med flere replikasjonsopprinnelser. Til sammenligning har prokaryot DNA bare et enkelt replikasjonsopprinnelse. I eukaryoter danner disse replikerende gaflene, som er mange langs DNA -en, "bobler" i DNA -en under replikasjon. Replikasjonsgaffelen dannes på et bestemt punkt som kalles autonomt replikerende sekvenser (ARS). Eukaryoter har et klemmelasterkompleks og en seks-enheters klemme kalt det prolifererende celle-atomantigenet. Den effektive bevegelsen av replikasjonsgaffelen er også kritisk avhengig av den raske plasseringen av glideklemmer på nylig primede steder på den DNA-strengen som henger etter av ATP-avhengige klemmelasterkomplekser. Dette betyr at stykkvis generering av Okazaki -fragmenter kan følge med den kontinuerlige syntesen av DNA på den ledende tråden. Disse klemmelasterkompleksene er karakteristiske for alle eukaryoter og skiller noen av de mindre forskjellene i syntesen av Okazaki -fragmenter i prokaryoter og eukaryoter. Lengden på Okazaki -fragmenter i prokaryoter og eukaryoter er også forskjellige. Prokaryoter har Okazaki -fragmenter som er ganske lengre enn eukaryoter. Eukaryoter har vanligvis Okazaki -fragmenter som er 100 til 200 nukleotider lange, mens fragmenter i prokaryote E. coli kan være 2000 nukleotider lange. Årsaken til denne uoverensstemmelsen er ukjent.
Hvert eukaryot kromosom består av mange replikerende enheter av DNA med flere replikasjonsopprinnelser. Til sammenligning har det prokaryote E. coli -kromosomet bare et enkelt replikasjonsopprinnelse. Replikasjon i prokaryoter skjer inne i cytoplasma, og alt dette begynner replikasjonen som er dannet av omtrent 100 til 200 eller flere nukleotider. Eukaryote DNA -molekyler har et betydelig større antall replikoner , omtrent 50 000 eller mer; replikering skjer imidlertid ikke samtidig på alle replikonene. I eukaryoter skjer DNA -replikasjon i kjernen. En overflod av replikasjon i bare ett replikerende DNA-molekyl, starten på DNA-replikasjon flyttes bort av multi-underenhetsproteinet. Denne replikasjonen er treg, og noen ganger tilsettes omtrent 100 nukleotider per sekund.
Vi tar av dette at prokaryote celler er enklere i struktur, de har ingen kjerne, organeller og veldig lite DNA, i form av et enkelt kromosom. Eukaryote celler har kjerne med flere organeller og mer DNA arrangert i lineære kromosomer. Vi ser også at størrelsen er en annen forskjell mellom disse prokaryote og eukaryote cellene. Den gjennomsnittlige eukaryote cellen har omtrent 25 ganger mer DNA enn en prokaryot celle har. Replikasjon skjer mye raskere i prokaryote celler enn i eukaryote celler; noen ganger tar bakterier bare 40 minutter, mens dyreceller kan ta opptil 400 timer. Eukaryoter har også en distinkt operasjon for å replikere telomerer på slutten av deres siste kromosomer. Prokaryoter har sirkulære kromosomer, og forårsaker ingen ender å syntetisere. Prokaryoter har en kort replikasjonsprosess som skjer kontinuerlig; eukaryote celler, derimot, gjennomfører bare DNA-replikasjon under S-fasen av cellesyklusen .
Likhetene er trinnene for DNA -replikasjon. I både prokaryoter og eukaryoter oppnås replikasjon ved å vikle DNA av et enzym som kalles DNA -helikase. Nye tråder dannes av enzymer kalt DNA -polymeraser. Begge disse følger et lignende mønster, kalt semi-konservativ replikasjon, der individuelle DNA-tråder produseres i forskjellige retninger, noe som lager en ledende og henger streng. Disse hengende trådene syntetiseres ved produksjon av Okazaki -fragmenter som snart slås sammen. Begge disse organismer begynner nye DNA -tråder som også inkluderer små tråder av RNA.
Bruksområder innen teknologi
Medisinske konsepter assosiert med Okazaki -fragmenter
Selv om cellene gjennomgår flere trinn for å sikre at det ikke er mutasjoner i den genetiske sekvensen, går noen ganger spesifikke slettinger og andre genetiske endringer under modning av Okazaki -fragment ubemerket. Fordi Okazaki -fragmenter er settet med nukleotider for den forsinkende strengen, kan enhver endring inkludert sletting, innsetting eller duplisering fra den opprinnelige tråden forårsake en mutasjon hvis den ikke blir oppdaget og fikset. Andre årsaker til mutasjoner inkluderer problemer med proteinene som hjelper til med DNA -replikasjon. For eksempel påvirker en mutasjon relatert til primase fjerning av RNA -primer og kan gjøre DNA -tråden mer skjør og utsatt for brudd. En annen mutasjon gjelder polymerase α, som svekker redigeringen av Okazaki -fragmentsekvensen og inkorporering av proteinet i det genetiske materialet. Begge endringene kan føre til kromosomavvik, utilsiktet genetisk omorganisering og en rekke kreftformer senere i livet.
For å teste effekten av proteinmutasjonene på levende organismer, forskere genetisk endrede laboratoriemus for å være homozygote for en annen mutasjon i protein relatert til DNA -replikasjon, klaffendonuklease 1 eller FEN1. Resultatene varierte basert på de spesifikke genendringene. De homozygote knockout -mutantmusene opplevde en "svikt i cellespredning" og "tidlig embryonal dødelighet" (27). Musene med mutasjonen F343A og F344A (også kjent som FFAA) døde like etter fødselen på grunn av komplikasjoner i fødsel inkludert pancytopeni og lunge hypoplasi . Dette er fordi FFAA -mutasjonen forhindrer FEN1 i å samhandle med PCNA (prolifererende celle -atomantigen), og dermed ikke tillate det å fullføre sitt formål under Okazaki -fragmentets modning. Interaksjonen med dette proteinet anses å være den viktigste molekylære funksjonen i FEN1s biologiske funksjon. FFAA-mutasjonen forårsaker defekter i fjerning av RNA-primer og reparasjon av lange basepar, som forårsaker mange brudd i DNA. Under nøye observasjon ser det ut til at celler som er homozygote for FFAA FEN1 -mutasjoner bare viser delvise defekter i modning, noe som betyr at mus heterozygote for mutasjonen vil kunne overleve til voksen alder, til tross for at de opprettholder flere små hakk i genomene. Uunngåelig hindrer imidlertid disse nikkene fremtidig DNA -replikasjon fordi bruddet får replikasjonsgaffelen til å kollapse og forårsaker dobbeltstrengbrudd i den faktiske DNA -sekvensen. Med tiden forårsaker disse nikkene også fulle kromosombrudd, noe som kan føre til alvorlige mutasjoner og kreftformer. Andre mutasjoner er implementert med endrede versjoner av Polymerase α, noe som fører til lignende resultater.
Referanser
Videre lesning
- Inman, Ross B .; Schnös, Maria (mars 1971). "Struktur av forgreningspunkter i replikerende DNA: Tilstedeværelse av enkeltstrengede forbindelser i λ DNA-grenpunkter". Journal of Molecular Biology . 56 (2): 319–325. doi : 10.1016/0022-2836 (71) 90467-0 . PMID 4927949 .
- Thommes, Pia; Hubscher, Ulrich (desember 1990). "Eukaryotisk DNA -replikasjon. Enzymer og proteiner som virker ved gaffelen". European Journal of Biochemistry . 194 (3): 699–712. doi : 10.1111/j.1432-1033.1990.tb19460.x . PMID 2269294 .
- "Kromosomavvik." Biology Reference, www.biologyreference.com/Ce-Co/Chromosome-Aberrations.html.
Cooper, Geoffrey M. "DNA -replikasjon." Nåværende Neurology and Neuroscience Reports., US National Library of Medicine, 1. januar 1970, www.ncbi.nlm.nih.gov/books/NBK9940/.
Eksterne linker
- Okazaki+fragmenter ved US National Library of Medicine Medical Subject Headings (MeSH)
- McGraw Hill Higher Education -artikkel som diskuterer DNA -syntese