Kalium- tert- butoksid -Potassium tert-butoxide
|
|
|||
|
|||
| Navn | |||
|---|---|---|---|
|
Foretrukket IUPAC-navn
Kalium- tert- butoksid |
|||
| Identifikatorer | |||
|
3D-modell ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard |
100.011.583 |
||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eiendommer | |||
| C 4 H 9 KO | |||
| Molarmasse | 112,21 g mol −1 | ||
| Utseende | fast | ||
| Smeltepunkt | 256 ° C (493 ° F, 529 K) | ||
| Løselighet i dietyleter | 4,34 g / 100 g (25-26 ° C) | ||
| Løselighet i heksan | 0,27 g / 100 g (25-26 ° C) | ||
| Løselighet i Toluen | 2,27 g / 100 g (25-26 ° C) | ||
| Løselighet i THF | 25,00 g / 100 g (25-26 ° C) | ||
| Farer | |||
| Sikkerhetsdatablad | Oxford MSDS | ||
|
EU-klassifisering (DSD) (utdatert)
|
Skadelig (Xn), Etsende (C) | ||
|
Med mindre annet er angitt, blir data gitt for materialer i standardtilstand (ved 25 ° C, 100 kPa). |
|||
|
|
|||
| Infoboksreferanser | |||
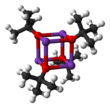
Kalium -tert- butoksyd er den kjemiske forbindelsen med formel K + (CH 3 ) 3- CO - . Dette fargeløse faste stoffet er en sterk base (pKa av konjugatsyre rundt 17), som er nyttig i organisk syntese . Den eksisterer som en tetramersk kubantype-klynge . Det blir ofte sett skrevet i kjemisk litteratur som kalium- t- butoksid. Forbindelsen er ofte avbildet som et salt, og den oppfører seg ofte som sådan, men den ioniseres ikke i oppløsning.
Forberedelse
Kalium- t- butoksid er kommersielt tilgjengelig som en løsning og som et fast stoff, men det genereres ofte in situ for laboratoriebruk fordi prøvene er så følsomme og eldre prøver ofte har dårlig kvalitet. Den fremstilles ved omsetning av tørr tert- butylalkohol med kaliummetall . Det faste stoffet oppnås ved å fordampe disse løsningene etterfulgt av oppvarming av det faste stoffet. Det faste stoffet kan renses ved sublimering ved 220 ° C og 1 mmHg. Sublimering kan også finne sted ved 140 ° C og 0,01 hPa. Det anbefales å dekke råmaterialet med glassull, da kalium-tert-butanolat har en tendens til å "sprette", slik at deler kan kastes opp under sublimeringen. Den vannfrie fjerningen ved bruk av et inert sublimeringsapparat er spesielt fordelaktig.
Struktur
Kalium- tert- butoksid krystalliserer fra tetrahydrofuran / pentan ved -20 ° C som [tBuOK · tBuOH] ∞ , som består av uendelige endimensjonale kjeder bundet ved hydrogenbinding . Sublimering av [tBuOK · tBuOH] ∞ gir tetramer [tBuOK] 4 , som vedtar en kubanlignende struktur. Mild Lewis basiske løsningsmidler som THF og dietyleter bryter ikke opp den tetrameriske strukturen, som vedvarer i det faste stoffet, i oppløsning og til og med i gassfasen.
applikasjoner
Den tert -butoksyd art er i seg selv nyttig som en sterk, ikke-nukleofil base i organisk kjemi. Det er ikke så sterkt som amidbaser, for eksempel litiumdiisopropylamid , men sterkere enn kaliumhydroksid. Dens sterisk hindring hindrer gruppen fra å delta i nukleofil addisjon, slik som i en Williamson etersyntese eller en S- N- 2 reaksjonen. Substrater som er deprotonert av kalium- t- butoksid inkluderer terminale acetylener og aktive metylenforbindelser . Det er nyttig i dehydrohalogeneringsreaksjoner .
Kalium -tert- butoksyd katalyserer reaksjonen av hydrosilaner og heterosykliske forbindelser, hvilket gir de silylderivater, med frigjøring av H- 2 .
Modifikasjoner
Mange modifikasjoner er rapportert som påvirker reagensen til dette reagenset. Forbindelsen vedtar en kompleks klyngestruktur (bildet ved siden er en forenklet tegneserie), og tilsetningsstoffer som endrer klyngen påvirker reagensens reaktivitet. For eksempel samhandler DMF , DMSO , heksametylfosforamid (HMPA) og 18-krone-6 med kaliumsenteret, noe som forbedrer basoksydet til butoksidet. Schlossers base , en blanding av alkoksydet og en alkyllitiumforbindelse, er en beslektet, men sterkere base.
Reaksjoner
Kalium- tert- butoksid reagerer med kloroform og gir diklorkarben , reaksjonen kan føre til antenning. Kalium- tert- butoksid skal aldri tilsettes diklormetan.
Som en base kan kalium-tert-butoxide trekke ut en beta-proton og danne Hofmann-produktet via en eliminasjonsreaksjon . Denne reaksjonen har en høy syntetisk verdi, da den kan sette opp ytterligere reaksjoner av den resulterende alkenen , spesielt regiokjemiske reaksjoner.