Terskelpotensial - Threshold potential
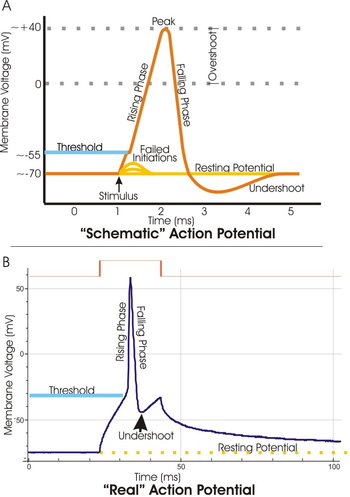
I elektrofysiologi er terskelpotensialet det kritiske nivået som et membranpotensial må depolariseres for å starte et handlingspotensial . I nevrovitenskap er terskelpotensialer nødvendige for å regulere og spre signalering i både sentralnervesystemet (CNS) og det perifere nervesystemet (PNS).
Oftest er terskelpotensialet en membranpotensialverdi mellom –50 og –55 mV , men kan variere basert på flere faktorer. Et neurons hvilemembranpotensial (–70 mV) kan endres for enten å øke eller redusere sannsynligheten for å nå terskel via natrium- og kaliumioner . En tilstrømning av natrium inn i cellen gjennom åpne, spenningsgaterte natriumkanaler kan depolarisere membranen forbi terskelen og dermed eksitere den mens en strøm av kalium eller tilstrømning av klorid kan hyperpolarisere cellen og dermed hemme terskelen fra å nås.
Oppdagelse
De første eksperimentene dreide seg om konseptet om at enhver elektrisk endring som oppstår i nevroner må skje gjennom virkningen av ioner. Den tyske fysiske kjemikeren Walther Nernst brukte dette konseptet i eksperimenter for å oppdage nervøs eksitabilitet, og konkluderte med at den lokale eksitatoriske prosessen gjennom en semi-permeabel membran avhenger av ionekonsentrasjonen. Ionkonsentrasjon ble også vist å være den begrensende faktoren i eksitasjon. Hvis riktig konsentrasjon av ioner ble oppnådd, ville det absolutt oppstå eksitasjon. Dette var grunnlaget for å oppdage terskelverdien.
Sammen med å rekonstruere handlingspotensialet på 1950 -tallet, var Alan Lloyd Hodgkin og Andrew Huxley også i stand til eksperimentelt å bestemme mekanismen bak terskelen for eksitasjon. Den er kjent som Hodgkin - Huxley -modellen . Gjennom bruk av spenningsklemmeteknikker på et blekksprut -gigantisk axon, oppdaget de at spennende vev generelt viser fenomenet at et visst membranpotensial må nås for å avfyre et handlingspotensial. Siden eksperimentet ga resultater gjennom observasjon av ioniske konduktansendringer, brukte Hodgkin og Huxley disse begrepene for å diskutere terskelpotensialet. De antydet først at det må være en diskontinuitet i konduktansen av enten natrium eller kalium, men i virkeligheten hadde begge konduktansene en tendens til å variere jevnt sammen med membranpotensialet.
De oppdaget snart at ved terskelpotensial var inn- og utstrømmene til henholdsvis natrium- og kaliumioner nøyaktig like og motsatte. I motsetning til hvilemembranpotensialet, viste terskelpotensialets forhold en balanse mellom strømmer som var ustabile. Ustabilitet refererer til det faktum at ytterligere depolarisering aktiverer enda flere spenningsgaterte natriumkanaler, og den innkommende natriumdepolariserende strømmen overvinner den forsinkede utadgående strømmen av kalium. På hvilenivå, derimot, er kalium- og natriumstrømmene like og motsatte på en stabil måte, der en plutselig, kontinuerlig strøm av ioner ikke bør oppstå. Grunnlaget er at på et visst nivå av depolarisering, når strømmen er lik og motsatt på en ustabil måte, genererer enhver ytterligere registrering av positiv ladning et handlingspotensial. Denne spesifikke verdien av depolarisering (i mV) er ellers kjent som terskelpotensialet.
Fysiologisk funksjon og egenskaper
Terskelverdien styrer om innkommende stimuli er tilstrekkelige til å generere et handlingspotensial. Den er avhengig av en balanse mellom innkommende hemmende og eksitatoriske stimuli. Potensialene generert av stimuliene er additive, og de kan nå terskelen avhengig av frekvens og amplitude. Normal funksjon av sentralnervesystemet innebærer en summering av synaptiske innganger som i stor grad gjøres på et nevronets dendritiske tre. Disse lokale graderte potensialene, som først og fremst er assosiert med eksterne stimuli, når aksons initialsegment og bygger til de klarer å nå terskelverdien. Jo større stimulans, desto større depolarisering eller forsøk på å nå terskel. Oppgaven med depolarisering krever flere viktige trinn som er avhengige av cellens anatomiske faktorer. De involverte ionekonduktansene avhenger av membranpotensialet og også tiden etter at membranpotensialet endres.
Hvilemembranpotensial
Den fosfolipidbilag av cellemembranen er i seg selv meget ugjennomtrengelig for ioner. Den komplette strukturen til cellemembranen inkluderer mange proteiner som er innebygd i eller krysser helt lipidbilaget. Noen av disse proteinene åpner for den meget spesifikke passasjen av ioner, ionekanaler . Lekkasje av kaliumkanaler lar kalium strømme gjennom membranen som svar på forskjellen i kaliumkonsentrasjoner inne (høy konsentrasjon) og utenfor cellen (lav). Tapet av positive (+) ladninger av kalium (K+) -ionene fra innsiden av cellen resulterer i et negativt potensial der sammenlignet med membranens ekstracellulære overflate. En mye mindre "lekkasje" av natrium (Na+) inn i cellen resulterer i at det faktiske hvilepotensialet, cirka –70 mV, er mindre negativt enn det beregnede potensialet for K+ alene, likevektspotensialet, cirka –90 mV. Den natrium-kalium-ATPase er en aktiv transportør inne i membranen som pumper kalium (2-ioner) tilbake inn i cellen og natrium (3 ioner) ut av cellen, opprettholde konsentrasjonene av begge ioner, så vel som konserverings spenningen polarisasjon.
Depolarisering
Imidlertid, når en stimulus aktiverer de spenningsgaterte natriumkanalene for å åpne, strømmer positive natriumioner inn i cellen og spenningen øker. Denne prosessen kan også initieres ved at ligand eller nevrotransmitter bindes til en ligand-gated kanal . Mer natrium er utenfor cellen i forhold til innsiden, og den positive ladningen i cellen driver utstrømningen av kaliumioner gjennom forsinkede likeretter-spenningsgaterte kaliumkanaler. Siden kaliumkanalene i cellemembranen er forsinket, aktiverer enhver ytterligere inngang av natrium flere og flere spenningsgaterte natriumkanaler. Depolarisering over terskel resulterer i en økning i konduktansen av Na som er tilstrekkelig til at natriumbevegelsen innover kan sumpe utover kaliumbevegelsen umiddelbart. Hvis tilstrømningen av natriumioner ikke når terskelen, øker ikke natriumkonduktansen tilstrekkelig mengde til å overstyre den hvilende kaliumkonduktansen. I så fall observeres subtreshold membranpotensielle svingninger i noen type nevroner. Hvis det lykkes, depolariserer den plutselige tilstrømningen av positiv ladning membranen, og kalium forsinkes i reetablering eller hyperpolarisering av cellen. Natriumtilstrømning depolariserer cellen i et forsøk på å etablere sitt eget likevektspotensial (ca. +52 mV) for å gjøre innsiden av cellen mer positiv i forhold til utsiden.
Variasjoner
Terskelverdien kan variere i henhold til mange faktorer. Endringer i ionekonduktansene av natrium eller kalium kan føre til enten en forhøyet eller senket terskelverdi. I tillegg påvirker aksonens diameter, tettheten av spenningsaktiverte natriumkanaler og egenskapene til natriumkanaler i axonet alle terskelverdien. Vanligvis i axon eller dendrit er det små depolariserende eller hyperpolariserende signaler som følge av en tidligere stimulans. Den passive spredningen av disse signalene avhenger av cellens passive elektriske egenskaper. Signalene kan bare fortsette langs nevronet for å forårsake et handlingspotensial lenger ned hvis de er sterke nok til å komme forbi cellens membranmotstand og kapasitans. For eksempel har et nevron med en stor diameter flere ioniske kanaler i membranen enn en mindre celle, noe som resulterer i en lavere motstand mot strømmen av ionestrøm. Strømmen sprer seg raskere i en celle med mindre motstand, og er mer sannsynlig å nå terskelen ved andre deler av nevronet.
Terskelpotensialet har også vist seg eksperimentelt å tilpasse seg langsomme endringer i inngangskarakteristikkene ved å regulere natriumkanaltettheten samt inaktivere disse natriumkanalene totalt sett. Hyperpolarisering av kaliumkanalene med forsinket likeretter forårsaker en relativ ildfast periode som gjør det mye vanskeligere å nå terskelen. Kaliumkanalene med forsinket likeretter er ansvarlige for den sene utadgående fasen av handlingspotensialet, der de åpnes ved en annen spenningsstimulering sammenlignet med de raskt aktiverte natriumkanalene. De korrigerer, eller reparerer, balansen av ioner over membranen ved å åpne og la kalium strømme ned i konsentrasjonsgradienten fra innsiden til utsiden av cellen. De lukker også sakte, noe som resulterer i en utadgående strøm av positiv ladning som overstiger den nødvendige balansen. Det resulterer i overdreven negativitet i cellen, noe som krever en ekstremt stor stimulans og resulterende depolarisering for å forårsake et svar.
Sporingsteknikker
Terskelsporingsteknikker tester nervepirring og er avhengig av egenskapene til aksonale membraner og steder for stimulering. De er ekstremt følsomme for membranpotensialet og endringer i dette potensialet. Disse testene kan måle og sammenligne en kontrollterskel (eller hvileterskel) med en terskel produsert av en endring i miljøet, med en foregående enkeltimpuls, et impulstog eller en undergrensestrøm. Måling av endringer i terskel kan indikere endringer i membranpotensial, aksonale egenskaper og/eller integriteten til myelinkappen .
Terskelsporing gjør at styrken til en teststimulus kan justeres av en datamaskin for å aktivere en definert brøkdel av det maksimale nerve- eller muskelpotensialet. Et terskelsporingseksperiment består av en stimulering på 1 ms som påføres en nerve med jevne mellomrom. Handlingspotensialet registreres nedstrøms fra den utløsende impulsen. Stimuleringen reduseres automatisk i trinn på en angitt prosentandel til responsen faller under målet (generering av et handlingspotensial). Deretter trappes stimulansen opp eller ned, avhengig av om den forrige responsen var mindre eller større enn målresponsen til en hvile (eller kontroll) terskel er etablert. Nervespitabilitet kan deretter endres ved å endre nervemiljøet eller påføre ytterligere strømmer. Siden verdien av en enkelt terskelstrøm gir lite verdifull informasjon fordi den varierer innenfor og mellom emner, er par med terskelmålinger, sammenligning av kontrollterskelen med terskler produsert av ildfasthet, supernormalitet, styrke-varighetstidskonstant eller "terskelelektrotonus" mer nyttige i vitenskapelig og klinisk studie.
Sporingsterskelen har fordeler i forhold til andre elektrofysiologiske teknikker, som metoden for konstant stimulering. Denne teknikken kan spore terskelendringer innenfor et dynamisk område på 200% og generelt gi mer innsikt i aksonale egenskaper enn andre tester. Denne teknikken tillater også at endringer i terskel gis en kvantitativ verdi, som når de matematisk omdannes til en prosentandel, kan brukes til å sammenligne enkeltfiber- og multifiberpreparater, forskjellige nevronale steder og nervepirring hos forskjellige arter.
"Terskelelektrotonus"
En spesifikk terskelsporingsteknikk er terskelelektrotonus , som bruker terskelsporingsoppsettet for å produsere langvarige depolariserende eller hyperpolariserende strømmer i en membran. Endringer i celle-eksitabilitet kan observeres og registreres ved å lage disse langvarige strømningene. Terskelreduksjon er tydelig under omfattende depolarisering, og terskeløkning er tydelig med omfattende hyperpolarisering. Med hyperpolarisering er det en økning i motstanden til den interneodale membranen på grunn av lukking av kaliumkanaler, og det resulterende plottet "vifter ut". Depolarisering produserer har motsatt effekt, aktivering av kaliumkanaler, og produserer et plot som "fans".
Den viktigste faktoren som bestemmer terskelelektrotonus er membranpotensial, så terskelelektrotonus kan også brukes som en indeks for membranpotensial. Videre kan den brukes til å identifisere kjennetegn ved betydelige medisinske tilstander ved å sammenligne effekten av disse forholdene på terskelpotensialet med effektene sett eksperimentelt. For eksempel forårsaker iskemi og depolarisering den samme "vifting" -effekten av elektrotonusbølgeformene. Denne observasjonen fører til konklusjonen at iskemi kan skyldes overaktivering av kaliumkanaler.
Klinisk signifikans
Terskelpotensialets rolle har vært implisert i en klinisk sammenheng, nemlig i funksjonen til selve nervesystemet så vel som i det kardiovaskulære systemet.
Feberkramper
Et feberkramper , eller "febertilpasning", er en krampe forbundet med en betydelig økning i kroppstemperaturen , som oftest forekommer tidlig i barndommen. Gjentatte episoder med feberkramper i barndommen er forbundet med en økt risiko for epilepsi i tinninglappen i voksen alder.
Med patch clamp -innspilling ble en analog tilstand gjentatt in vitro i rottekortikale nevroner etter induksjon av febrile kroppstemperaturer; en bemerkelsesverdig reduksjon i terskelpotensial ble observert. Mekanismen for denne reduksjonen innebærer muligens undertrykkelse av inhibering mediert av GABA B -reseptoren med overdreven varmeeksponering.
ALS og diabetes
Abnormiteter i nevronal eksitabilitet har blitt observert hos amyotrofisk lateral sklerose og diabetespasienter . Selv om mekanismen som til slutt er ansvarlig for variansen er forskjellig mellom de to tilstandene, indikerer tester gjennom et svar på iskemi en lignende motstand, ironisk nok, for iskemi og resulterende parestesier. Ettersom iskemi oppstår gjennom inhibering av natrium-kaliumpumpen, er abnormiteter i terskelpotensialet derfor implisert.
Arrythmia
Siden 1940 -tallet har begrepet diastolisk depolarisering, eller "pacemakerpotensial", blitt etablert; denne mekanismen er et karakteristisk særpreg for hjertevev. Når terskelen er nådd og det resulterende handlingspotensialet brenner, oppstår et hjerteslag fra interaksjonene; Men når dette hjerteslaget oppstår på et uregelmessig tidspunkt, kan det oppstå en potensielt alvorlig tilstand som kalles arrytmi .
Bruk av medisiner
En rekke medikamenter kan presentere forlengelse av QT -intervallet som en bivirkning. Forlengelse av dette intervallet er et resultat av en forsinkelse i natrium- og kalsiumkanalinaktivering; uten riktig kanalinaktivering, er terskelpotensialet nådd for tidlig og dermed har arytmi en tendens til å oppstå. Disse stoffene, kjent som proarytmiske midler, inkluderer antimikrobielle midler, antipsykotika, metadon og ironisk nok antiarytmiske midler . Bruk av slike midler er spesielt hyppig på intensivavdelinger, og spesiell forsiktighet må utvises når QT -intervaller forlenges hos slike pasienter: arytmier som følge av forlengede QT -intervaller inkluderer potensielt dødelige torsades de pointes , eller TdP.
Kostholdets rolle
Kosthold kan være en variabel i risikoen for arytmi. Flerumettede fettsyrer , som finnes i fiskeoljer og flere planteoljer, har en rolle i forebyggingen av arytmier. Ved å hemme den spenningsavhengige natriumstrømmen, skifter disse oljene terskelpotensialet til en mer positiv verdi; Derfor krever et handlingspotensial økt depolarisering. Klinisk terapeutisk bruk av disse ekstraktene er fortsatt gjenstand for forskning, men det er etablert en sterk sammenheng mellom regelmessig inntak av fiskeolje og lavere sykehusinnleggelse for atrieflimmer, en alvorlig og stadig mer vanlig arrytmi.
Merknader
Referanser
- Bostock, Hugh; Cikurel, Katia; Burke, David (1998). "Terskelsporingsteknikker i studiet av menneskelig perifer nerve". Muskel og nerve . 21 (2): 137–158. doi : 10.1002/(SICI) 1097-4598 (199802) 21: 2 <137 :: AID-MUS1> 3.0.CO; 2-C .
- Burke, D; Kiernan, Matthew C; Bostock, Hugh (2001). "Spenning av menneskelige aksoner". Klinisk nevrofysiologi . 112 (9): 1575–1585. doi : 10.1016/S1388-2457 (01) 00595-8 .
- Monfredi, O; Dobrzyński, H; Mondal, T; Boyett, MR; Morris, GM (2010). "Anatomi og fysiologi til den kinesiske noden - en samtidsoversikt". Pacing og klinisk elektrofysiologi . 33 (11): 1392–1406. doi : 10.1111/j.1540-8159.2010.02838.x . PMID 20946278 .
- Nelson, S; Leung, J (2011). "QTc -forlengelse på intensivavdelingen: En gjennomgang av fornærmende agenter". AACN Advanced Critical Care . 22 (4): 289–295. doi : 10.1097/NCI.0b013e31822db49d . PMID 22064575 .
- Nicholls, JG; Martin, AR; Fuchs, PA; Brown, DA; Diamond, ME; Weisblat, DA (2012). Fra Neuron to Brain (5. utg.). Sunderland, Massachusetts: Sinauer Associates, Inc.
- Rushton, WAH (1927). "Effekten på terskelen for nervøs eksitasjon av lengden på eksponert nerve, og vinkelen mellom strøm og nerve" . Journal of Physiology . 63 (4): 357–377. doi : 10.1113/jphysiol.1927.sp002409 . PMC 1514939 . PMID 16993895 .
- Savelieva, I; Kourliouros, Antonios; Camm, John (2010). "Primær og sekundær forebygging av atrieflimmer med statiner og flerumettede fettsyrer: gjennomgang av bevis og klinisk relevans". Naunyn-Schmiedebergs arkiv for farmakologi . 381 (3): 207–219. doi : 10.1007/s00210-009-0468-y . PMID 19937318 .
- Seifter, Julian; Ratner, Austin; Sloane, David (2005). Konsepter i medisinsk fysiologi . Lippincott Williams & Wilkins. ISBN 978-0781744898.
- Stuart, G; Spruston, N; Sakmann, B; Häusser, M (1997). "Handlingspotensial initiering og tilbakepropagering i nevroner i pattedyrets CNS" (PDF) . Trender innen nevrovitenskap . 20 (3): 125–131. doi : 10.1016/S0166-2236 (96) 10075-8 . PMID 9061867 .
- Trautwein, W (1963). "Generering og ledning av impulser i hjertet som påvirket av medisiner". Farmakologiske anmeldelser . 15 (2): 277–332.
- Wang, Y; Qin, J; Han, Y; Cai, J; Xing, G (2011). "Hypertermi induserer epileptiforme utslipp i dyrkede kortikale nevroner hos rotter". Hjerneforskning . 1417 : 87–102. doi : 10.1016/j.brainres.2011.08.027 . PMID 21907327 .
Eksterne linker
- Nosek, Thomas M. "Seksjon 1/1ch4/s1ch4_8" . Essentials of Human Physiology . Arkivert fra originalen 2016-03-24.
- Beskrivelse på cameron.edu
- Diagram på nih.gov
