Membranpotensial - Membrane potential

Membranpotensial (også transmembranpotensial eller membranspenning ) er forskjellen i elektrisk potensial mellom det indre og ytre av en biologisk celle . For utsiden av cellen varierer typiske verdier for membranpotensial, normalt angitt i enheter på milli volt og angitt som mV, fra –40 mV til –80 mV.
Alle dyreceller er omgitt av en membran som består av et lipiddobbelt lag med proteiner innebygd i den. Membranen fungerer både som isolator og som diffusjonsbarriere for bevegelse av ioner . Transmembranproteiner , også kjent som ionetransportør eller ionepumpeproteiner , skyver ioner aktivt over membranen og etablerer konsentrasjonsgradienter over membranen, og ionekanaler lar ioner bevege seg over membranen nedover disse konsentrasjonsgradientene. Ionpumper og ionekanaler tilsvarer elektrisk sett et sett med batterier og motstander som er satt inn i membranen, og skaper derfor en spenning mellom membranens to sider.
Nesten alle plasmamembraner har et elektrisk potensial over seg, med innsiden vanligvis negativ med hensyn til utsiden. Membranpotensialet har to grunnleggende funksjoner. For det første lar den en celle fungere som et batteri, og gir strøm til å drive en rekke "molekylære enheter" innebygd i membranen. For det andre, i elektrisk exciterbare celler som nevroner og muskelceller , brukes den til å overføre signaler mellom forskjellige deler av en celle. Signaler genereres ved å åpne eller lukke ionekanaler på et tidspunkt i membranen, noe som gir en lokal endring i membranpotensialet. Denne endringen i det elektriske feltet kan kjennes raskt av enten tilstøtende eller mer fjerne ionekanaler i membranen. Disse ionekanalene kan deretter åpne eller lukke som et resultat av den potensielle endringen og reprodusere signalet.
I ikke-eksiterbare celler, og i eksitable celler i baseline-tilstandene, holdes membranpotensialet på en relativt stabil verdi, kalt hvilepotensialet . For nevroner varierer typiske verdier for hvilepotensialet fra –70 til –80 millivolt; det vil si at det indre av en celle har en negativ grunnlinjespenning på litt mindre enn en tidel av en volt. Åpning og lukking av ionekanaler kan forårsake en avvik fra hvilepotensialet. Dette kalles en depolarisering hvis den innvendige spenningen blir mindre negativ (si fra –70 mV til –60 mV), eller en hyperpolarisering hvis den innvendige spenningen blir mer negativ (si fra –70 mV til –80 mV). I eksiterende celler kan en tilstrekkelig stor depolarisering fremkalle et handlingspotensial , der membranpotensialet endres raskt og betydelig i kort tid (i størrelsesorden 1 til 100 millisekunder), og ofte reverserer polariteten. Handlingspotensialer genereres ved aktivering av visse spenningsstyrte ionekanaler .
I nevroner er faktorene som påvirker membranpotensialet forskjellige. De inkluderer mange typer ionekanaler, hvorav noen er kjemisk inngjerdet og noen som er spenningsstyrte. Fordi spenningsstyrte ionekanaler styres av membranpotensialet, mens membranpotensialet i seg selv påvirkes av de samme ionekanalene, oppstår tilbakemeldingsløkker som gir mulighet for kompleks tidsmessig dynamikk, inkludert oscillasjoner og regenerative hendelser som handlingspotensialer.
Fysisk grunnlag
Membranpotensialet i en celle stammer til syvende og sist fra to faktorer: elektrisk kraft og diffusjon. Elektrisk kraft oppstår fra den gjensidige tiltrekningen mellom partikler med motsatte elektriske ladninger (positive og negative) og gjensidig frastøtning mellom partikler med samme type ladning (både positive eller begge negative). Diffusjon oppstår fra den statistiske tendensen til partikler til å omfordele fra regioner der de er sterkt konsentrert til områder der konsentrasjonen er lav.
Spenning
Spenning, som er synonymt med forskjellen i elektrisk potensial , er evnen til å drive en elektrisk strøm over en motstand. Faktisk er den enkleste definisjonen av en spenning gitt av Ohms lov : V = IR, hvor V er spenning, I er strøm og R er motstand. Hvis en spenningskilde, for eksempel et batteri, er plassert i en elektrisk krets, jo høyere spenning til kilden, jo større mengde strøm vil den drive over den tilgjengelige motstanden. Den funksjonelle betydningen av spenning ligger bare i potensielle forskjeller mellom to punkter i en krets. Ideen om en spenning på et enkelt punkt er meningsløs. Det er vanlig innen elektronikk å tilordne en spenning på null til et vilkårlig valgt element i kretsen, og deretter tildele spenninger for andre elementer målt i forhold til det nullpunktet. Det er ingen betydning for hvilket element som er valgt som nullpunkt - funksjonen til en krets avhenger bare av forskjellene, ikke av spenninger i seg selv . I de fleste tilfeller og etter konvensjon er imidlertid nullnivået oftest tilordnet delen av en krets som er i kontakt med bakken.
Det samme prinsippet gjelder spenning i cellebiologi. I elektrisk aktivt vev kan potensialforskjellen mellom to punkter måles ved å sette inn en elektrode ved hvert punkt, for eksempel en inne i og en utenfor cellen, og koble begge elektrodene til ledningene til det som egentlig er et spesialisert voltmeter. Etter konvensjon tilordnes nullpotensialverdien utsiden av cellen, og tegnet på potensialforskjellen mellom utsiden og innsiden bestemmes av potensialet til innsiden i forhold til det ytre nullpunktet.
I matematiske termer begynner definisjonen av spenning med konseptet om et elektrisk felt E , et vektorfelt som tilordner en størrelse og retning til hvert punkt i rommet. I mange situasjoner er det elektriske felt en konservativ felt , noe som betyr at den kan bli uttrykt som gradienten av en skalar funksjon V , det vil si, E = -∇ V . Dette skalarfeltet V blir referert til som spenningsfordelingen. Legg merke til at definisjonen åpner for en vilkårlig integrasjonskonstant - det er derfor absolutte spenningsverdier ikke er meningsfulle. Generelt kan elektriske felt kun behandles som konservative hvis magnetfelt ikke påvirker dem vesentlig, men denne tilstanden gjelder vanligvis godt for biologisk vev.
Fordi det elektriske feltet er gradienten av spenningsfordelingen, innebærer raske endringer i spenning i et lite område et sterkt elektrisk felt; på motsatt side, hvis spenningen forblir omtrent den samme over et stort område, må de elektriske feltene i den regionen være svake. Et sterkt elektrisk felt, tilsvarende en sterk spenningsgradient, innebærer at det utøves en sterk kraft på alle ladede partikler som ligger i regionen.
Ioner og kreftene som driver bevegelsen

Elektriske signaler i biologiske organismer er generelt drevet av ioner . De viktigste kationene for handlingspotensialet er natrium (Na + ) og kalium (K + ). Begge disse er monovalente kationer som bærer en enkelt positiv ladning. Handlingspotensialer kan også involvere kalsium (Ca 2+ ), som er en divalent kation som bærer en dobbel positiv ladning. Den klorid -anion (Cl - ) spiller en viktig rolle i virkningspotensialer med en viss alger , men spiller en ubetydelig rolle i virkningspotensialer for de fleste dyr.
Ioner krysser cellemembranen under to påvirkninger: diffusjon og elektriske felt . Et enkelt eksempel der to løsninger - A og B - er atskilt med en porøs barriere, illustrerer at diffusjon vil sikre at de til slutt blandes til like løsninger. Denne blandingen skjer på grunn av forskjellen i konsentrasjonene. Regionen med høy konsentrasjon vil diffundere ut mot regionen med lav konsentrasjon. For å utvide eksemplet, la løsning A ha 30 natriumioner og 30 kloridioner. La også løsning B bare ha 20 natriumioner og 20 kloridioner. Forutsatt at barrieren tillater begge typer ioner å bevege seg gjennom den, da vil en stabil tilstand oppnås der begge løsningene har 25 natriumioner og 25 kloridioner. Hvis imidlertid den porøse barrieren er selektiv som ionene slippes gjennom, vil diffusjon alene ikke bestemme den resulterende løsningen. For å gå tilbake til forrige eksempel, la oss nå konstruere en barriere som bare er permeabel for natriumioner. Nå er det bare natrium som får diffundere kryss av barrieren fra den høyere konsentrasjonen i løsning A til den lavere konsentrasjonen i løsning B. Dette vil resultere i en større opphopning av natriumioner enn kloridioner i løsning B og et mindre antall natriumioner enn kloridioner i løsning A.
Dette betyr at det er en netto positiv ladning i løsning B fra den høyere konsentrasjonen av positivt ladede natriumioner enn negativt ladede kloridioner. På samme måte er det en netto negativ ladning i løsning A fra den større konsentrasjonen av negative kloridioner enn positive natriumioner. Siden motsatte ladninger tiltrekker og som ladninger frastøter, påvirkes ionene nå også av elektriske felt så vel som diffusjonskrefter. Derfor vil positive natriumioner være mindre sannsynlig å reise til den nå-mer-positive B-løsningen og forbli i den nå-mer-negative A-løsningen. Punktet der kreftene til de elektriske feltene motvirker kraften på grunn av diffusjon fullstendig, kalles likevektspotensialet. På dette tidspunktet er nettostrømmen til det spesifikke ionet (i dette tilfellet natrium) null.
Plasmamembraner

Hver celle er innelukket i en plasmamembran , som har strukturen til et lipiddobbelt lag med mange typer store molekyler innebygd i den. Fordi den er laget av lipidmolekyler, har plasmamembranen iboende en høy elektrisk resistivitet, med andre ord en lav iboende permeabilitet for ioner. Imidlertid er noen av molekylene som er innebygd i membranen i stand til enten aktivt å transportere ioner fra den ene siden av membranen til den andre eller tilveiebringe kanaler som de kan bevege seg gjennom.
I elektrisk terminologi fungerer plasmamembranen som en kombinert motstand og kondensator . Motstand oppstår fra det faktum at membranen hindrer bevegelsen av ladninger over den. Kapasitans oppstår fra det faktum at lipiddobbeltlaget er så tynt at en opphopning av ladede partikler på den ene siden gir opphav til en elektrisk kraft som trekker motsatt ladede partikler mot den andre siden. Kapasitansen til membranen er relativt upåvirket av molekylene som er innebygd i den, så den har en mer eller mindre invariant verdi estimert til omtrent 2 μF/cm 2 (den totale kapasitansen til en membranlapp er proporsjonal med arealet). Konduktansen til et rent lipiddobbelt lag er derimot så lavt at den i biologiske situasjoner alltid domineres av konduktansen til alternative veier levert av innebygde molekyler. Dermed er membranens kapasitans mer eller mindre fast, men motstanden er svært variabel.
Tykkelsen på en plasmamembran er estimert til å være omtrent 7-8 nanometer. Fordi membranen er så tynn, trenger det ikke en veldig stor transmembranspenning for å skape et sterkt elektrisk felt i den. Typiske membranpotensialer i dyreceller er i størrelsesorden 100 millivolt (det vil si en tidel av en volt), men beregninger viser at dette genererer et elektrisk felt nær det maksimale som membranen kan opprettholde - det er beregnet at en spenning forskjell mye større enn 200 millivolt kan forårsake dielektrisk nedbrytning , det vil si bue over membranen.
Tilrettelagt diffusjon og transport

Motstanden til et rent lipiddobbelt lag mot ioners passasje over den er veldig høy, men strukturer som er innebygd i membranen kan i stor grad forbedre ionebevegelsen, enten aktivt eller passivt , via mekanismer som kalles lettere transport og lettere diffusjon . De to typene struktur som spiller de største rollene er ionekanaler og ionepumper , begge vanligvis dannet av sammensetninger av proteinmolekyler. Ionkanaler gir passasjer som ioner kan bevege seg gjennom. I de fleste tilfeller er en ionekanal bare permeabel for bestemte typer ioner (for eksempel natrium og kalium, men ikke klorid eller kalsium), og noen ganger varierer permeabiliteten avhengig av ionebevægelsesretningen. Ionpumper, også kjent som ionetransportører eller bærerproteiner, transporterer aktivt bestemte typer ioner fra den ene siden av membranen til den andre, noen ganger ved å bruke energi som stammer fra metabolske prosesser for å gjøre det.
Ionpumper
Ionpumper er integrerte membranproteiner som utfører aktiv transport , dvs. bruker cellulær energi (ATP) til å "pumpe" ionene mot konsentrasjonsgradienten. Slike ionepumper tar inn ioner fra den ene siden av membranen (reduserer konsentrasjonen der) og slipper dem på den andre siden (øker konsentrasjonen der).
Ionpumpen som er mest relevant for handlingspotensialet er natrium-kaliumpumpen , som transporterer tre natriumioner ut av cellen og to kaliumioner. Som en konsekvens er konsentrasjonen av kaliumioner K + inne i nevronet omtrent 20 ganger større enn den ytre konsentrasjonen, mens natriumkonsentrasjonen utenfor er omtrent ni ganger større enn innsiden. På lignende måte har andre ioner forskjellige konsentrasjoner i og utenfor nevronet, for eksempel kalsium , klorid og magnesium .
Hvis tallene for hver ionetype var like, ville natrium-kaliumpumpen være elektrisk nøytral, men på grunn av tre-til-to-utvekslingen gir den en netto bevegelse på én positiv ladning fra intracellulær til ekstracellulær for hver syklus, og bidrar dermed til en positiv spenningsforskjell. Pumpen har tre effekter: (1) den gjør natriumkonsentrasjonen høy i det ekstracellulære rommet og lavt i det intracellulære rommet; (2) det gjør kaliumkonsentrasjonen høy i det intracellulære rommet og lavt i det ekstracellulære rommet; (3) det gir det intracellulære rommet en negativ spenning med hensyn til det ekstracellulære rommet.
Natrium-kaliumpumpen er relativt treg i drift. Hvis en celle ble initialisert med like konsentrasjoner av natrium og kalium overalt, ville det ta timer før pumpen etablerte likevekt. Pumpen opererer konstant, men blir gradvis mindre effektiv ettersom konsentrasjonene av natrium og kalium tilgjengelig for pumping reduseres.
Ionpumper påvirker aksjonspotensialet bare ved å etablere det relative forholdet mellom intracellulære og ekstracellulære ionekonsentrasjoner. Handlingspotensialet innebærer hovedsakelig åpning og lukking av ionekanaler, ikke ionepumper. Hvis ionepumpene slås av ved å fjerne energikilden, eller ved å legge til en hemmer som ouabain , kan aksonet fortsatt skyte hundretusenvis av aksjonspotensialer før amplituder begynner å falle betydelig. Spesielt spiller ionepumper ingen vesentlig rolle i repolarisasjonen av membranen etter et handlingspotensial.
En annen funksjonell ionepumpe er natrium-kalsiumveksleren . Denne pumpen fungerer på en konseptuelt lik måte som natrium-kaliumpumpen, bortsett fra at den i hver syklus bytter ut tre Na + fra det ekstracellulære rommet med ett Ca ++ fra det intracellulære rommet. Fordi nettostrømmen er innover, går denne pumpen "nedoverbakke", og krever derfor ingen energikilde bortsett fra membranspenningen. Den viktigste effekten er å pumpe kalsium utover-det tillater også en innadstrømning av natrium, og derved motvirke natrium-kaliumpumpen, men fordi den totale natrium- og kaliumkonsentrasjonen er mye høyere enn kalsiumkonsentrasjonene, er denne effekten relativt uviktig. Nettoresultatet av natrium-kalsiumveksleren er at intracellulære kalsiumkonsentrasjoner i hviletilstand blir svært lave.
Ionkanaler
Ionkanaler er integrerte membranproteiner med en pore gjennom hvilken ioner kan bevege seg mellom ekstracellulært rom og celleinteriør. De fleste kanaler er spesifikke (selektive) for ett ion; for eksempel er de fleste kaliumkanaler preget av 1000: 1 selektivitetsforhold for kalium over natrium, selv om kalium- og natriumioner har samme ladning og avviker bare litt i radius. Kanalporene er vanligvis så små at ioner må passere gjennom den i enkeltfilrekkefølge. Kanalporer kan enten være åpne eller lukkede for ionepassasje, selv om en rekke kanaler viser forskjellige sub-konduktansnivåer. Når en kanal er åpen, penetrerer ioner gjennom kanalen nedover transmembrankonsentrasjonsgradienten for det bestemte ionet. Den ioniske strømningshastigheten gjennom kanalen, det vil si enkeltkanals strømamplitude, bestemmes av maksimal kanalkonduktans og elektrokjemisk drivkraft for det ionet, som er forskjellen mellom den umiddelbare verdien av membranpotensialet og verdien av reverseringspotensialet .
En kanal kan ha flere forskjellige tilstander (tilsvarende forskjellige konformasjoner av proteinet), men hver slik tilstand er enten åpen eller lukket. Generelt tilsvarer lukkede tilstander enten en sammentrekning av poren - noe som gjør den ufremkommelig for ionet - eller en separat del av proteinet, som stopper poren. For eksempel gjennomgår den spenningsavhengige natriumkanalen inaktivering , der en del av proteinet svinger inn i porene og forsegler det. Denne inaktiveringen slår av natriumstrømmen og spiller en kritisk rolle i handlingspotensialet.
Ionkanaler kan klassifiseres etter hvordan de reagerer på miljøet. For eksempel er ionekanalene involvert i handlingspotensialet spenningssensitive kanaler ; de åpner og lukker som svar på spenningen over membranen. Ligand-gated kanaler danner en annen viktig klasse; disse ionekanalene åpnes og lukkes som svar på bindingen av et ligandmolekyl , for eksempel en nevrotransmitter . Andre ionekanaler åpnes og lukkes med mekaniske krefter. Fortsatt andre ionekanaler - som for sensoriske nevroner - åpner og lukker som svar på andre stimuli, for eksempel lys, temperatur eller trykk.
Lekkasjekanaler
Lekkasjekanaler er den enkleste typen ionekanal, ved at deres permeabilitet er mer eller mindre konstant. Typer lekkasjekanaler som har størst betydning i nevroner er kalium- og kloridkanaler. Selv disse er ikke helt konstante i sine egenskaper: For det første er de fleste av dem spenningsavhengige i den forstand at de leder bedre i den ene retningen enn den andre (med andre ord, de er likerettere ); For det andre er noen av dem i stand til å bli stengt av kjemiske ligander, selv om de ikke krever ligander for å fungere.
Ligand-gated kanaler
Ligand-gated ion-kanaler er kanaler hvis permeabilitet er sterkt økt når noen form for kjemisk ligand binder seg til proteinstrukturen. Dyreceller inneholder hundrevis, om ikke tusenvis av typer av disse. En stor delmengde fungerer som nevrotransmitterreseptorer - de forekommer på postsynaptiske steder, og den kjemiske liganden som porter dem frigjøres av den presynaptiske axonterminalen . Et eksempel på denne typen er AMPA -reseptoren , en reseptor for nevrotransmitteren glutamat som ved aktivering tillater passering av natrium- og kaliumioner. Et annet eksempel er GABA A -reseptoren , en reseptor for nevrotransmitteren GABA som ved aktivering tillater passering av kloridioner.
Neurotransmitterreseptorer aktiveres av ligander som vises i det ekstracellulære området, men det er andre typer ligandgaterte kanaler som styres av interaksjoner på den intracellulære siden.
Spenningsavhengige kanaler
Spenningsstyrte ionekanaler , også kjent som spenningsavhengige ionekanaler , er kanaler hvis permeabilitet påvirkes av membranpotensialet. De danner en annen veldig stor gruppe, hvor hvert medlem har en spesiell ionselektivitet og en spesiell spenningsavhengighet. Mange er også tidsavhengige-med andre ord, de reagerer ikke umiddelbart på en spenningsendring, men bare etter en forsinkelse.
Et av de viktigste medlemmene i denne gruppen er en type spenningsstyrt natriumkanal som ligger til grunn for handlingspotensialer-disse kalles noen ganger Hodgkin-Huxley natriumkanaler fordi de opprinnelig ble preget av Alan Lloyd Hodgkin og Andrew Huxley i sin nobelprisvinnende studier av fysiologien til handlingspotensialet. Kanalen er stengt ved hvilespenningsnivået, men åpner brått når spenningen overskrider en viss terskel, noe som tillater en stor tilstrømning av natriumioner som gir en veldig rask endring i membranpotensialet. Gjenoppretting fra et handlingspotensial er delvis avhengig av en type spenningsstyrt kaliumkanal som er lukket ved hvilespenningsnivået, men åpnes som en konsekvens av den store spenningsendringen som produseres under handlingspotensialet.
Reverseringspotensial
Den reversering potensial (eller likevektspotensialet ) av et ion er verdien av spenningen over membranen ved hvilken diffusiv og elektriske krefter motvekt, slik at det ikke er noen netto ionestrøm gjennom membranen. Dette betyr at transmembranspenningen nøyaktig er imot diffusjonskraften til ionet, slik at nettstrømmen til ionet over membranen er null og uforanderlig. Omvendingspotensialet er viktig fordi det gir spenningen som virker på kanaler som er gjennomtrengelige for det ionet - med andre ord gir det spenningen som ionekonsentrasjonsgradienten genererer når den fungerer som et batteri .
Likevektspotensialet til et bestemt ion er vanligvis angitt med notasjonen E -ion . Likevektspotensialet for et hvilket som helst ion kan beregnes ved hjelp av Nernst -ligningen . For eksempel vil reverseringspotensialet for kaliumioner være som følger:
hvor
- E eq, K + er likevektspotensialet for kalium, målt i volt
- R er den universelle gasskonstanten , lik 8,314 joule · K −1 · mol −1
- T er den absolutte temperaturen målt i kelvin (= K = grader Celsius + 273,15)
- z er antall elementære ladninger for det aktuelle ionet som er involvert i reaksjonen
- F er Faradays konstant , lik 96,485 coulomb · mol -1 eller J · V -1 · mol -1
- [K + ] o er den ekstracellulære konsentrasjonen av kalium, målt i mol · m −3 eller mmol·l −1
- [K + ] i er den intracellulære konsentrasjonen av kalium
Selv om to forskjellige ioner har samme ladning (dvs. K + og Na + ), kan de fortsatt ha svært forskjellige likevektspotensialer, forutsatt at konsentrasjonene ute og/eller innvendig er forskjellige. Ta for eksempel likevektspotensialene til kalium og natrium i nevroner. Kalium -likevektspotensialet E K er -84 mV med 5 mM kalium ute og 140 mM inne. På den annen side er natrium -likevektspotensialet, E Na , omtrent +66 mV med omtrent 12 mM natrium inne og 140 mM utenfor.
Endringer i membranpotensial under utvikling
Et neurons hvilemembranpotensial endres faktisk under utviklingen av en organisme. For at et nevron til slutt skal kunne adoptere sin fulle voksenfunksjon, må potensialet være tett regulert under utviklingen. Når en organisme utvikler seg gjennom utvikling, blir hvilemembranpotensialet mer negativt. Glialceller differensierer og formerer seg også etter hvert som utviklingen utvikler seg i hjernen . Tilsetningen av disse glialcellene øker organismens evne til å regulere ekstracellulært kalium . Fallet i ekstracellulært kalium kan føre til en nedgang i membranpotensial på 35 mV.
Celle -eksitabilitet
Celle -eksitabilitet er endringen i membranpotensial som er nødvendig for cellulære responser i forskjellige vev. Celleeksitabilitet er en egenskap som induseres under tidlig embryogenese. Spenning av en celle har også blitt definert som den enkle reaksjonen som kan utløses. Hvile- og terskelpotensialene danner grunnlaget for celleopphisselse, og disse prosessene er grunnleggende for generering av graderte og handlingspotensialer.
De viktigste regulatorene for celleeksitabilitet er de ekstracellulære elektrolyttkonsentrasjonene (dvs. Na + , K + , Ca 2+ , Cl - , Mg 2+ ) og tilhørende proteiner. Viktige proteiner som regulerer celleeksitabilitet er spenningsgaterte ionekanaler , ionetransportører (f.eks. Na+/K+-ATPase , magnesiumtransportører , syre-basetransportører ), membranreseptorer og hyperpolarisasjonsaktiverte syklisk-nukleotid-gatede kanaler . For eksempel er kaliumkanaler og kalsiumfølende reseptorer viktige regulatorer for eksitabilitet i nevroner , hjertemyocytter og mange andre eksitable celler som astrocytter . Kalsiumion er også den viktigste andre messenger i eksitabel cellesignalering . Aktivering av synaptiske reseptorer initierer langvarige endringer i neuronal eksitabilitet. Skjoldbruskkjertelen , binyrene og andre hormoner regulerer også celle -eksitabilitet, for eksempel modulerer progesteron og østrogen myometriell glattmuskelcelle -eksitabilitet.
Mange celletyper anses å ha en eksitabel membran. Spennende celler er nevroner, myocytter (hjerte, skjelett, glatte ), vaskulære endotelceller , pericytter , juxtaglomerulære celler , interstitielle celler i Cajal , mange typer epitelceller (f.eks. Betaceller , alfaceller , deltaceller , enteroendokrine celler , pulmonale nevroendokrine celler , pinealocytes ), gliale celler (f.eks astrocytter), mechanoreceptor celler (f.eks hårceller og Merkel celler ), chemoreceptor celler (f.eks glomus celler , smaksreseptorer ), visse planteceller og muligens immunceller . Astrocytter viser en form for ikke-elektrisk eksitabilitet basert på intracellulære kalsiumvariasjoner relatert til uttrykk for flere reseptorer som de kan detektere det synaptiske signalet. I nevroner er det forskjellige membranegenskaper i noen deler av cellen, for eksempel gir dendrittisk eksitabilitet nevroner kapasitet til tilfeldighetsdeteksjon av romlig adskilte innganger.
Tilsvarende krets
Elektrofysiologer modellerer effekten av ioniske konsentrasjonsforskjeller, ionekanaler og membrankapasitans når det gjelder en ekvivalent krets , som er ment å representere de elektriske egenskapene til en liten membranlapp. Den tilsvarende kretsen består av en kondensator parallelt med fire baner som hver består av et batteri i serie med variabel konduktans. Kapasitansen bestemmes av egenskapene til lipiddobbeltlaget, og må tas i bruk. Hver av de fire parallelle veiene kommer fra en av hovedionene, natrium, kalium, klorid og kalsium. Spenningen til hver ionebane bestemmes av ionets konsentrasjoner på hver side av membranen; se avsnittet om tilbakeføring av potensialet ovenfor. Ledningsevnen til hver ionebane på et hvilket som helst tidspunkt bestemmes av tilstandene til alle ionekanalene som potensielt er gjennomtrengelige for det ionet, inkludert lekkasjekanaler, ligand-gated kanaler og spenningsgatede ion-kanaler.

For faste ionekonsentrasjoner og faste verdier for ionekanalkonduktans kan ekvivalentkretsen ytterligere reduseres ved bruk av Goldman -ligningen som beskrevet nedenfor til en krets som inneholder en kapasitans parallelt med et batteri og konduktans. I elektriske termer er dette en type RC-krets (motstand-kapasitans-krets), og dens elektriske egenskaper er veldig enkle. Fra en hvilken som helst starttilstand faller strømmen som flyter over konduktansen eller kapasitansen med et eksponentielt tidsforløp, med en tidskonstant på τ = RC , hvor C er kapasitansen til membranplasteret, og R = 1/g nett er netto motstand. For realistiske situasjoner ligger tidskonstanten vanligvis i området 1-100 millisekunder. I de fleste tilfeller skjer endringer i konduktansen til ionekanaler på en raskere tidsskala, så en RC -krets er ikke en god tilnærming; differensialligningen som brukes til å modellere en membranplaster er imidlertid vanligvis en modifisert versjon av RC -kretsligningen.
Hvilepotensial
Når membranpotensialet til en celle går over lang tid uten å endre seg nevneverdig, blir det referert til som et hvilepotensial eller hvilespenning. Dette uttrykket brukes om membranpotensialet til ikke-eksitable celler, men også om membranpotensialet til eksitable celler i fravær av eksitasjon. I eksiterbare celler er de andre mulige tilstandene graderte membranpotensialer (med variabel amplitude), og handlingspotensialer, som er store, alt-eller-ingenting stiger i membranpotensial som vanligvis følger et bestemt tidsforløp. Spennende celler inkluderer nevroner , muskelceller og noen sekretoriske celler i kjertler . Selv i andre celletyper kan membranspenningen imidlertid gjennomgå endringer som reaksjon på miljømessige eller intracellulære stimuli. For eksempel ser det ut til at depolarisering av plasmamembranen er et viktig trinn i programmert celledød .
Interaksjonene som genererer hvilepotensialet er modellert av Goldman -ligningen . Dette ligner i form på Nernst -ligningen vist ovenfor, ved at den er basert på ladningene til de aktuelle ionene, så vel som forskjellen mellom konsentrasjonene inne og ute. Imidlertid tar det også hensyn til plasmamembranens relative permeabilitet for hvert ion.
De tre ionene som vises i denne ligningen er kalium (K + ), natrium (Na + ) og klorid (Cl - ). Kalsium er utelatt, men kan tilsettes for å håndtere situasjoner der det spiller en vesentlig rolle. Som en anion blir kloridbetingelsene behandlet annerledes enn kationbetingelsene; den intracellulære konsentrasjonen er i telleren, og den ekstracellulære konsentrasjonen i nevneren, som er reversert fra kationbegrepene. P i står for den relative permeabiliteten til ionetypen i.
I hovedsak uttrykker Goldman -formelen membranpotensialet som et veid gjennomsnitt av reverseringspotensialene for de enkelte ionetyper, vektet med permeabilitet. (Selv om membranpotensialet endrer seg omtrent 100 mV under et handlingspotensial, endres ikke konsentrasjonene av ioner i og utenfor cellen vesentlig. De forblir nær sine respektive konsentrasjoner når membranen er i hvilepotensial.) I de fleste dyreceller er permeabilitet for kalium er mye høyere i hviletilstand enn permeabiliteten for natrium. Som en konsekvens er hvilepotensialet vanligvis nær kalium -reverseringspotensialet. Permeabiliteten for klorid kan være høy nok til å være signifikant, men i motsetning til de andre ionene pumpes ikke klorid aktivt, og ekvilibrerer derfor med et reverseringspotensial veldig nær hvilepotensialet bestemt av de andre ionene.
Verdier av hvilemembranpotensial i de fleste dyreceller varierer vanligvis mellom kalium reverseringspotensial (vanligvis rundt -80 mV) og rundt -40 mV. Hvilepotensialet i eksitable celler (i stand til å produsere handlingspotensialer) er vanligvis nær -60 mV -mer depolariserte spenninger ville føre til spontan generering av handlingspotensialer. Umodne eller udifferensierte celler viser svært varierende verdier for hvilespenning, vanligvis betydelig mer positive enn i differensierte celler. I slike celler korrelerer hvilepotensialverdien med differensieringsgraden: udifferensierte celler viser i noen tilfeller ikke noen transmembranspenningsforskjell i det hele tatt.
Vedlikehold av hvilepotensialet kan være metabolsk kostbart for en celle på grunn av kravet til aktiv pumping av ioner for å motvirke tap på grunn av lekkasjekanaler. Kostnaden er høyest når cellefunksjonen krever en spesielt depolarisert verdi av membranspenning. For eksempel kan hvilepotensialet i dagslys -tilpasset blåsefugl ( Calliphora vicina ) fotoreseptorer være så høyt som -30 mV. Dette forhøyede membranpotensialet gjør at cellene kan reagere veldig raskt på visuelle innganger; kostnaden er at vedlikehold av hvilepotensialet kan forbruke mer enn 20% av den totale cellulære ATP .
På den annen side medfører det høye hvilepotensialet i udifferensierte celler ikke nødvendigvis høye metabolske kostnader. Dette tilsynelatende paradokset løses ved å undersøke opprinnelsen til hvilepotensialet. Små differensierte celler er preget av ekstremt høy inngangsmotstand, noe som innebærer at få lekkasjekanaler er til stede på dette stadiet av cellelivet. Som et tydelig resultat blir kaliumpermeabilitet lik den for natriumioner, noe som plasserer hvilepotensial mellom reverseringspotensialene for natrium og kalium som diskutert ovenfor. De reduserte lekkasjestrømmene betyr også at det er lite behov for aktiv pumping for å kompensere, derfor lave metabolske kostnader.
Gradert potensial
Som forklart ovenfor, bestemmes potensialet på et hvilket som helst tidspunkt i cellens membran av ionekonsentrasjonforskjellene mellom de intracellulære og ekstracellulære områdene, og av membranens permeabilitet for hver type ion. Ionkonsentrasjonene endres normalt ikke veldig raskt (med unntak av Ca 2+ , der baseline intracellulær konsentrasjon er så lav at selv en liten tilstrømning kan øke den med størrelsesordener), men permeabiliteten til ionene kan endres i en brøkdel av et millisekund, som et resultat av aktivering av ligandgaterte ionekanaler. Endringen i membranpotensialet kan være enten stor eller liten, avhengig av hvor mange ionekanaler som er aktivert og hvilken type de er, og kan være enten lang eller kort, avhengig av hvor lenge kanalene forblir åpne. Endringer av denne typen omtales som graderte potensialer , i motsetning til handlingspotensialer, som har en fast amplitude og tidsforløp.
Som det kan utledes av Goldman -ligningen vist ovenfor, forskyver effekten av å øke permeabiliteten til en membran til en bestemt type ion membranpotensialet mot reverseringspotensialet for det ionet. Dermed forskyver åpning av Na + -kanaler membranpotensialet mot Na + reverseringspotensialet, som vanligvis er rundt +100 mV. På samme måte forskyver åpning av K + -kanaler membranpotensialet mot omtrent –90 mV, og åpning av Cl - kanaler forskyver det mot cirka –70 mV (hvilepotensial for de fleste membraner). Dermed forskyver Na + -kanaler membranpotensialet i en positiv retning, K + -kanaler forskyver det i en negativ retning (unntatt når membranen hyperpolariseres til en verdi som er mer negativ enn K + reverseringspotensialet), og Cl - kanaler har en tendens til å skifte det mot hvilepotensialet.
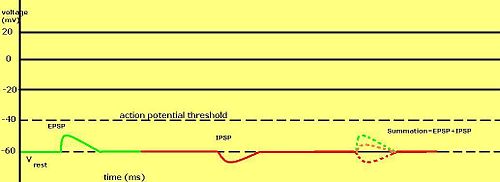
Gradert membranpotensial er spesielt viktig i nevroner , der de produseres av synapser - en midlertidig endring i membranpotensialet produsert ved aktivering av en synapse av et enkelt gradert eller handlingspotensial kalles et postsynaptisk potensial . Nevrotransmittere som virker for å åpne Na + -kanaler får vanligvis membranpotensialet til å bli mer positivt, mens nevrotransmittere som aktiverer K + -kanaler vanligvis får det til å bli mer negativt; de som hemmer disse kanalene har en tendens til å ha motsatt effekt.
Hvorvidt et postsynaptisk potensial anses som eksitatorisk eller hemmende, avhenger av reverseringspotensialet for ionene i den aktuelle strømmen, og terskelen for cellen til å skyte et handlingspotensial (rundt –50mV). En postsynaptisk strøm med et reverseringspotensial over terskel, for eksempel en typisk Na + -strøm, regnes som eksitatorisk. En strøm med et reverseringspotensial under terskel, for eksempel en typisk K + -strøm, regnes som hemmende. En strøm med et reverseringspotensial over hvilepotensialet, men under terskelen, vil ikke i seg selv fremkalle handlingspotensialer, men vil produsere subterskelmembranpotensialoscillasjoner . Således produserer nevrotransmittere som virker for å åpne Na + -kanaler eksitatoriske postsynaptiske potensialer , eller EPSP, mens nevrotransmittere som virker for å åpne K + eller Cl - kanaler vanligvis produserer hemmende postsynaptiske potensialer , eller IPSP. Når flere typer kanaler er åpne i samme tidsperiode, summeres deres postsynaptiske potensialer (legges sammen).
Andre verdier
Fra synspunktet til biofysikken, den hvil er membranpotensialet bare membranpotensialet som resulterer fra membran permeabiliteter som dominerer når cellen hviler. Ovenstående ligning for veide gjennomsnitt gjelder alltid, men følgende tilnærming kan lettere visualiseres. Til enhver tid er det to faktorer for et ion som bestemmer hvor stor innflytelse det ionet vil ha på cellens membranpotensial:
- Det ionet er drivkraften
- Det ionets permeabilitet
Hvis drivkraften er høy, blir ionet "dyttet" over membranen. Hvis permeabiliteten er høy, vil det være lettere for ionet å diffundere over membranen.
- Drivkraft er den elektriske netto kraften som er tilgjengelig for å flytte det ionet over membranen. Det beregnes som forskjellen mellom spenningen som ionet "ønsker" å være ved (dets likevektspotensial) og det faktiske membranpotensialet ( E m ). Så formelt sett er drivkraften for et ion = E m - E ion
- For eksempel, ved vårt tidligere beregnede hvilepotensial på −73 mV, er drivkraften på kalium 7 mV: (−73 mV) - (−80 mV) = 7 mV. Drivkraften på natrium vil være (−73 mV) - (60 mV) = −133 mV.
- Permeabilitet er et mål på hvor lett et ion kan krysse membranen. Det måles vanligvis som (elektrisk) konduktans og enheten, siemens , tilsvarer 1 C · s −1 · V −1 , det vil si én coulomb per sekund per volt potensial.
Så, i en hvilemembran, mens drivkraften for kalium er lav, er dens permeabilitet veldig høy. Natrium har en enorm drivkraft, men nesten ingen hvilepermeabilitet. I dette tilfelle bærer kalium omtrent 20 ganger mer strøm enn natrium, og har således 20 ganger større innflytelse E m enn det natrium.
Vurder imidlertid en annen sak - toppen av handlingspotensialet. Her er permeabiliteten til Na høy og K permeabiliteten relativt lav. Således membran beveger seg til i nærheten av E Na og langt fra E K .
Jo flere ioner som er gjennomtrengelige, jo mer komplisert blir det å forutsi membranpotensialet. Imidlertid kan dette gjøres ved å bruke Goldman-Hodgkin-Katz-ligningen eller den vektede middellikningen. Ved å plugge inn konsentrasjonsgradientene og permeabilitetene til ionene når som helst, kan man bestemme membranpotensialet i det øyeblikket. Hva GHK -ligningene betyr er at verdien til membranpotensialet når som helst vil være et veid gjennomsnitt av likevektspotensialene til alle permeantioner. "Vektingen" er ionenes relative permeabilitet over membranen.
Effekter og implikasjoner
Mens celler bruker energi på å transportere ioner og etablere et transmembranpotensial, bruker de dette potensialet i sin tur til å transportere andre ioner og metabolitter som sukker. Mitokondriens transmembranpotensial driver produksjonen av ATP , som er den vanlige valutaen for biologisk energi.
Celler kan dra nytte av energien de lagrer i hvilepotensialet for å drive handlingspotensialer eller andre former for eksitasjon. Disse endringene i membranpotensialet muliggjør kommunikasjon med andre celler (som med handlingspotensialer) eller initierer endringer inne i cellen, som skjer i et egg når det blir befruktet av en sæd .
I nevronceller begynner et handlingspotensial med et rush av natriumioner inn i cellen gjennom natriumkanaler, noe som resulterer i depolarisering, mens utvinning innebærer et utadstrømming av kalium gjennom kaliumkanaler. Begge disse fluksene oppstår ved passiv diffusjon .
Se også
- Bioelektrokjemi
- Elektrokjemisk potensial
- Goldman ligning
- Membranbiofysikk
- Mikroelektrodearray
- Saltatorisk ledning
- Overflate potensial
- Gibbs – Donnan -effekt
- Synaptisk potensial
Merknader
- ^ Legg merke til at tegnene på E Na og E K er motsatte. Dette er fordi konsentrasjonsgradienten for kalium ledes ut av cellen, mens konsentrasjonsgradienten for natrium rettes inn i cellen. Membranpotensialer er definert i forhold til utsiden av cellen; Dermed innebærer et potensial på -70 mV at det indre av cellen er negativt i forhold til utsiden.
Referanser
Videre lesning
- Alberts et al. Molekylærbiologi av cellen . Garland Publishing; 4. Bk & Cdr -utgave (mars, 2002). ISBN 0-8153-3218-1 . Bachelor nivå.
- Guyton, Arthur C., John E. Hall. Lærebok for medisinsk fysiologi . WB Saunders Company; 10. utgave (15. august 2000). ISBN 0-7216-8677-X . Bachelor nivå.
- Hille, B. Ionic Channel of Excitable Membranes Sinauer Associates, Sunderland, MA, USA; 1. utgave, 1984. ISBN 0-87893-322-0
- Nicholls, JG, Martin, AR og Wallace, BG From Neuron to Brain Sinauer Associates, Inc. Sunderland, MA, USA 3. utgave, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Biologiske membraner: Transportteori, potensialer og elektriske impulser . Cambridge University Press (26. september 2002). ISBN 0-521-81018-3 . Utdanningsnivå.
- National Medical Series for Independent Study. Fysiologi . Lippincott Williams & Wilkins. Philadelphia, PA, USA 4. utgave, 2001. ISBN 0-683-30603-0






![E_ {eq, K^+} = \ frac {RT} {zF} \ ln \ frac {[K^+] _ {o}} {[K^+] _ {i}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_ {m} = \ frac {RT} {F} \ ln {\ venstre (\ frac {P _ {\ mathrm {K}} [\ mathrm {K}^{ +}] _ \ mathrm {out} + P_ { \ mathrm {Na}} [\ mathrm {Na}^{ +}] _ \ mathrm {out} + P _ {\ mathrm {Cl}} [\ mathrm {Cl}^{-}] _ \ mathrm {in}} {P _ {\ mathrm {K}} [\ mathrm {K}^{+}] _ \ mathrm {in}+P _ {\ mathrm {Na}} [\ mathrm {Na}^{+}] _ \ mathrm { in} + P _ {\ mathrm {Cl}} [\ mathrm {Cl}^{-}] _ \ mathrm {out}} \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)