Sirkulært kromosom - Circular chromosome
Et sirkulært kromosom er et kromosom i bakterier , archaea , mitokondrier og kloroplaster , i form av et molekyl av sirkulært DNA, i motsetning til det lineære kromosomet for de fleste eukaryoter .
De fleste prokaryote kromosomer inneholder et sirkulært DNA -molekyl - det er ingen frie ender til DNA . Frie ender ville ellers skape betydelige utfordringer for cellene med hensyn til DNA -replikasjon og stabilitet. Celler som inneholder kromosomer med DNA -ender, eller telomerer (de fleste eukaryoter), har fått omfattende mekanismer for å overvinne disse utfordringene. Imidlertid kan et sirkulært kromosom gi andre utfordringer for celler. Etter replikering kan de to avkomssirkulære kromosomene noen ganger forbli sammenkoblede eller sammenfiltrede, og de må løses slik at hver celle arver en komplett kopi av kromosomet under celledeling .
Replikering
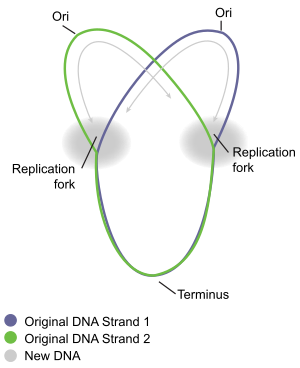
Den sirkulære bakteriekromosomreplikasjonen forstås best hos de godt studerte bakteriene Escherichia coli og Bacillus subtilis . Kromosomreplikasjon foregår i tre hovedfaser: initiering, forlengelse og avslutning. Startfasen starter med den ordnede sammensetningen av "initiator" -proteiner ved kromosomets opprinnelsesområde, kalt oriC . Disse samlingstrinnene er regulert for å sikre at kromosomreplikasjon bare skjer en gang i hver cellesyklus. Under forlengelsesfasen av replikasjonen fortsetter enzymene som ble samlet ved oriC under initiering langs hver arm (" replikor ") av kromosomet, i motsatte retninger vekk fra oriC, og replikerte DNA for å lage to identiske kopier. Denne prosessen er kjent som toveis replikasjon. Hele sammensetningen av molekyler som er involvert i DNA -replikasjon på hver arm kalles et " replikom ". I spissen for replikomet er en DNA -helikase som avvikler de to DNA -strengene og skaper en bevegelig " replikasjonsgaffel ". De to avviklede enkeltstrengene av DNA fungerer som maler for DNA -polymerase , som beveger seg med helikasen (sammen med andre proteiner) for å syntetisere en komplementær kopi av hver streng. På denne måten opprettes to identiske kopier av det originale DNA. Etter hvert møtes de to replikasjonsgaflene som beveger seg rundt det sirkulære kromosomet i en bestemt sone av kromosomet, omtrent motsatt oriC, kalt endestasjonen. Forlengelsesenzymer demonteres deretter, og de to "datter" -kromosomene løses før celledeling er fullført.
Initiering
Den E. coli bakterielle replikasjonsorigo, kalt oriC består av DNA-sekvenser som gjenkjennes av den DnaA protein, som er sterkt konservert blant forskjellige bakteriearter. DnaA -binding til opprinnelsen starter den regulerte rekrutteringen av andre enzymer og proteiner som til slutt vil føre til etablering av to komplette replikomer for toveis replikasjon.
DNA-sekvenselementer i ori C som er viktige for dets funksjon inkluderer DnaA-bokser, en 9-mer-repetisjon med en svært konservert konsensus-sekvens 5 '-TTATCCACA-3', som gjenkjennes av DnaA-proteinet. DnaA -protein spiller en avgjørende rolle i starten av kromosomal DNA -replikasjon. Bundet til ATP, og ved hjelp av bakterielle histonlignende proteiner [HU] DnaA spoler deretter en AT-rik region nær venstre grense til oriC , som bærer tre 13-mer-motiver, og åpner det dobbeltstrengede DNA for inngang av andre replikasjonsproteiner.
Denne regionen inneholder også fire "GATC" -sekvenser som gjenkjennes av DNA -adeninmetylase (Dam), et enzym som modifiserer adeninbasen når denne sekvensen er umetylert eller hemimetylert. Den metylering av adeniner er viktig som det endrer konformasjonen av DNA for å fremme kjedeseparasjon, og det viser seg at denne regionen av ori C har en naturlig tendens til å slappe av.
DnaA rekrutterer deretter den replikative helikasen , DnaB , fra DnaB-DnaC-komplekset til avviklet region for å danne pre-priming-komplekset. Etter at DnaB translokerer til toppen av hver replikasjonsgaffel, vikler helikasen både foreldrenes DNA og samhandler øyeblikkelig med primase .
For at DNA-replikasjon skal fortsette, er det nødvendig med enkeltstrengede bindingsproteiner for å forhindre at enkeltstrengene av DNA danner sekundære strukturer og for å forhindre at de glødes på nytt . I tillegg er DNA -gyrase nødvendig for å lindre det topologiske stresset som skapes av virkningen av DnaB -helikase.
Forlengelse
Når replikasjonsgaffelen beveger seg rundt sirkelen, dannes en struktur formet som den greske bokstaven theta Ө. John Cairns demonstrerte theta -strukturen for kromosomal replikasjon av E. coli i 1963, ved å bruke en nyskapende metode for å visualisere DNA -replikasjon. I eksperimentet merket han radioaktivt kromosomet ved å dyrke sine kulturer i et medium som inneholder 3H- tymidin . Den nukleosid base ble innlemmet jevnt i det bakterielle kromosom. Deretter isolerte han kromosomene ved å lysere cellene forsiktig og plassere dem på et elektronmikrograf (EM) rutenett som han eksponerte for røntgenfilm i to måneder. Dette eksperimentet viser tydelig theta -replikasjonsmodellen for sirkulære bakteriekromosomer.
- Se autoradiograf av intakt replikerende kromosom av E. coli [1]
Som beskrevet ovenfor skjer bakteriell kromosomal replikasjon toveis. Dette ble først demonstrert ved spesifikk merking av replikerende bakteriekromosomer med radioaktive isotoper . Regionene av DNA som gjennomgår replikasjon under eksperimentet ble deretter visualisert ved å bruke autoradiografi og undersøke den utviklede filmen mikroskopisk. Dette tillot forskerne å se hvor replikasjon fant sted. De første avgjørende observasjonene av toveis replikasjon var fra studier av B. subtilis. Kort tid etter ble E. coli -kromosomet også vist å replikere toveis.
- Se figur 4 i DM Prescott og PL Kuempel (1972): Et kornspor produsert av et E. coli -kromosom fra celler merket i 19 minutter med [3H] tymin, etterfulgt av merking i 2,5 minutter med [3H] tymin og ['H ] tymidin. [2] .
Den E. coli- DNA-polymerase III holoenzym er et 900 kD-komplekset, som har en i hovedsak en dimer struktur. Hver monomerenhet har en katalytisk kjerne, en dimeriseringsunderenhet og en prosessivitetskomponent . DNA Pol III bruker ett sett med sine kjerneunderenheter for å syntetisere den ledende strengen kontinuerlig, mens det andre settet med kjerneunderenheter sykluser fra det ene Okazaki -fragmentet til det neste på den sløyfede, halende strengen . Ledende strengsyntese begynner med syntesen av en kort RNA -primer ved replikasjonsopprinnelsen med enzymet Primase ( DnaG -protein ).
Deoksynukleotider tilsettes deretter til denne primeren med en enkelt DNA -polymerase III -dimer, i et integrert kompleks med DnaB -helikase. Ledende strengsyntese fortsetter deretter kontinuerlig, mens DNAet avvikles samtidig ved replikasjonsgaffelen. I kontrast til dette oppnås forsinket strengsyntese i korte Okazaki -fragmenter. Først blir en RNA -primer syntetisert av primase, og i likhet med ledende strengsyntese binder DNA Pol III seg til RNA -primeren og tilfører deoksyribonukleotider .
Når syntesen av et Okazaki -fragment er fullført, stopper replikasjonen og kjerneunderenhetene til DNA Pol III dissosierer fra β -glideklemmen [B -glideklapp er prosessivitetsunderenheten til DNA Pol III]. RNA -primeren fjernes og erstattes med DNA med DNA -polymerase I [som også besitter korrekturlesing av eksonukleaseaktivitet ], og den gjenværende nick blir forseglet med DNA -ligase , som deretter ligerer disse fragmentene for å danne den hengerstrengen.
En betydelig andel (10-15%) av replikasjonsgaflene med opprinnelse i oriC støter på DNA-skade eller strengbrudd når celler vokser under normale laboratorieforhold (uten at en eksogen DNA skader behandlingen). De oppståtte DNA -skadene blir vanligvis behandlet av rekombinasjonelle reparasjonsenzymer for å tillate fortsatt replikasjonsgaffelprogresjon.
Avslutning

Terminering er prosessen med sammensmelting av replikasjonsgafler og demontering av replikomene for å gi to separate og komplette DNA -molekyler . Det forekommer i endeområdet, omtrent motsatt oriC på kromosomet (figur 5). Terminalregionen inneholder flere DNA -replikasjonsterminatorsteder, eller "Ter" -steder. Et spesielt "replikasjonsterminator" -protein må bindes på Ter -stedet for at det skal stoppe replikasjonen. Hvert Ter -område har handlingspolaritet, det vil si at det vil stoppe en replikasjonsgaffel som nærmer seg Ter -stedet fra en retning, men vil tillate uhindret bevegelse av gaffelen gjennom Ter -stedet fra den andre retningen. Arrangementet av Ter -stedene danner to motsatte grupper som tvinger de to gaflene til å møte hverandre i regionen de spenner over. Denne ordningen kalles "replikasjonsgaffelfellen".
- Se steder og sekvenser av replikasjonsterminene til E. coli. (A) Kart som viser ori og de 10 Ter -nettstedene. (B) Konsensussekvensen til Ter. [3]
Ter -nettstedene interagerer spesielt med replikasjonsterminatorproteinet kalt Tus i E. coli . Tus-Ter-komplekset hindrer DNA-avviklingsaktiviteten til DnaB på en orienteringsavhengig måte.
- Den krystallstruktur av den Ter DNA-Tus proteinkomplekset (A) som viser den ikke-blokkerende og gaffel-blokkerende flater på Tus. (B) Et tverrsnitt av helikase-arrestasjonsoverflaten. [4]
Replikasjon av DNA som skiller de motsatte replikasjonsgaflene, etterlater de fullførte kromosomene som " catenaner " eller topologisk sammenkoblede sirkler. Sirklene er ikke kovalent koblet, men kan ikke skilles fordi de er sammenvevd og hver er kovalent lukket. De sammenkoblede sirkler krever virkning av topoisomeraser for å skille sirklene [dekatanasjon]. I E.coli spiller DNA topoisomerase IV hovedrollen i separasjonen av de koblede kromosomene, forbigående bryter begge DNA -strengene til det ene kromosomet og lar det andre kromosomet passere gjennom bruddet.
Det har vært en viss forvirring om hvilken rolle DNA -gyrase spiller i dekatasjon. For å definere nomenklaturen er det to typer topoisomeraser: type I produserer forbigående enkeltstrengede brudd i DNA og type II produserer forbigående dobbeltstrengede brudd. Som et resultat fjerner type I -enzymet supercoils fra DNA en om gangen, mens type II -enzymet fjerner supercoils to om gangen. Topo I av både prokaryoter og eukaryoter er topoisomerase av type I. Den eukaryote topo II, bakterielle gyrase og bakterielle topo IV tilhører type II.
Vi glemmer ofte at DNA -gyrase faktisk har topoisomerase type II -aktivitet; Dermed, med at det er en homolog for topoisomerase IV (som også har topoisomerase II -aktivitet), forventer vi likhet i de to proteinenes funksjoner. DNA -gyrase -foreløpig rolle er å introdusere negative superspoler i DNA, og dermed slappe av positive supercoils som spiller inn under DNA -replikasjon. Topoisomerase IV slapper også av positive supercoils, derfor spiller DNA Gyrase og topoisomerase IV en nesten identisk rolle i å fjerne de positive supercoilene foran en translokerende DNA -polymerase, slik at DNA -replikasjon kan fortsette uhindret av topologisk belastning.
Forvirring oppstår når noen vitenskapelig litteratur sier at DNA -gyrase er det eneste enzymet som er ansvarlig for dekatanisering. I et eksperiment utført av Zechiedrich, Khodursky og Cozzarelli i 1997, ble det funnet at topoisomerase IV er den eneste viktige dekatenasen av DNA -replikasjonsmellomprodukter i bakterier. I dette spesielle eksperimentet, da DNA -gyrase alene ble hemmet, ble de fleste av catenanene koblet fra. Men da Topoisomerase IV alene ble hemmet, ble dekatenering nesten fullstendig blokkert. De oppnådde resultatene antyder at Topoisomerase IV er den primære dekatenasen in vivo , og selv om DNA -gyrase spiller en rolle i dekatenering, er dens funksjon ikke like viktig som topoisomerase IV ved dekatentering av sammenkoblede kromosomer.
Anerkjennelser
Dette er basert på en artikkel av Imalda Devaparanam og David Tribe som ble gjort tilgjengelig under CC av SA -lisensbetingelser fra en universitetskursaktivitet ved Institutt for mikrobiologi og immunologi, University of Melbourne, 2007.
Se også
Referanser
Denne artikkelen inneholder materiale fra Citizendium- artikkelen " Replication of a circular bacterial chromosome ", som er lisensiert under Creative Commons Attribution-ShareAlike 3.0 Unported License, men ikke under GFDL .