Genomredigering - Genome editing
Genomredigering , eller genomteknikk , eller genredigering , er en type genteknologi der DNA settes inn, slettes, modifiseres eller erstattes i genomet til en levende organisme. I motsetning til tidlige gentekniske teknikker som tilfeldig setter inn genetisk materiale i et vertsgenom, retter genomredigering innføringene til stedsspesifikke steder.
Historie
Genomredigering ble banebrytende på 1990-tallet, før ankomsten av de gjeldende nukleasebaserte genredigeringsplattformene, men bruken av den var begrenset av lave effektivitet ved redigering. Genomredigering med konstruerte nukleaser, dvs. alle tre hovedklassene av disse enzymene-sinkfinger-nukleaser (ZFN-er), transkripsjonsaktivatorlignende effektor-nukleaser (TALEN-er) og konstruerte meganukleaser-ble valgt av Nature Methods som Årets metode i 2011. CRISPR-Cas-systemet ble valgt av Science som Årets gjennombrudd 2015.
Fra 2015 ble det brukt fire familier av konstruerte nukleaser: meganukleaser , sinkfinger-nukleaser (ZFNs), transkripsjonsaktivatorlignende effektorbaserte nukleaser (TALEN) og de klyngede, regelmessig mellomliggende korte palindromiske repetisjonene ( CRISPR / Cas9 ) -systemet. Ni genomredaktører var tilgjengelige fra 2017.
I 2018 brukte de vanlige metodene for slik redigering konstruerte nukleaser , eller "molekylær saks". Disse nukleasene skaper stedsspesifikke dobbeltstrengspauser (DSB) på ønskede steder i genomet. De induserte dobbeltstrengspausene repareres gjennom ikke-homolog endeforbindelse (NHEJ) eller homolog rekombinasjon (HR), noe som resulterer i målrettede mutasjoner ('redigeringer').
I mai 2019 rapporterte advokater i Kina , i lys av den påståtte etableringen av den kinesiske forskeren He Jiankui av de første genredigerte menneskene (se Lulu og Nana-kontrovers ), utarbeidelse av forskrifter om at noen manipulerer det menneskelige genomet med genredigeringsteknikker , i likhet med CRISPR , vil bli holdt ansvarlig for eventuelle negative konsekvenser. Et forsiktighetsperspektiv på mulige blinde flekker og risiko ved CRISPR og relaterte bioteknologier har nylig blitt diskutert, med fokus på den stokastiske naturen til cellulære kontrollprosesser.
Den University of Edinburgh Roslin Institute utviklet griser resistente mot et virus som forårsaker svin og respiratorisk syndrom , som koster amerikanske og europeiske svinebønder $ 2,6 milliarder årlig.
I februar 2020 viste en amerikansk studie trygt CRISPR -genredigering på 3 kreftpasienter. I 2020 ble Sicilian Rouge High GABA, en tomat som lager mer av en aminosyre som sies å fremme avslapning, godkjent for salg i Japan.
I 2021 planla England (ikke resten av Storbritannia) å fjerne restriksjoner på genredigerte planter og dyr, og gikk fra regulering som samsvarer med EU til regler som er nærmere de i USA og noen andre land. En rapport fra Europakommisjonen fra april 2021 fant "sterke indikasjoner" på at dagens reguleringsregime ikke var egnet for genredigering Senere i 2021 kunngjorde forskere et CRISPR -alternativ, merket obligate mobile element -guided activity (OMEGA) proteiner inkludert IscB, IsrB og TnpB som endonukleaser funnet i transposoner , og styrt av små ωRNA.
Bakgrunn
Genteknologi som metode for å introdusere nye genetiske elementer i organismer har eksistert siden 1970 -tallet. En ulempe med denne teknologien har vært den tilfeldige naturen som DNA settes inn i vertens genom , som kan svekke eller endre andre gener i organismen. Selv om det er blitt oppdaget flere metoder som retter seg mot de innsatte genene på spesifikke steder i et organismens genom. Det har også muliggjort redigering av spesifikke sekvenser i et genom samt reduserte måleffekter. Dette kan brukes til forskningsformål, ved å målrette mutasjoner mot spesifikke gener og i genterapi . Ved å sette inn et funksjonelt gen i en organisme og målrette det mot å erstatte det defekte kan det være mulig å kurere visse genetiske sykdommer .
Genmålretting
Homolog rekombinasjon
Tidlige metoder for å målrette gener til bestemte steder i et genom av en organisme (kalt genmålretting ) var avhengig av homolog rekombinasjon (HR). Ved å lage DNA -konstruksjoner som inneholder en mal som matcher den målrettede genom -sekvensen, er det mulig at HR -prosessene i cellen vil sette inn konstruksjonen på ønsket sted. Ved å bruke denne metoden på embryonale stamceller førte det til utvikling av transgene mus med målrettede gener slått ut . Det har også vært mulig å banke inn gener eller endre genuttrykksmønstre . Som anerkjennelse for deres oppdagelse av hvordan homolog rekombinasjon kan brukes til å introdusere genetiske modifikasjoner hos mus gjennom embryonale stamceller, ble Mario Capecchi , Martin Evans og Oliver Smithies tildelt Nobelprisen i 2007 for fysiologi eller medisin .
Betinget målretting
Hvis et vitalt gen blir slått ut, kan det vise seg å være dødelig for organismen. For å studere funksjonen til disse genene ble stedsspesifikke rekombinaser (SSR) brukt. De to vanligste typene er Cre-LoxP og Flp-FRT- systemene. Cre-rekombinase er et enzym som fjerner DNA ved homolog rekombinasjon mellom bindingssekvenser kjent som Lox-P-steder. Flip-FRT-systemet fungerer på en lignende måte, med Flip-rekombinase som gjenkjenner FRT-sekvenser. Ved å krysse en organisme som inneholder rekombinase -stedene som flankerer genet av interesse med en organisme som uttrykker SSR under kontroll av vevsspesifikke promotorer , er det mulig å slå ut eller slå på gener bare i visse celler. Disse teknikkene ble også brukt til å fjerne markørgener fra transgene dyr. Ytterligere modifikasjoner av disse systemene tillot forskere å indusere rekombinasjon bare under visse forhold, slik at gener ble slått ut eller uttrykt på ønsket tidspunkt eller utviklingstrinn .
Prosess
Reparasjon med dobbelt tråd
En vanlig form for genomredigering er avhengig av konseptet med reparasjonsmekanikk for dobbeltstrenget DNA (DSB). Det er to hovedveier som reparerer DSB; ikke-homolog sluttforbindelse (NHEJ) og homologirettet reparasjon (HDR). NHEJ bruker en rekke enzymer for å koble seg direkte til DNA -endene mens den mer nøyaktige HDR bruker en homolog sekvens som en mal for regenerering av manglende DNA -sekvenser ved brytpunktet. Dette kan utnyttes ved å lage en vektor med de ønskede genetiske elementene i en sekvens som er homolog med de flankerende sekvensene til en DSB. Dette vil resultere i at den ønskede endringen blir satt inn på stedet for DSB. Selv om HDR -basert genredigering ligner den homologe rekombinasjonsbaserte genmålretting, økes rekombinasjonshastigheten med minst tre størrelsesordener.
Konstruerte nukleaser
Nøkkelen til genomredigering er å lage en DSB på et bestemt punkt i genomet. Vanlige restriksjonsenzymer er effektive til å kutte DNA, men gjenkjenner og kutter generelt på flere steder. For å overvinne denne utfordringen og lage stedsspesifikk DSB, har tre forskjellige klasser av nukleaser blitt oppdaget og bioingeniert til dags dato. Dette er sinkfinger-nukleasene (ZFN-er), transkripsjonsaktivator som effektor-nukleaser ( TALEN ), meganukleaser og de klyngede, regelmessig mellomliggende korte palindromiske repetisjonene ( CRISPR /Cas9) -systemet.
Meganukleaser
Meganukleaser , oppdaget på slutten av 1980 -tallet , er enzymer i endonukleasefamilien som er preget av deres evne til å gjenkjenne og kutte store DNA -sekvenser (fra 14 til 40 basepar). De mest utbredte og mest kjente meganukleasene er proteinene i LAGLIDADG -familien, som skylder navnet sitt på en konservert aminosyresekvens .
Meganukleaser, som vanligvis finnes i mikrobielle arter, har den unike egenskapen å ha svært lange gjenkjenningssekvenser (> 14bp), noe som gjør dem naturlig veldig spesifikke. Imidlertid er det praktisk talt ingen sjanse for å finne den eksakte meganukleasen som kreves for å virke på en valgt spesifikk DNA -sekvens. For å overvinne denne utfordringen har mutagenese og metoder for screening med høy gjennomstrømning blitt brukt til å lage meganukleasevarianter som gjenkjenner unike sekvenser. Andre har vært i stand til å smelte forskjellige meganukleaser og lage hybridenzymer som gjenkjenner en ny sekvens. Andre har forsøkt å endre de DNA -interagerende aminosyrene i meganukleasen for å designe sekvensspesifikke meganukelaser i en metode som heter rasjonelt designet meganuklease. En annen tilnærming innebærer å bruke datamodeller for å prøve å forutsi så nøyaktig som mulig aktiviteten til de modifiserte meganukleasene og spesifisiteten til den gjenkjente nukleinsekvensen.
En stor bank som inneholder flere titusenvis av proteinenheter er opprettet. Disse enhetene kan kombineres for å oppnå kimære meganukleaser som gjenkjenner målstedet, og derved tilby forsknings- og utviklingsverktøy som dekker et bredt spekter av behov (grunnforskning, helse, landbruk, industri, energi, etc.) Disse inkluderer produksjon i industriell skala av to meganukleaser i stand til å spalte det humane XPC -genet; mutasjoner i dette genet resulterer i Xeroderma pigmentosum , en alvorlig monogen lidelse som disponerer pasientene for hudkreft og brenner når huden deres blir utsatt for UV -stråler.
Meganukleaser har fordelen av å forårsake mindre toksisitet i celler enn metoder som sinkfingernuklease (ZFN), sannsynligvis på grunn av strengere DNA -sekvensgjenkjenning; konstruksjonen av sekvensspesifikke enzymer for alle mulige sekvenser er imidlertid kostbar og tidkrevende, ettersom man ikke drar fordel av kombinatoriske muligheter som metoder som ZFN og TALEN-baserte fusjoner utnytter.
Sinkfingernukleaser
I motsetning til meganukleaser, er konseptet bak ZFNs og TALEN-teknologi basert på et uspesifikt DNA-kuttende katalytisk domene, som deretter kan kobles til spesifikk DNA-sekvens som gjenkjenner peptider som sinkfingre og transkripsjonsaktivatorlignende effektorer (TALE). Det første trinnet til dette var å finne en endonuklease hvis DNA -gjenkjenningssted og spaltingssted var atskilt fra hverandre, en situasjon som ikke er den vanligste blant restriksjonsenzymer. Når dette enzymet ble funnet, kunne dets spaltningsdel separeres, noe som ville være svært uspesifikt, da det ikke ville ha noen gjenkjenningsevne. Denne delen kan deretter kobles til sekvensgjenkjenning av peptider som kan føre til svært høy spesifisitet.
Zink-finger- motiv opptre i flere transkripsjonsfaktorer . Sinkionen, som finnes i 8% av alle menneskelige proteiner, spiller en viktig rolle i organiseringen av deres tredimensjonale struktur. I transkripsjonsfaktorer er det oftest plassert på protein-DNA-interaksjonsstedene, hvor det stabiliserer motivet. Den C-terminale delen av hver finger er ansvarlig for den spesifikke gjenkjenningen av DNA-sekvensen.
De gjenkjente sekvensene er korte, består av rundt 3 basepar, men ved å kombinere 6 til 8 sinkfingre hvis gjenkjennelsessteder har blitt karakterisert, er det mulig å skaffe spesifikke proteiner for sekvenser på rundt 20 basepar. Det er derfor mulig å kontrollere ekspresjonen av et spesifikt gen. Det har blitt demonstrert at denne strategien kan brukes til å fremme en prosess med angiogenese hos dyr. Det er også mulig å smelte et protein konstruert på denne måten med det katalytiske domenet til en endonuklease for å indusere et målrettet DNA -brudd, og derfor å bruke disse proteinene som genomtekniske verktøy.
Metoden som vanligvis brukes for dette innebærer å knytte to DNA-bindende proteiner-som hver inneholder 3 til 6 spesifikt utvalgte sinkfingre-med det katalytiske domenet til FokI- endonukleasen som må dimeriseres for å spalte dobbeltstrenget DNA. De to proteinene gjenkjenner to DNA -sekvenser som er noen få nukleotider fra hverandre. Å koble de to sinkfingerproteinene til deres respektive sekvenser bringer de to FokI -domenene nærmere hverandre. FokI krever dimerisering for å ha nukleaseaktivitet, og dette betyr at spesifisiteten øker dramatisk ettersom hver nukleasepartner ville gjenkjenne en unik DNA -sekvens. For å forsterke denne effekten har FokI -nukleaser blitt konstruert som bare kan fungere som heterodimerer.
Flere tilnærminger brukes til å designe spesifikke sinkfingernukleaser for de valgte sekvensene. Den mest utbredte innebærer å kombinere sinkfingerenheter med kjente spesifisiteter (modulær montering). Ulike seleksjonsteknikker ved bruk av bakterier, gjær eller pattedyrceller er utviklet for å identifisere kombinasjonene som gir den beste spesifisiteten og den beste celletoleransen. Selv om den direkte genomomfattende karakteriseringen av sinkfingernukleaseaktivitet ikke er rapportert, fant en analyse som måler det totale antallet dobbeltstrengede DNA-brudd i celler at bare ett til to slike brudd oppstår over bakgrunnen i celler behandlet med sinkfingernukleaser med et 24 bp kompositt gjenkjenningssted og obligatoriske heterodimer FokI -nukleasedomener.
De heterodimer fungerende nukleasene ville unngå muligheten for uønsket homodimer aktivitet og dermed øke spesifisiteten til DSB. Selv om nukleasedelene av både ZFN- og TALEN -konstruksjoner har lignende egenskaper, er forskjellen mellom disse konstruerte nukleasene i deres DNA -gjenkjenningspeptid. ZFN-er er avhengige av Cys2-His2 sinkfingre og TALEN-konstruksjoner på TALEs. Begge disse DNA -gjenkjennende peptiddomenene har karakteristikken at de naturlig finnes i kombinasjoner i proteinene. Cys2-His2 Sinkfingre skjer vanligvis ved repetisjoner som er 3 bp fra hverandre og finnes i forskjellige kombinasjoner i en rekke nukleinsyre-interagerende proteiner, for eksempel transkripsjonsfaktorer . Hver finger på sinkfinger -domenet er helt uavhengig og bindingskapasiteten til en finger påvirkes av naboen. TALE på den annen side finnes i gjentakelser med et en-til-ett gjenkjenningsforhold mellom aminosyrene og de gjenkjente nukleotidparene. Fordi både sinkfingre og TALE skjer i gjentatte mønstre, kan forskjellige kombinasjoner prøves for å skape en rekke sekvensspesifisiteter. Sinkfingre har blitt mer etablert i disse begrepene og tilnærmingene, for eksempel modulær montering (hvor sinkfingre korrelert med en tripletsekvens er festet på rad for å dekke den nødvendige sekvensen), OPEN (utvalg med lav stringens av peptiddomener vs. trillingnukleotider fulgt ved seleksjoner med høy stringens av peptidkombinasjon vs. det endelige målet i bakterielle systemer), og bakteriell en-hybrid screening av sinkfingerbiblioteker blant andre metoder har blitt brukt for å lage stedsspesifikke nukleaser.
Sinkfingernukleaser er forsknings- og utviklingsverktøy som allerede har blitt brukt til å modifisere en rekke genomer, spesielt av laboratoriene i Zink Finger Consortium. Det amerikanske selskapet Sangamo BioSciences bruker sinkfingernukleaser for å forske på genteknologi av stamceller og modifikasjon av immunceller for terapeutiske formål. Modifiserte T -lymfocytter gjennomgår for tiden fase I kliniske studier for å behandle en type hjernesvulst (glioblastom) og i kampen mot AIDS.
TALEN
Transkripsjonsaktivatorlignende effektor-nukleaser (TALENer) er spesifikke DNA-bindende proteiner som inneholder en rekke 33 eller 34-aminosyre gjentakelser. TALENer er kunstige restriksjonsenzymer designet ved å fusjonere DNA -skjæreområdet til en nuklease til TALE -domener, som kan skreddersys for å spesifikt gjenkjenne en unik DNA -sekvens. Disse fusjonsproteinene fungerer som lett målbare "DNA -saks" for genredigeringsprogrammer som gjør det mulig å utføre målrettede genommodifikasjoner som sekvensinnsetting, sletting, reparasjon og erstatning i levende celler. DNA-bindingsdomenene, som kan utformes for å binde enhver ønsket DNA-sekvens, kommer fra TAL-effektorer , DNA-bindende proteiner som skilles ut av plantepatogene Xanthomanos app. TAL -effektorer består av gjentatte domener, som hver inneholder en høyt konservert sekvens på 34 aminosyrer, og gjenkjenner et enkelt DNA -nukleotid innenfor målstedet. Nukleasen kan skape dobbeltstrengspauser på målstedet som kan repareres ved feilutsatt ikke-homolog endeforbindelse (NHEJ), noe som resulterer i genforstyrrelser gjennom introduksjon av små innsettinger eller slettinger. Hver gjentak bevares, med unntak av de såkalte repeterbare variabel-di-restene (RVD) ved aminosyrestilling 12 og 13. RVD-ene bestemmer DNA-sekvensen som TALE vil binde seg til. Denne enkle en-til-en-korrespondansen mellom TALE-gjentakelsene og den tilsvarende DNA-sekvensen gjør prosessen med å sette sammen gjentatte matriser for å gjenkjenne nye DNA-sekvenser grei. Disse TALE-ene kan fusjoneres til det katalytiske domenet fra en DNA-nuklease, FokI, for å generere en transkripsjonsaktivatorlignende effektor-nuklease (TALEN). De resulterende TALEN-konstruksjonene kombinerer spesifisitet og aktivitet, og genererer effektivt konstruerte sekvensspesifikke nukleaser som bare binder og spalter DNA-sekvenser på forhåndsvalgte steder. TALEN-målgjenkjenningssystemet er basert på en kode som er lett å forutsi. TAL -nukleaser er spesifikke for målet sitt, delvis på grunn av lengden på deres 30+ basepar bindingssted. TALEN kan utføres innenfor et område på 6 basepar av et hvilket som helst enkelt nukleotid i hele genomet.
TALEN-konstruksjoner brukes på lignende måte som designet sinkfinger-nukleaser, og har tre fordeler ved målrettet mutagenese: (1) DNA-bindingsspesifisiteten er høyere, (2) off-target-effekter er lavere, og (3) konstruksjon av DNA-binding domener er lettere.
CRISPR
CRISPRs (Clustered Regularly Interspaced Short Palindromic Repeats) er genetiske elementer som bakterier bruker som en slags ervervet immunitet for å beskytte mot virus. De består av korte sekvenser som stammer fra virale genomer og har blitt inkorporert i bakteriegenomet. Cas (CRISPR -assosierte proteiner) behandler disse sekvensene og kutter matchende virale DNA -sekvenser. Ved å introdusere plasmider som inneholder Cas -gener og spesifikt konstruerte CRISPR -er i eukaryote celler, kan det eukaryote genomet kuttes i en hvilken som helst ønsket posisjon.
Redigering ved Nucleobase -modifikasjon (BASE -redigering)
En av de tidligste metodene for effektiv redigering av nukleinsyrer bruker nukleobasemodifiserende enzymer rettet av nukleinsyrestyringssekvenser ble først beskrevet på 1990 -tallet og har sett gjenoppblomstring mer nylig. Denne metoden har fordelen at den ikke krever å bryte de genomiske DNA -strengene, og dermed unngår tilfeldig innsetting og sletting forbundet med DNA -strengbrudd. Den er bare egnet for presis redigering som krever endringer i enkeltnukleotid, og har vist seg å være svært effektiv for denne typen redigering.
Presisjon og effektivitet av konstruerte nukleaser
Meganukleaser metode for genredigering er den minst effektive av metodene nevnt ovenfor. På grunn av arten av dets DNA-bindende element og det spaltende elementet, er det begrenset til å gjenkjenne ett potensielt mål for hver 1000 nukleotider. ZFN ble utviklet for å overvinne begrensningene ved meganuklease. Antall mulige mål ZFN kan gjenkjenne ble økt til ett av hver 140 nukleotider. Imidlertid er begge metodene uforutsigbare på grunn av deres DNA-bindende elementer som påvirker hverandre. Som et resultat kreves høy grad av kompetanse og lange og kostbare valideringsprosesser.
TALE -nukleaser som er den mest presise og spesifikke metoden gir en høyere effektivitet enn de to foregående metodene. Den oppnår en slik effektivitet fordi DNA-bindingselementet består av en rekke TALE-underenheter, som hver har evnen til å gjenkjenne en spesifikk DNA-nukleotidkjede uavhengig av andre, noe som resulterer i et større antall målsteder med høy presisjon. Nye TALE -nukleaser tar omtrent en uke og noen hundre dollar å lage, med spesifikk ekspertise innen molekylærbiologi og proteinteknikk.
CRISPR -nukleaser har en litt lavere presisjon sammenlignet med TALE -nukleasene. Dette er forårsaket av behovet for å ha et spesifikt nukleotid i den ene enden for å produsere guide-RNA som CRISPR bruker for å reparere dobbeltstrengs brudd det induserer. Det har vist seg å være den raskeste og billigste metoden, som bare koster mindre enn to hundre dollar og noen få dager. CRISPR krever også minst mulig ekspertise innen molekylærbiologi slik designet ligger i veilednings -RNA i stedet for proteinene. En stor fordel som CRISPR har i forhold til ZFN- og TALEN -metodene er at den kan dirigeres til å målrette forskjellige DNA -sekvenser ved å bruke ~ 80nt CRISPR -sgRNA -ene, mens både ZFN- og TALEN -metodene krevde konstruksjon og testing av proteinene som ble opprettet for å målrette hver DNA -sekvens.
Fordi off-target-aktivitet av en aktiv nuklease ville ha potensielt farlige konsekvenser på genetisk og organismenivå, har presisjonen til meganukleaser, ZFN-er, CRISPR og TALEN-baserte fusjoner vært et aktivt forskningsområde. Selv om variable tall er rapportert, har ZFN en tendens til å ha mer cytotoksisitet enn TALEN-metoder eller RNA-guidede nukleaser, mens TALEN- og RNA-guidede tilnærminger har en tendens til å ha størst effektivitet og færre effekter utenfor målet. Basert på den maksimale teoretiske avstanden mellom DNA -binding og nukleaseaktivitet, resulterer TALEN -tilnærminger i størst presisjon.
Multiplex Automated Genomic Engineering (MAGE)
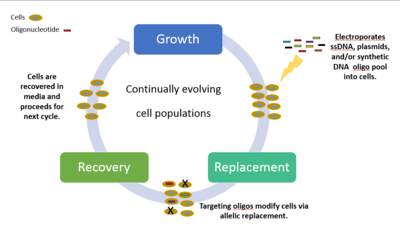
Metodene for forskere og forskere som ønsket å studere genomisk mangfold og alle mulige tilknyttede fenotyper var veldig sakte, dyre og ineffektive. Før denne nye revolusjonen måtte forskere utføre enkeltgenmanipulasjoner og justere genomet en liten seksjon om gangen, observere fenotypen og starte prosessen på nytt med en annen enkeltgenmanipulasjon. Derfor designet forskere ved Wyss Institute ved Harvard University MAGE, en kraftig teknologi som forbedrer prosessen med in vivo genomredigering. Det gir mulighet for raske og effektive manipulasjoner av et genom, alt skjer i en maskin som er liten nok til å sette oppå et lite kjøkkenbord. Disse mutasjonene kombineres med variasjonen som naturlig oppstår under cellemitose og skaper milliarder av cellulære mutasjoner.
Kjemisk kombinert, syntetisk enkeltstrenget DNA (ssDNA) og et basseng med oligionukleotider blir introdusert på målrettede områder av cellen og skaper derved genetiske modifikasjoner. Den sykliske prosessen innebærer transformasjon av ssDNA (ved elektroporering ) etterfulgt av utvekst, hvor bakteriofag -homologe rekombinasjonsproteiner medierer gløding av ssDNA til deres genomiske mål. Eksperimenter rettet mot selektive fenotypiske markører screenes og identifiseres ved å plate cellene på differensialmedier. Hver syklus tar til slutt 2,5 timer å behandle, med ytterligere tid som kreves for å dyrke isogene kulturer og karakterisere mutasjoner. Ved iterativt å introdusere biblioteker med mutagene ssDNAer rettet mot flere steder, kan MAGE generere kombinatorisk genetisk mangfold i en cellepopulasjon. Det kan være opptil 50 genomredigeringer, fra enkle nukleotidbasepar til hele genom- eller gennettverk samtidig med resultater i løpet av dager.
MAGE -eksperimenter kan deles inn i tre klasser, preget av varierende omfang og kompleksitet: (i) mange målsteder, enkelt genetiske mutasjoner; (ii) enkelt målsted, mange genetiske mutasjoner; og (iii) mange målsteder, mange genetiske mutasjoner. Et eksempel på klasse tre ble reflektert i 2009, hvor Church og kolleger var i stand til å programmere Escherichia coli til å produsere fem ganger den normale mengden lykopen, en antioksidant som normalt finnes i tomatfrø og knyttet til kreftbekjempende egenskaper. De brukte MAGE for å optimalisere 1-deoksy-d-xylulose-5-fosfat (DXP) metabolsk vei i Escherichia coli for å overprodusere isoprenoid lykopen. Det tok dem omtrent 3 dager og litt over $ 1000 i materialer. Enkelheten, hastigheten og kostnadseffektiviteten der MAGE kan endre genomer, kan transformere hvordan næringer nærmer seg produksjon og produksjon av viktige forbindelser innen bioingeniør, bioenergi, biomedisinsk ingeniørfag, syntetisk biologi, farmasøytisk, landbruks- og kjemisk industri.
applikasjoner
Fra 2012 hadde effektiv genomredigering blitt utviklet for et bredt spekter av eksperimentelle systemer som spenner fra planter til dyr, ofte utenfor klinisk interesse, og ble en standard eksperimentell strategi i forskningslaboratorier. Den siste generasjonen av ZFN-medierte mutanter fra rotte, sebrafisk , mais og tobakk og forbedringene i TALEN-baserte tilnærminger vitner om betydningen av metodene, og listen ekspanderer raskt. Genomredigering med konstruerte nukleaser vil sannsynligvis bidra til mange områder innen biovitenskap fra å studere genfunksjoner hos planter og dyr til genterapi hos mennesker. For eksempel vil feltet syntetisk biologi som tar sikte på å konstruere celler og organismer for å utføre nye funksjoner, sannsynligvis dra nytte av evnen til konstruert nuklease til å legge til eller fjerne genomiske elementer og derfor lage komplekse systemer. I tillegg kan genfunksjoner studeres ved hjelp av stamceller med konstruerte nukleaser.
Nedenfor er noen spesifikke oppgaver denne metoden kan utføre:
- Målrettet genmutasjon
- Genterapi
- Opprette kromosomarrangement
- Studer genfunksjon med stamceller
- Transgene dyr
- Endogen genmerking
- Målrettet transgen -tillegg
Målrettet genmodifisering hos dyr
Kombinasjonen av nylige funn innen genteknologi, spesielt genredigering og den siste forbedringen innen teknologier for reproduksjon av storfe (f.eks. Embryokultur in vitro ) muliggjør genomredigering direkte i befruktede oocytter ved bruk av syntetiske høyspesifikke endonukleaser. RNA-guidede endonukleaser: klynger med jevne mellomrom mellom palindromiske repetisjoner assosiert Cas9 (CRISPR/Cas9) er et nytt verktøy, som ytterligere øker omfanget av tilgjengelige metoder . Spesielt tillater CRISPR/Cas9 -konstruerte endonukleaser bruk av flere guide -RNAer for samtidige knockout (KO) i ett trinn ved cytoplasmatisk direkte injeksjon (CDI) på zygoter hos pattedyr.
Videre kan genredigering brukes på visse typer fisk i havbruk som atlantisk laks. Genredigering hos fisk er for tiden eksperimentell, men mulighetene inkluderer vekst, sykdomsresistens, sterilitet, kontrollert reproduksjon og farge. Å velge disse egenskapene kan gi et mer bærekraftig miljø og bedre velferd for fisken.
AquAdvantage laks er en genmodifisert atlantisk laks utviklet av AquaBounty Technologies. Veksthormonregulerende genet i atlantisk laks erstattes med veksthormonregulerende gen fra Pacific Chinook-laksen og en promotorsekvens fra havputen
Takket være den parallelle utviklingen av encellede transkriptomikk, genomredigering og nye stamcellemodeller går vi nå inn i en vitenskapelig spennende periode der funksjonell genetikk ikke lenger er begrenset til dyremodeller, men kan utføres direkte i menneskelige prøver. Encellet genuttrykk analyse har løst et transkripsjonelt veikart for menneskelig utvikling som nøkkelkandidatgener blir identifisert for funksjonelle studier. Ved å bruke globale transcriptomics -data for å veilede eksperimentering, har det CRISPR -baserte genomredigeringsverktøyet gjort det mulig å forstyrre eller fjerne viktige gener for å belyse funksjon i menneskelige omgivelser.
Målrettet genmodifisering i planter
Genomredigering ved bruk av Meganuclease , ZFNs og TALEN gir en ny strategi for genetisk manipulasjon i planter og vil sannsynligvis hjelpe til med konstruksjonen av ønskede plantetrekk ved å modifisere endogene gener. For eksempel kan stedsspesifikk gentilsetning i store avlingsarter brukes til 'trait stacking', hvorved flere ønskede egenskaper er fysisk knyttet til å sikre deres co-segregering under avlsprosessene. Fremgang i slike tilfeller har nylig blitt rapportert i Arabidopsis thaliana og Zea mays . I Arabidopsis thaliana , ved bruk av ZFN-assistert genmålretting, ble to herbicidresistente gener (tobakkacetolaktatsyntase SuRA og SuRB) introdusert for SuR loci med så høye som 2% transformerte celler med mutasjoner. I Zea mays ble forstyrrelse av målstedet oppnådd av ZFN-induserte DSBer og den resulterende NHEJ. ZFN ble også brukt til å drive herbicid-toleranse genuttrykkskassett (PAT) inn i det målrettede endogene locus IPK1 i dette tilfellet. Slik genommodifisering observert i de regenererte plantene har vist seg å være arvelig og ble overført til neste generasjon. Et potensielt vellykket eksempel på bruk av genomredigeringsteknikker for avlingsforbedring finnes i banan, hvor forskere brukte CRISPR/Cas9 -redigering for å inaktivere det endogene bananstrekviruset i B -genomet av banan ( Musa spp. ) For å overvinne en stor utfordring i bananavl.
I tillegg har TALEN-basert genomteknikk blitt grundig testet og optimalisert for bruk i planter. TALEN -fusjoner har også blitt brukt av et amerikansk selskap for matingredienser, Calyxt, for å forbedre kvaliteten på soyabønneoljeprodukter og for å øke lagringspotensialet til poteter
Flere optimaliseringer må gjøres for å forbedre redigering av plantegenomer ved bruk av ZFN-mediert målretting. Det er behov for pålitelig design og påfølgende test av nukleasene, fraværet av toksisitet av nukleasene, det riktige valget av plantevevet for målretting, induksjonsveiene for enzymaktivitet, mangel på off-target mutagenese og en pålitelig påvisning av muterte tilfeller.
En vanlig leveringsmetode for CRISPR/Cas9 i anlegg er Agrobacterium -basert transformasjon. T-DNA blir introdusert direkte i plantegenomet av en T4SS-mekanisme. Cas9 og gRNA-baserte ekspresjonskassetter blir til Ti-plasmider , som transformeres i Agrobacterium for plantebruk . For å forbedre Cas9 -levering i levende planter, brukes virus mer effektiv transgenlevering.
| Del av en artikkelserie om |
| Syntetisk biologi |
|---|
| Syntetiske biologiske kretser |
| Genomredigering |
| Kunstige celler |
| Xenobiologi |
| Andre temaer |
Forskning
Genterapi
Den ideelle genterapipraksis er den som erstatter det defekte genet med en normal allel på sin naturlige plassering. Dette er fordelaktig i forhold til et viralt levert gen, ettersom det ikke er nødvendig å inkludere de fulle kodende sekvensene og regulatoriske sekvenser når bare en liten andel av genet må endres som ofte er tilfellet. Uttrykket av de delvis erstattede genene er også mer konsistent med normal cellebiologi enn fulle gener som bæres av virusvektorer.
Den første kliniske bruken av TALEN-basert genomredigering var ved behandling av CD19+ akutt lymfoblastisk leukemi hos et 11 måneder gammelt barn i 2015. Modifiserte donor-T-celler ble konstruert for å angripe leukemi-cellene, for å være resistente mot Alemtuzumab og for å unngå deteksjon av vertens immunsystem etter introduksjon.
Omfattende forskning har blitt gjort på celler og dyr som bruker CRISPR-Cas9 for å prøve å korrigere genetiske mutasjoner som forårsaker genetiske sykdommer som Downs syndrom, spina bifida, anencephaly og Turner og Klinefelter syndromer.
I februar 2019 kunngjorde medisinske forskere som jobber med Sangamo Therapeutics , med hovedkontor i Richmond, California , den første "i kroppen" menneskelige genredigeringsterapien som permanent endrer DNA - hos en pasient med Hunter syndrom . Kliniske studier av Sangamo som omfatter genet redigering ved hjelp av zinkfinger-nuklease (ZFN) er pågående.
Utrydde sykdommer
Forskere har brukt CRISPR-Cas9 gen stasjoner for å modifisere gener assosiert med sterilitet hos A. gambiae , vektoren for malaria. Denne teknikken har ytterligere implikasjoner for å utrydde andre vektorbårne sykdommer som gul feber, dengue og Zika.
CRISPR-Cas9-systemet kan programmeres til å modulere populasjonen av alle bakteriearter ved å målrette mot kliniske genotyper eller epidemiologiske isolater. Det kan selektivt aktivere de gunstige bakteriearter i forhold til de skadelige ved å eliminere patogen, noe som gir det en fordel i forhold til bredspektret antibiotika.
Antivirale applikasjoner for behandlinger rettet mot humane virus som HIV, herpes og hepatitt B -virus er under forskning. CRISPR kan brukes til å målrette mot viruset eller verten for å forstyrre gener som koder for viruscelleoverflate-reseptorproteinene. I november 2018 kunngjorde He Jiankui at han hadde redigert to menneskelige embryoer for å prøve å deaktivere genet for CCR5 , som koder for en reseptor som HIV bruker for å komme inn i celler. Han sa at tvillingjenter, Lulu og Nana , hadde blitt født noen uker tidligere. Han sa at jentene fremdeles hadde funksjonelle kopier av CCR5 sammen med funksjonshemmede CCR5 ( mosaikk ) og fremdeles var sårbare for HIV. Arbeidet ble bredt fordømt som uetisk, farlig og for tidlig.
I januar 2019 rapporterte forskere i Kina etableringen av fem identiske klonede genredigerte aper, ved bruk av samme kloningsteknikk som ble brukt med Zhong Zhong og Hua Hua- de første klonede aper- og sauene Dolly , og det samme genet- redigering av Crispr - Cas9 -teknikk som angivelig ble brukt av He Jiankui for å lage de første genmodifiserte menneskelige babyene Lulu og Nana noensinne . Apeklonene ble laget for å studere flere medisinske sykdommer.
I nær fremtid vil det nye CRISPR -systemet også kunne utrydde sykdommer og tilstander som mennesker er disponert for. Med denne nye teknologien vil forskere kunne ta genene til en menneskelig sædcelle og egg, og erstatte genene som aktiverer kreft eller andre unormale eller uønskede defekter. Dette vil fjerne stresset fra foreldre som bekymrer seg for å få et barn og ikke kan leve et normalt liv. Etter bare en generasjon av denne prosessen, ville hele menneskehetens fremtid aldri måtte bekymre seg for problemene med deformiteter eller predisponerte forhold.
Utsikter og begrensninger
I fremtiden må et viktig mål for forskning på genomredigering med konstruerte nukleaser være forbedring av sikkerheten og spesifisiteten til nukleaseaksjonen. For eksempel kan forbedring av evnen til å oppdage hendelser utenfor målet forbedre vår evne til å lære om måter å forhindre dem på. I tillegg er sinkfingre som brukes i ZFN-er sjelden helt spesifikke, og noen kan forårsake en toksisk reaksjon. Det er imidlertid rapportert at toksisiteten er redusert ved endringer gjort på spaltningsområdet til ZFN.
I tillegg har forskning av Dana Carroll om modifisering av genomet med konstruerte nukleaser vist behovet for bedre forståelse av de grunnleggende rekombinasjons- og reparasjonsmaskinene til DNA. I fremtiden vil en mulig metode for å identifisere sekundære mål være å fange ødelagte ender fra celler som uttrykker ZFNene og sekvensere det flankerende DNA ved hjelp av sekvensering med høy gjennomstrømning.
På grunn av brukervennligheten og kostnadseffektiviteten til CRISPR, blir det for tiden utført omfattende undersøkelser på det. Det er nå flere publikasjoner om CRISPR enn ZFN og TALEN til tross for hvor nylig oppdagelsen av CRISPR er. Både CRISPR og TALEN foretrekkes som valgene som skal implementeres i store produksjoner på grunn av presisjon og effektivitet.
Genomredigering skjer også som en naturlig prosess uten kunstig genteknologi. Agenter som er kompetente til å redigere genetiske koder er virus eller subvirale RNA-agenter.
Selv om GEEN har høyere effektivitet enn mange andre metoder innen omvendt genetikk, er det fremdeles ikke svært effektivt; i mange tilfeller oppnår mindre enn halvparten av de behandlede populasjonene de ønskede endringene. For eksempel, når man planlegger å bruke cellens NHEJ til å lage en mutasjon, vil cellens HDR -systemer også være i gang med å korrigere DSB med lavere mutasjonshastigheter.
Tradisjonelt har mus vært det vanligste valget for forskere som vert for en sykdomsmodell. CRISPR kan hjelpe til med å bygge bro mellom denne modellen og kliniske studier på mennesker ved å lage transgene sykdomsmodeller hos større dyr som griser, hunder og ikke-menneskelige primater. Ved å bruke CRISPR-Cas9-systemet kan det programmerte Cas9-proteinet og sgRNA introduseres direkte i befruktede zygoter for å oppnå de ønskede genmodifikasjonene når transgenmodeller opprettes hos gnagere. Dette tillater omgåelse av det vanlige cellemålrettingsstadiet for generering av transgene linjer, og som et resultat reduserer det generasjonstiden med 90%.
Et potensial som CRISPR bringer med seg sin effektivitet er anvendelse av xenotransplantasjon. I tidligere forskningsstudier demonstrerte CRISPR evnen til å målrette og eliminere endogene retrovirus, noe som reduserer risikoen for å overføre sykdommer og reduserer immunbarrierer. Å eliminere disse problemene forbedrer donororgelfunksjonen, noe som bringer denne applikasjonen nærmere en virkelighet.
I planter blir genomredigering sett på som en levedyktig løsning for bevaring av biologisk mangfold. Gendrift er et potensielt verktøy for å endre reproduksjonshastigheten til invasive arter , selv om det er betydelige forbundet risiko.
Menneskelig forbedring
Mange transhumanister ser på genomredigering som et potensielt verktøy for menneskelig forbedring . Australsk biolog og professor i genetikk David Andrew Sinclair bemerker at "den nye teknologien med genomredigering vil tillate at den kan brukes på enkeltpersoner (...) for å ha (...) sunnere barn" - designerbarn . Ifølge en rapport fra september 2016 fra Nuffield Council on Bioethics i fremtiden kan det være mulig å forbedre mennesker med gener fra andre organismer eller helt syntetiske gener for å for eksempel forbedre nattesyn og luktesans . George Church har samlet en liste over potensielle genetiske modifikasjoner for muligens fordelaktige egenskaper som mindre søvnbehov , kognisjonsrelaterte endringer som beskytter mot Alzheimers sykdom, sykdomsresistens og forbedrede læringsevner sammen med noen av de tilhørende studiene og potensielle negative effekter.
American National Academy of Sciences og National Academy of Medicine ga ut en rapport i februar 2017 med kvalifisert støtte til redigering av menneskelig genom. De anbefalte at kliniske studier for genomredigering en dag kan tillates når svar er funnet på sikkerhets- og effektivitetsproblemer "men bare for alvorlige forhold under streng tilsyn."
Risiko
I 2016 Worldwide Threat Assessment of the US Intelligence Community -uttalelsen, utpekte USAs direktør for nasjonal etterretning, James R. Clapper , genomredigering som et potensielt masseødeleggelsesvåpen , og uttalte at genomredigering utført av land med regulatoriske eller etiske standarder "forskjellig fra Vestlige land "øker sannsynligvis risikoen for dannelse av skadelige biologiske agenter eller produkter. I følge uttalelsen kan den brede distribusjonen, de lave kostnadene og det akselererte utviklingshastigheten for denne teknologien, bevisst eller utilsiktet misbruk føre til vidtrekkende økonomiske og nasjonale sikkerhetskonsekvenser. For eksempel kan teknologier som CRISPR brukes til å lage "drepende mygg" som forårsaker plager som utsletter stiftavlinger.
I følge en rapport fra Nuffield Council on Bioethics fra september 2016 , vil enkelheten og de lave kostnadene for verktøy for å redigere den genetiske koden tillate amatører - eller " biohackere " - å utføre sine egne eksperimenter, noe som utgjør en potensiell risiko ved frigjøring av genmodifiserte feil. Gjennomgangen fant også at risikoene og fordelene ved å modifisere en persons genom - og få endringene videre til fremtidige generasjoner - er så komplekse at de krever hastig etisk granskning. Slike modifikasjoner kan ha utilsiktede konsekvenser som kan skade ikke bare barnet, men også deres fremtidige barn, ettersom det endrede genet vil være i sædcellen eller eggene. I 2001 ble australske forskere Ronald Jackson og Ian Ramshaw kritisert for å ha publisert et papir i Journal of Virology som undersøkte den potensielle kontrollen av mus, et stort skadedyr i Australia, ved å infisere dem med et endret mousepox -virus som ville forårsake infertilitet som den informasjon kan føre til produksjon av biologiske våpen av potensielle bioterrorister som kan bruke kunnskapen til å lage vaksinebestandige stammer av andre koppevirus, for eksempel kopper , som kan påvirke mennesker. Videre er det ytterligere bekymringer for de økologiske risikoene ved å frigjøre genstasjoner til ville populasjoner.
Se også
- CRISPR/Cpf1
- Epigenome redigering
- Germinal choice -teknologi
- NgAgo , en ssDNA-guidet Argonaute endonuklease
Referanser
"WHO lanserer et globalt register for redigering av menneskelig genom." PharmaBiz, 31. august 2019. Gale General OneFile, åpnet 27. april 2020.
Videre lesning
- "Spesialutgave om redigering av menneskelig kimlinje" . Bioetikk . 34 . 2020.
- "Tilpassede menneskelige gener: nye løfter og farer" . Vitenskapelig amerikansk . Hentet 2019-02-21 .
- Connor S (25. april 2014). "Vitenskapelig splittelse - det menneskelige genomens gjennombrudd som deler tidligere kolleger" . The Independent . Hentet 2016-02-11 .
- "Hva er genomredigering?" . yourgenome.org . Hentet 2018-04-13 .