Streptococcus agalactiae -Streptococcus agalactiae
| Streptococcus agalactiae | |
|---|---|
|
Vitenskapelig klassifisering |
|
| Domene: | Bakterie |
| Filum: | Firmicutes |
| Klasse: | Basiller |
| Rekkefølge: | Lactobacillales |
| Familie: | Streptococcaceae |
| Slekt: | Streptococcus |
| Arter: |
S. agalactiae
|
| Binomisk navn | |
|
Streptococcus agalactiae Lehmann og Neumann, 1896
|
|
Streptococcus agalactiae (også kjent som gruppe B-streptokokker eller GBS ) er en gram-positiv coccus (rund bakterie ) med en tendens til å danne kjeder (som reflektert av slekten navn streptokokker ). Det er en beta -hemolytisk , katalase -negativ og fakultativ anaerobe .
S. agalactiae er artsbetegnelsen for de eneste streptokokkartene som tilhører gruppen B i Rebecca Lancefield -klassifiseringen av streptokokker. GBS er omgitt av en bakteriekapsel sammensatt av polysakkarider (exopolysacharide). Arten er underklassifisert i ti serotyper (Ia, Ib, II - IX) avhengig av den immunologiske reaktiviteten til deres polysakkaridkapsel. Dette er grunnen til at flertallsbegrepet gruppe B streptokokker (refererer til serotypene) og entallbetegnelsen gruppe B streptokokker (refererer til den enkelte arten) begge er vanlige.
Generelt er GBS en ufarlig kommensal bakterie som er en del av den menneskelige mikrobiota som koloniserer mage -tarm- og genitourinary -kanalen hos opptil 30% av friske voksne mennesker ( asymptomatiske bærere ). Likevel kan GBS forårsake alvorlige invasive infeksjoner, spesielt hos nyfødte, eldre og mennesker med nedsatt immunforsvar.
S. agalactiae er også et vanlig veterinærpatogen, fordi det kan forårsake storfe mastitt (betennelse i juret) hos melkekyr. Artsnavnet agalactiae betyr "ingen melk" henspiller til dette.
Laboratorieidentifikasjon
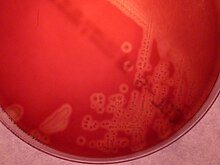
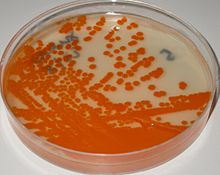
GBS vokser lett på blodagarplater som kolonier omgitt av en smal sone med β- hemolyse . GBS er preget av tilstedeværelsen i celleveggen til antigengruppe B i Lancefield -klassifisering ( Lancefield -gruppering ) som kan påvises direkte i intakte bakterier ved hjelp av latexagglutinasjonstester. Den CAMP test er også en annen viktig test for identifisering av GBS. CAMP-faktoren produsert av GBS virker synergistisk med stafylokokk β-hemolysin som induserer forbedret hemolyse av sauer eller storfe erytrocytter. GBS er også i stand til å hydrolysere hippurat, og denne testen kan også brukes til å identifisere antagelig GBS. Hemolytiske GBS-stammer produserer et oransje-murstein-rødt ikke- isoprenoid polyen (ornitin rhamnolipid) pigment ( granadaen ) når det dyrkes på granada-medium som gjør det enkelt å identifisere det. GBS kan også identifiseres ved hjelp av MALDI-TOF (Matrix Assisted Laser Desorption/Ionization-Time of Flight) instrumenter. GBS-kolonier kan i tillegg identifiseres foreløpig etter at de har vist seg i kromogene agarmedier , men GBS-lignende kolonier som utvikler seg i kromogene medier, bør bekreftes som GBS ved bruk av ytterligere pålitelige tester (eglatex-agglutinering eller CAMP-testen) for å unngå potensiell feilidentifikasjon. Et sammendrag av laboratorieteknikkene for GBS -identifikasjon er avbildet i Ref 7.
GBS -kolonisering
GBS er en normal komponent i tarm- og vaginal mikrobiota hos noen kvinner, GBS er en asymptomatisk (uten symptomer) kolonisator av mage -tarmkanalen og skjeden hos opptil 30% av ellers friske voksne, inkludert gravide. GBS -kolonisering kan være permanent, intermitterende eller midlertidig. I forskjellige studier varierer GBS vaginal koloniseringsrate fra 0%til 36%, de fleste studier rapporterer koloniseringshastigheter hos seksuelt aktive kvinner over 20%. Det har blitt estimert at mors GBS -kolonisering over hele verden er 18%, med regional variasjon fra 11%til 35%. Disse variasjonene i den rapporterte forekomsten av asymptomatisk GBS -kolonisering kan være relatert til deteksjonsmetodene som ble brukt, og forskjeller i populasjoner som ble prøvetatt.
Virulens
Som andre virulente bakterier har GBS et viktig antall virulensfaktorer (virulensfaktorer er molekyler produsert av bakterier som øker deres evne til å infisere og skade menneskelig vev), den viktigste er kapsulær polysakkarid (rik på sialinsyre ) og en pore- danner toksin , β-hemolysin. I dag anses det at GBS -pigment og hemolysin er identiske eller nært beslektede molekyler.
GBS -infeksjon hos nyfødte
GBS -kolonisering forårsaker vanligvis ikke problemer hos friske kvinner, men under graviditet kan det noen ganger forårsake alvorlig sykdom for mor og nyfødte. GBS er den viktigste årsaken til bakteriell nyfødt infeksjon hos babyen under svangerskapet og etter fødselen, med betydelig dødelighet hos premature spedbarn. GBS -infeksjoner hos moren kan forårsake chorioamnionitt (en alvorlig infeksjon i morkaken ) sjelden, postpartum infeksjoner (etter fødselen), og det hadde vært relatert til prematuritet og fosterdød. GBS urinveisinfeksjoner (UTI) kan også forårsake fødsel og forårsake for tidlig fødsel. I den vestlige verden er GBS (i mangel av effektive forebyggende tiltak) hovedårsaken til flere bakterielle infeksjoner i nyfødt nyfødt infeksjon sepsis , lungebetennelse og hjernehinnebetennelse , noe som kan føre til død eller langvarige følgetilfeller .
GBS nyfødt infeksjon stammer vanligvis fra den nedre reproduktive kanalen hos infiserte mødre. GBS-infeksjoner hos nyfødte er delt inn i to kliniske syndromer , tidlig debut sykdom (EOD) og sen debut (LOD). EOD manifesterer seg fra 0 til 7 levedager hos nyfødte, de fleste tilfellene av EOD er synlige innen 24 timer etter fødselen. De vanligste kliniske syndromene ved EOD er sepsis uten tilsynelatende fokus, lungebetennelse og sjeldnere meningitt. EOD ervervet vertikalt ( vertikal overføring ), gjennom eksponering av fosteret eller babyen for GBS fra skjeden til en kolonisert kvinne, enten intrautero eller under fødselen etter brudd på membraner. Spedbarn kan bli smittet under passering gjennom fødselskanalen, men nyfødte som får GBS gjennom denne ruten kan bare bli koloniserte, og disse koloniserte spedbarn utvikler vanligvis ikke EOD. Omtrent 50% av nyfødte til GBS -koloniserte mødre er også GBS -koloniserte, og (uten forebyggende tiltak) vil 1-2% av disse nyfødte utvikle EOD. Tidligere varierte forekomsten av EOD fra 0,7 til 3,7 per tusen levendefødte i USA og fra 0,2 til 3,25 per tusen i Europa. I 2008, etter utbredt bruk av antenatal screening og intrapartum antibiotikaprofylakse (IAP), rapporterte CDC en forekomst av 0,28 tilfeller av EOD per tusen levendefødte i USA.
Flerstatlig overvåking 2006-2015 viser en nedgang i EOD fra 0,37 til 0,23 per 1000 levendefødte i USA, men LOD forblir stabil på 0,31 per 1000 levendefødte.
Det har blitt indikert at der det var en policy for å tilby IAP for GBS -koloniserte mødre, er den totale risikoen for EOGBS 0,3%. Siden 2006 til 2015 falt forekomsten av GBS EOD fra 0,37 til 0,23 per tusen levendefødte i USA.
Selv om mors GBS -kolonisering er nøkkeldeterminanten for EOD, øker også andre faktorer risikoen. Disse faktorene inkluderer fødsel før 37 ukers svangerskap ( prematur fødsel ), langvarig ruptur av membraner (≥18 timer før fødsel), intrapartum feber (> 38 ° C,> 100,4 ° F), fostervanninfeksjoner (chorioamnionitt), unge mors alder og lave nivåer av GBS antikapsulære polysakkaridantistoffer hos moren. Likevel er de fleste babyer som utvikler EOD født av GBS -koloniserte mødre uten ekstra risikofaktor. Et tidligere søsken med EOD er også en viktig risikofaktor for utvikling av infeksjonen ved påfølgende fødsler, noe som sannsynligvis gjenspeiler mangel på GBS -polysakkarider beskyttende antistoffer hos moren. Tung GBS vaginal kolonisering er også forbundet med en høyere risiko for EOD. Totalt sett har dødeligheten mellom tilfeller og dødsfall fra EOD gått ned, fra 50% observert i studier fra 1970 -tallet til 2 til 10% de siste årene, hovedsakelig som en konsekvens av forbedringer i terapi og behandling. Dødelige nyfødte infeksjoner av GBS er hyppigere blant premature spedbarn.
GBS LOD påvirker spedbarn fra 7 dager til 3 måneders alder og er mer sannsynlig å forårsake bakteriemi eller hjernehinnebetennelse. LOD kan skaffes fra moren eller fra miljøkilder. Hørselstap og psykisk svekkelse kan være en langsiktig oppfølging av GBS-meningitt. I motsetning til EOD har forekomsten av LOD vært uendret på 0,26 per 1000 levendefødte i USA. S. agalactiae nyfødt hjernehinnebetennelse viser ikke kjennetegn på voksen hjernehinnebetennelse, stiv nakke; den gir heller uspesifikke symptomer , som feber, oppkast og irritabilitet, og kan derfor føre til en sen diagnose.
Forebygging av nyfødt infeksjon
Den eneste pålitelige måten å forhindre EOD på er intrapartum antibiotisk profylakse (IAP), det vil si administrering av antibiotika under levering. Det er bevist at intravenøs penicillin eller ampicillin administrert i minst 4 timer før levering til GBS -koloniserte kvinner, er svært effektivt for å forhindre vertikal overføring av GBS fra mor til baby og EOD. Intravenøs penicillin er fortsatt det foretrukne middelet for IAP, med intravenøs ampicillin som et akseptabelt alternativ. For penicillinallergiske kvinner bør laboratoriekravene for bestilling av GBS -screeningskulturer før ankomsten vise tydelig at det er penicillinallergi. Cefazolin , clindamycin og vancomycin brukes for å forhindre EOD hos spedbarn født av penicillinallergiske mødre. Intravenøs vankomycin anbefales for IAP hos kvinner kolonisert med en clindamycinresistent gruppe B Streptococcus-stamme og alvorlig penicillinallergi.
Det er to måter å identifisere kvinnelige kandidater for å få intrapartum antibiotika profylakse: en risikobasert tilnærming eller en kulturbasert screeningmetode. Den kulturbaserte screeningmetoden identifiserer kandidater til å motta IAP ved bruk av lavere vaginale og rektale kulturer oppnådd mellom 36 og 37 ukers svangerskap (32–34 ukers svangerskap for kvinner med tvillinger), og IAP administreres til alle GBS-koloniserte kvinner. Den risikobaserte strategien identifiserer kandidater til å motta IAP av de nevnte risikofaktorene som er kjent for å øke sannsynligheten for EOD uten å vurdere om moren er GBS-bærer eller ikke.
IAP anbefales også for kvinner med intrapartum risikofaktorer hvis deres GBS -bærerstatus ikke er kjent på leveringstidspunktet, for kvinner med GBS -bakteriuri under graviditeten og for kvinner som har hatt et spedbarn med EOD tidligere.
Den risikobaserte tilnærmingen for IAP er generelt mindre effektiv enn den kulturbaserte tilnærmingen fordi EOD i de fleste tilfeller utvikler seg blant nyfødte, som er født av mødre uten risikofaktorer.
I 2010 ga Centers for Disease Control and Prevention (CDC), i samarbeid med flere faggrupper, sine reviderte retningslinjer for forebygging av GBS.
I 2018 ble oppgaven med å revidere og oppdatere GBS -profylakse -retningslinjene overført fra CDC til ACOG ( American College of Obstetricians and Gynecologists ), American Academy of Pediatrics og til American Society for Microbiology.
ACOG-komiteen ga ut et oppdateringsdokument om forebygging av gruppe B Streptococcal tidlig debut hos nyfødte i 2019. Dette dokumentet innfører ikke viktige endringer fra CDC-retningslinjene. De viktigste tiltakene som er nødvendige for å forhindre nyfødt GBS tidlig debut sykdom er fortsatt universell prenatal screening ved dyrking av GBS fra vattpinner samlet ned fra nedre vagina og endetarm, korrekt innsamling og mikrobiologisk behandling av prøvene og riktig implementering av intrapartum antibiotika profylakse. ACOG anbefaler nå å utføre universell GBS -screening mellom 36 og 37 ukers svangerskap. Denne nye anbefalingen gir et fem-ukers vindu for gyldige kulturresultater som inkluderer fødsler som oppstår opptil en svangerskapsalder på minst 41 uker.
Den kulturbaserte screeningmetoden følges i de fleste utviklede land som USA, Frankrike, Spania, Belgia, Canada, Argentina og Australia. Den risikobaserte strategien følges i Storbritannia og Nederland.
Screening for GBS -kolonisering
Selv om GBS -koloniseringsstatus for kvinner kan endres under graviditet, forutsier kulturer for å oppdage GBS utført ≤5 uker før levering ganske nøyaktig GBS -bærerstatus ved levering.
Hvis den prenatale kulturen derimot utføres mer enn fem uker før levering, er det upålitelig for nøyaktig å forutsi GBS -bærerstatus ved levering.
De kliniske prøvene som anbefales for kultur av GBS ved 36–37 ukers svangerskap, gir denne anbefalingen et 5-ukers vindu for gyldige kulturresultater som inkluderer fødsler som oppstår opp til en svangerskapsalder på minst 41 uker (32–34 uker med svangerskap) for kvinner med tvillinger) er vattpinner samlet den nedre skjeden (nær introitus) og deretter fra endetarmen (gjennom analsfinkteren) uten bruk av spekulum. Prøver fra vaginal-rektal bør samles ved bruk av en strømpinne, fortrinnsvis siden flokkede vattpinner frigjør prøver og mikroorganismer mer effektivt enn fiberpinner.
Etter anbefalingene fra Centers for Disease Control and Prevention of United States (CDC), bør disse vattpinnene plasseres i et ikke-næringsrikt transportmedium og senere inokuleres i en selektiv anrikningsbuljong, Todd Hewitt-kjøttkraft med selektive antibiotika ( berikelseskultur ). Etter inkubasjon blir anrikningsbuljongen subkultivert til blodagarplater og GBS -lignende kolonier identifiseres ved CAMP -testen eller ved bruk av latexagglutinering med GBS antisera . Etter inkubasjon kan berikelsesbuljongen også subkultureres til granada medium agar der GBS vokser som rosa-røde kolonier eller til kromogene agarer, hvor GBS vokser som fargede kolonier.
GBS-lignende kolonier som utvikler seg i kromogene medier, bør bekreftes som GBS ved å bruke ytterligere pålitelige tester for å unngå feilidentifikasjon.
Nukleinsyreforsterkningstester (NAAT) som polymerasekjedereaksjon (PCR) og DNA- hybridiseringsprober er utviklet for å identifisere GBS direkte fra rekto-vaginale prøver, men de kan fortsatt ikke erstatte antenatal kultur for den mest nøyaktige påvisning av GBS-bærere.
Intrapartum NAAT uten berikelse har en høy falsk negativ rate og bruk av intrapartum NAAT uten berikelse for å utelukke behovet for IAP.
Vaksinasjon
Selv om IAP for EOD-forebygging er assosiert med en stor nedgang i forekomsten av sykdommen, er det imidlertid ingen effektiv strategi for å forhindre sen debut av nyfødt GBS-sykdom.
Vaksinasjon anses som en ideell løsning for å forhindre ikke bare EOD og LOD, men også GBS -infeksjoner hos voksne i fare. Selv om forskning og kliniske studier for utvikling av en effektiv vaksine for å forhindre GBS -infeksjoner pågår, var ingen vaksine tilgjengelig i 2020. Kapselpolysakkarid av GBS er ikke bare en viktig GBS -virulensfaktor, men det er også en utmerket kandidat for utvikling av en effektiv vaksine. Proteinbaserte vaksiner er også under utvikling.
GBS -infeksjon hos voksne
GBS er også et viktig smittestoff som kan forårsake invasive infeksjoner hos voksne. Alvorlige livstruende invasive GBS-infeksjoner blir stadig mer kjent blant eldre og personer som er utsatt for underliggende sykdommer som diabetes, skrumplever og kreft. GBS-infeksjoner hos voksne inkluderer urinveisinfeksjon, hud- og bløtvevsinfeksjon ( hud- og hudstrukturinfeksjon ) bakteremi, osteomyelitt , meningitt og endokarditt . GBS -infeksjon hos voksne kan være alvorlig og relatert til høy dødelighet. Generelt er penicillin det antibiotikumet du velger for behandling av GBS -infeksjon. Gentamicin (for synergi med penicillin G eller ampicillin) kan også brukes hos pasienter med livstruende invasiv GBS.
Ikke -menneskelige infeksjoner
I tillegg til infeksjoner hos mennesker er GBS en hovedårsak til mastitt (en infeksjon i juret ) hos melkekveg og en viktig kilde til økonomisk tap for industrien. GBS hos kyr kan enten produsere en akutt febersykdom eller en subakutt mer kronisk tilstand . Begge fører til redusert melkeproduksjon (derav navnet: agalactiae som betyr "uten melk"). Utbrudd i besetninger er vanlige, så dette er av stor betydning for meieriindustrien , og programmer for å redusere effekten av S. agalactiae sykdom har blitt håndhevet i mange land de siste 40 årene.
GBS forårsaker også alvorlige epidemier hos oppdrettsfisk, forårsaker sepsis og ytre og indre blødninger, etter å ha blitt rapportert fra vill og fanget fisk involvert i epizootier i mange land. Vaksinasjon er en effektiv metode for å forhindre patogene sykdommer i havbruk og forskjellige typer vaksiner for å forhindre GBS -infeksjoner har blitt utviklet nylig.
GBS har også blitt funnet hos mange andre dyr, for eksempel kameler, hunder, katter, krokodiller, seler, elefanter og delfiner.