Lambda fag - Lambda phage
| Escherichia -virus Lambda | |
|---|---|

|
|
| Elektronmikrograf av en viruspartikkel av arten Escherichia -virus Lambda | |
|
Virusklassifisering |
|
| (uten rangering): | Virus |
| Rike : | Duplodnaviria |
| Kongedømme: | Heunggongvirae |
| Filum: | Uroviricota |
| Klasse: | Caudoviricetes |
| Rekkefølge: | Caudovirales |
| Familie: | Siphoviridae |
| Slekt: | Lambdavirus |
| Arter: |
Escherichia -virus Lambda
|
Enterobacteria phage λ ( lambda phage , coliphage λ , offisielt Escherichia virus Lambda ) er et bakterievirus, eller bakteriofag , som infiserer bakteriearten Escherichia coli ( E. coli ). Det ble oppdaget av Esther Lederberg i 1950. Villtypen til dette viruset har en temperert livssyklus som gjør at det enten kan bo i genomet til verten gjennom lysogeni eller gå inn i en lytisk fase, hvor det dreper og lyserer cellen til produsere avkom. Lambda -stammer, mutert på spesifikke steder, klarer ikke å lysogenisere celler; i stedet vokser de og går inn i den lytiske syklusen etter å ha superinfisert en allerede lysogenisert celle.
Fagpartikkelen består av et hode (også kjent som et kapsid ), en hale og halefibre (se bildet av virus nedenfor). Hodet inneholder fagens dobbeltstrengede lineære DNA- genom. Under infeksjon gjenkjenner og binder fagpartikkelen seg til verten, E. coli , noe som forårsaker at DNA i fagets hode blir kastet ut gjennom halen inn i cytoplasma i bakteriecellen. Vanligvis oppstår en " lytisk syklus ", hvor lambda -DNAet replikeres og nye fagpartikler produseres i cellen. Dette etterfølges av cellelyse , som frigjør celleinnholdet, inkludert virioner som er montert, i miljøet. Under visse betingelser kan imidlertid fag -DNA integrere seg i vertscellekromosomet i den lysogene banen. I denne tilstanden kalles λ -DNA en profet og forblir bosatt i vertens genom uten tilsynelatende skade på verten. Verten kalles et lysogen når en profag er tilstede. Denne profagen kan gå inn i den lytiske syklusen når lysogenet går inn i en stresset tilstand.
Anatomi
Viruspartikkelen består av et hode og en hale som kan ha halefibre. Hele partikkelen består av 12–14 forskjellige proteiner med mer enn 1000 proteinmolekyler totalt og ett DNA -molekyl plassert i faghodet. Imidlertid er det fortsatt ikke helt klart om L- og M -proteinene er en del av virionen. Alle karakteriserte lambdoidfager har en N-protein-mediert transkripsjon antitermineringsmekanisme, med unntak av fag HK022
Den genom inneholder 48,490 basepar av dobbeltkjedet, lineært DNA, med 12-base enkelttråds segmenter i begge 5' ender. Disse to enkeltstrengede segmentene er de "klissete endene" av det som kalles cos- stedet. Den cos nettstedet circularizes DNA i verts cytoplasma. I sin sirkulære form er faggenomet derfor 48.502 basepar i lengde. Lambda -genomet kan settes inn i E. coli -kromosomet og kalles deretter en profagi. Se avsnittet nedenfor for detaljer.
Livssyklus
Infeksjon
Lambda-fag er en ikke-kontraktil halefag, noe som betyr at den under en infeksjon ikke kan "tvinge" DNA-en gjennom en bakteriell cellemembran. Den må i stedet bruke en eksisterende vei for å invadere vertscellen, etter å ha utviklet spissen av halen til å samhandle med en bestemt pore for å tillate innføring av DNA til vertene.
- Bakteriofag Lambda binder seg til en E. coli -celle ved hjelp av sitt J -protein i halespissen. J -proteinet interagerer med maltose ytre membran porin (produktet av lamB genet) til E. coli , et porin molekyl, som er en del av maltose operon.
- Det lineære faggenomet injiseres gjennom den ytre membranen.
- DNA passerer gjennom mannose-permeasekomplekset i den indre membranen (kodet av manXYZ-genene) og sirkulerer umiddelbart ved hjelp av cos- stedene, 12-baserte GC-rike sammenhengende "klebrige ender". Enstrengede virale DNA-ender ligeres av vert- DNA-ligase . Det er ikke generelt forstått at de 12 bp lambda kohesive ender var gjenstand for den første direkte nukleotidsekvensering av et biologisk DNA.
- Vert- DNA-gyrase setter negative supercoils i det sirkulære kromosomet, noe som får AT-rike regioner til å slappe av og drive transkripsjon.
- Transkripsjon starter fra det konstitutive P l , P- R og P R' fremmere som produserer de 'immediate early' transkripter. Først uttrykker disse N- og cro -genene, og produserer N, Cro og et kort inaktivt protein.
- Cro binder seg til OR3 , forhindrer tilgang til P RM -promotoren, forhindrer ekspresjon av cI -genet. N binder seg til to mutter (N utnyttelse) områder, ett i det N -genet i den P- L- leserammen, og en i cro -genet i den P- R -leserammen.
- N -proteinet er en antiterminator og fungerer ved å engasjere transkriberende RNA -polymerase på spesifikke steder i det nascently transkriberte mRNA. Når RNA -polymerase transkriberer disse områdene, rekrutterer det N og danner et kompleks med flere verts -Nus -proteiner. Dette komplekset hopper gjennom de fleste avslutningssekvensene. De utvidede transkripsjonene (de 'sene tidlige' transkripsjonene) inkluderer N- og cro -genene sammen med cII- og cIII -gener, og xis , int , O , P og Q -gener diskutert senere.
- Den cIII proteinet virker til å beskytte cll proteinet fra proteolyse av FtsH (en membranbundet essensielle E . Coli protease) ved å virke som en konkurrerende inhibitor. Denne inhiberingen kan indusere en bakteriostatisk tilstand, som favoriserer lysogeni. cIII stabiliserer også direkte cII -proteinet.
Ved første infeksjon bestemmer stabiliteten til cII livsstilen til faget; stabil cII vil føre til den lysogene banen, mens hvis cII brytes ned, vil fagen gå inn i den lytiske banen. Lav temperatur, sult av cellene og høy infeksjonsmengde (MOI) er kjent for å favorisere lysogeni (se senere diskusjon).
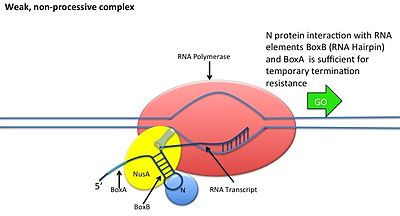
N antitermination
Dette skjer uten at N -proteinet interagerer med DNA; proteinet binder seg i stedet til det fersk transkriberte mRNA. Nøttesteder inneholder 3 konserverte "esker", hvorav bare BoxB er avgjørende.
- BoxB RNA -sekvensene er plassert nær 5' -enden av pL- og pR -transkripsjonene. Når de transkriberes, danner hver sekvens en hårnålesløyfestruktur som N -proteinet kan binde seg til.
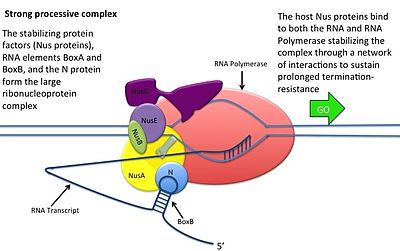
- N -protein binder seg til boks B i hvert transkripsjon, og kontakter den transkriberende RNA -polymerasen via RNA -looping. N-RNAP-komplekset stabiliseres ved påfølgende binding av flere vert Nus (N utnyttelsesstoff) proteiner (som inkluderer transkripsjonsterminering/antitermineringsfaktorer og, bisarrt, en ribosomunderenhet).
- Hele komplekset (inkludert det bundne mutterstedet på mRNA) fortsetter transkripsjon og kan hoppe gjennom avslutningssekvenser.
Lytisk livssyklus

Dette er livssyklusen som fagen følger etter de fleste infeksjoner, der cII -proteinet ikke når en høy nok konsentrasjon på grunn av nedbrytning, så det aktiverer ikke promotorene.
- De 'sene tidlige' transkripsjonene fortsetter å bli skrevet, inkludert xis , int , Q og gener for replikasjon av lambda -genomet ( OP ). Cro dominerer repressorstedet (se "Repressor" -delen ), og undertrykker syntese fra P RM -promotoren (som er en promotor for den lysogene syklusen).
- O- og P -proteinene starter replikasjon av fagkromosomet (se "Lytisk replikasjon").
- Q, en annen antiterminator , binder seg til Qut -nettsteder .
- Transkripsjon fra P R' -promotoren kan nå strekke seg til å produsere mRNA for lysis og hode- og hale -proteiner.
- Strukturelle proteiner og faggenomer samler seg selv til nye fagpartikler.
- Produkter av genene S , R , Rz og Rz1 forårsaker cellelyse. S er et holin , et lite membranprotein som på et tidspunkt bestemt av proteinets sekvens plutselig lager hull i membranen. R er et endolysin , et enzym som rømmer gjennom S -hullene og klyver celleveggen. Rz og Rz1 er membranproteiner som danner et kompleks som på en eller annen måte ødelegger den ytre membranen, etter at endolysinet har degradert celleveggen. For villtype lambda oppstår lyse omtrent 50 minutter etter infeksjonsstart og frigjør rundt 100 virioner.
Transkripsjon til høyre
Transkripsjon til høyre uttrykker O- , P- og Q -genene. O og P er ansvarlige for å starte replikasjon, og Q er en annen antiterminator som tillater uttrykk for hode-, hale- og lyseringsgener fra P R ' .
Lytisk replikasjon
- I de første replikasjonssyklusene gjennomgår lambda-genomet θ replikasjon (sirkel-til-sirkel).
- Dette initieres på ori -stedet som ligger i O -genet. O -protein binder ori -stedet , og P -protein binder DnaB -underenheten til vertsreplikasjonsmaskinen samt binding O. Dette kommanderer effektivt vert -DNA -polymerasen.
- Snart bytter fagen til en replikering av en rullende sirkel som ligner den som brukes av fag M13. DNA er nicked og 3' -enden fungerer som en primer. Vær oppmerksom på at dette ikke frigjør enkeltkopier av faggenomet, men et langt molekyl med mange kopier av genomet: en concatemer .
- Disse concatemerne spaltes på cos -stedene når de pakkes. Emballasje kan ikke skje fra sirkulær fag -DNA, bare fra konkatomerisk DNA.
Q antitermination
Q er lik N i sin virkning: Q binder seg til RNA -polymerase på Qut -steder og det resulterende komplekset kan ignorere terminatorer, men mekanismen er veldig forskjellig; Q -proteinet assosierer først med en DNA -sekvens i stedet for en mRNA -sekvens.
- Den QUT området er svært nær den P R' promoter, nær nok til at σ faktor ikke er blitt frigjort fra det RNA-polymerase holoenzym. En del av Qut -nettstedet ligner -10 Pribnow -boksen , noe som får holoenzymet til å stoppe.
- Q-protein bindes og fortrenges deretter en del av σ-faktoren og transkripsjonen starter på nytt.
- Hodet og halen gener transkriberes og de tilsvarende proteinene samles selv.
Transkripsjon til venstre
Transkripsjon til venstre uttrykker gam- , rød- , xis- og int -gener. Gam og røde proteiner er involvert i rekombinasjon. Gam er også viktig ved at det hemmer verten RecBCD -nukleasen fra å forringe 3' -endene i rullende sirkelreplikasjon. Int og xis er integrerings- og eksisjonsproteiner avgjørende for lysogeni.
xis og int regulering av innsetting og eksisjon
- xis og int finnes på samme stykke mRNA, så det produseres omtrent like store konsentrasjoner av xis og int proteiner. Dette resulterer (i utgangspunktet) i eksisjon av eventuelle innsatte genomer fra vertsgenomet.
- MRNA fra P- L -promoteren danner en stabil sekundærstruktur med en stilk-løkke i den sib -delen av mRNA. Dette er rettet mot 3 '( sib ) enden av mRNA for RNAaseIII nedbrytning, noe som resulterer i en lavere effektiv konsentrasjon av int mRNA enn xis mRNA (ettersom int cistron er nærmere sib -sekvensen enn xis cistron er til sib -sekvensen) , så en høyere konsentrasjon av xis enn int blir observert.
- Høyere konsentrasjoner av xis enn int resulterer i ingen innsetting eller utskæring av faggener, den evolusjonært begunstigede handlingen - slik at alle forhåndsinstruerte faggener settes inn (slik reduserer konkurransen) og forhindrer innsetting av faggenomet i genomet til en dødsdømt vert.
Lysogen (eller lysenogen) livssyklus
Den lysogene livssyklusen begynner når cI -proteinet når en høy nok konsentrasjon for å aktivere promoterne etter et lite antall infeksjoner.
- De 'sene tidlige' transkripsjonene fortsetter å bli skrevet, inkludert xis , int , Q og gener for replikasjon av lambda -genomet.
- Den stabiliserte cll virker til å fremme transkripsjon fra P RE , P I og P antiq aktivatorer.
- Den P antiq promoteren produserer antisense mRNA til den Q -genet meldingen av P- R -promoteren transkripsjon, hvilket kobler ut Q produksjon. Den P RE -promoteren produserer antisense mRNA til cro-delen av P- R -promoteren transkript, å slå ned cro-produksjon, og har en transkripsjon av cl- genet. Dette kommer til uttrykk ved å slå på cI -repressorproduksjon. Den P I promoter uttrykker int -genet, som resulterer i høye konsentrasjoner av Int protein. Dette int -proteinet integrerer fag -DNA i vertskromosomet (se "Profagintegrasjon").
- Det er ingen Q gir ingen forlengelse av P R' promoter leseramme, slik at ingen lytiske eller strukturelle proteiner er gjort. Forhøyede nivåer av int (mye høyere enn xis) resulterer i innsetting av lambda -genomet i vertsgenomet (se diagram). Produksjon av Ci fører til bindingen av cl til OR1 og OR2 områder i P- R -promoteren, slå av cro og andre tidlig genekspresjon. cl også binder seg til de P- L -promoteren, dreiing av transkripsjon der også.
- Mangel på cro forlater OR3 -stedet ubundet, så transkripsjon fra P RM -promotoren kan forekomme, og opprettholder nivåene av cI.
- Mangel på transkripsjon fra P l og P R promotorer fører til ingen ytterligere produksjon av CII og cIII.
- Etter hvert som cII- og cIII -konsentrasjonene reduseres, slutter transkripsjon fra P antiq , P RE og P I å bli promotert siden de ikke lenger er nødvendige.
- Bare P RM og P R' -promotorene er igjen aktive, førstnevnte produserer cI -protein og sistnevnte et kort inaktivt transkript. Genomet forblir innsatt i vertsgenomet i en sovende tilstand.
Profetien dupliseres med hver påfølgende celledeling av verten. Fagenene uttrykt i denne sovende tilstandskoden for proteiner som undertrykker ekspresjon av andre faggener (for eksempel struktur- og lyseringsgenene) for å forhindre inntreden i den lytiske syklusen. Disse undertrykkende proteiner brytes ned når vertscellen er under stress, noe som resulterer i uttrykk for de undertrykte faggenene. Stress kan skyldes sult , giftstoffer (som antibiotika ) eller andre faktorer som kan skade eller ødelegge verten. Som svar på stress blir den aktiverte profagen fjernet fra vertencellens DNA av et av de nylig uttrykte genproduktene og går inn i den lytiske banen.
Profetintegrasjon
Integreringen av fag λ skjer på et spesielt festested i bakterie- og faggenomet, kalt att λ . Sekvensen av bakterie att området kalles attB , mellom gal og bio operoner, og består av deler BO-B 'mens den komplementære sekvens i den sirkulære fag-genomet er kalt attP og består av delene PO-P'. Selve integrasjonen er en sekvensiell utveksling (se genetisk rekombinasjon ) via et Holliday -kryss og krever både fagproteinet Int og bakterieproteinet IHF ( integrasjonsvertsfaktor ). Både Int og IHF binder seg til attP og danner et intasome, et DNA-proteinkompleks designet for stedsspesifikk rekombinasjon av fag- og vert-DNA. Den opprinnelige BOB-sekvensen endres ved integrasjonen til BO-P'-fag DNA-PO-B '. Fag -DNA er nå en del av vertens genom.
Vedlikehold av lysogeni
- Lysogeni opprettholdes utelukkende av cI. cl undertrykker transkripsjon fra P l og P R samtidig oppregulering og styre sin egen ekspresjon fra P RM . Det er derfor det eneste proteinet uttrykt av lysogen fag.
- Dette koordineres av P L og P R operatørene. Begge operatører har tre bindingsseter for CI: OL1 , OL2 , og OL3 for P L , og OR1 , OR2 og OR3 for P R .
- cI binder seg best til OR1 ; binding her hemmer transkripsjon fra P R . Etter hvert som cI lett dimererer, øker bindingen av cI til OR1 sterkt affiniteten til bindingen av cI til OR2 , og dette skjer nesten umiddelbart etter OR1 -bindingen. Dette aktiverer transkripsjon i den andre retningen fra P RM , ettersom N -terminaldomenet til cI på OR2 strammer bindingen av RNA -polymerase til P RM og dermed stimulerer cI sin egen transkripsjon. Når den er tilstede i en mye høyere konsentrasjon, binder den seg også til OR3 , og hemmer transkripsjon fra P RM , og regulerer dermed sine egne nivåer i en negativ tilbakemeldingsløkke.
- cl-binding til P L operatøren er svært like, bortsett fra at den ikke har noen direkte effekt på cl-transkripsjon. Som en ytterligere undertrykkelse av sitt eget uttrykk bøyer imidlertid cI -dimerer bundet til OR3 og OL3 DNA mellom dem for å tetramerisere.
- Tilstedeværelsen av cl fører til immunitet overfor super av andre lambda-fag, som det vil hemme deres P l og P- R- aktivatorer.
Induksjon
Den klassiske induksjonen av et lysogen involverte bestråling av de infiserte cellene med UV -lys. Enhver situasjon der et lysogen gjennomgår DNA -skade eller SOS -responsen til verten ellers blir stimulert, fører til induksjon.
- Vertscellen, som inneholder et sovende faggenom, opplever DNA -skade på grunn av et høyt stressmiljø, og begynner å gjennomgå SOS -responsen .
- RecA (et cellulært protein) oppdager DNA -skade og blir aktivert. Det er nå RecA*, en svært spesifikk co-protease.
- Normalt binder RecA* LexA (en transkripsjonsrepressor ), og aktiverer LexA-autoproteaseaktivitet, som ødelegger LexA-repressoren, slik at produksjon av DNA-reparasjonsproteiner tillates . I lysogene celler blir denne responsen kapret, og RecA* stimulerer cI autocleavage. Dette er fordi cI etterligner strukturen til LexA på autocleavage -stedet.
- Spaltet cI kan ikke lenger dimeriseres, og mister sin affinitet for DNA -binding.
- De P- R og P- L- promotere er ikke lenger undertrykket og slå den på, og cellen går tilbake til den lytiske sekvensen av hendelser uttrykk (merk at CII er ikke stabil i celler som gjennomgår SOS respons). Det er imidlertid en bemerkelsesverdig forskjell.
Kontroll av faggenomseksjon ved induksjon
- Faggenomet er fortsatt satt inn i vertsgenomet og trenger eksisjon for at DNA -replikasjon skal skje. Den sib seksjonen som overskrider normal P L promoter transkripsjon er, imidlertid, ikke lenger er inkludert i denne leseramme (se diagram).
- Ingen sib domene på P- L -promoteren mRNA fører ikke til noen hårnålsløyfe på 3'-enden, og den transkriptet ikke lenger er målrettet for RNAaseIII degradering.
- Det nye intakte transkriptet har én kopi av både xis og int , så det produseres omtrent like store konsentrasjoner av xis- og int -proteiner.
- Like konsentrasjoner av xis og int resulterer i utskæring av det innsatte genomet fra vertsgenomet for replikasjon og senere fagproduksjon.
Flerfaldsreaktivering og profagreaktivering
Multiplicity reactivation (MR) er prosessen der flere virale genomer, som hver inneholder inaktiverende genomskader, interagerer i en infisert celle for å danne et levedyktig viralt genom. MR ble opprinnelig oppdaget med fag T4, men ble senere funnet i fag λ (så vel som i mange andre bakterielle og pattedyrvirus). MR av fag λ inaktivert av UV -lys avhenger av rekombinasjonsfunksjonen til enten verten eller den infiserende fagen. Fravær av begge rekombinasjonssystemer fører til tap av MR.
Overlevelse av UV-bestrålet fag λ økes når E. coli-verten er lysogen for en homolog profag, et fenomen som kalles profagreaktivering. Profagreaktivering i fag λ ser ut til å skje ved en rekombinasjonell reparasjonsprosess som ligner på MR.
Repressor
Den repressor funnet i fag lambda er et bemerkelsesverdig eksempel på den grad av kontroll er mulig over genekspresjon av et meget enkelt system. Den danner en 'binær bryter' med to gener under gjensidig utelukkende uttrykk, som oppdaget av Barbara J. Meyer .
Lambda -repressorgensystemet består av (fra venstre til høyre på kromosomet):
- cI -genet
- O R 3
- O R 2
- O R 1
- cro -genet
Lambda -repressoren er en selvmonterende dimer, også kjent som cI -proteinet . Det binder DNA i helix-turn-helix-bindingsmotivet. Det regulerer transkripsjonen av cI -proteinet og Cro -proteinet.
Livssyklusen til lambda -fager styres av cI- og Cro -proteiner. Lambda -fagen vil forbli i lysogen tilstand hvis cI -proteiner dominerer, men vil bli transformert til den lytiske syklusen hvis cro -proteiner dominerer.
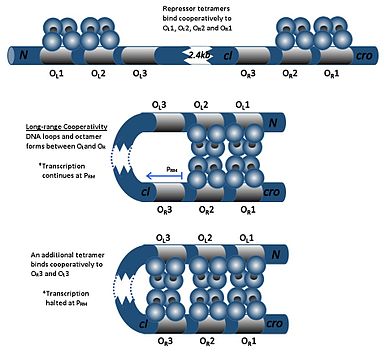
CI -dimeren kan binde seg til hvilken som helst av tre operatorer, O R 1, O R 2 og O R 3, i rekkefølgen O R 1> O R 2> O R 3. Binding av en cI -dimer til O R 1 øker bindingen av en andre cI -dimer til O R2 , en effekt som kalles kooperativitet . Dermed blir O R 1 og O R 2 nesten alltid samtidig okkupert av cI. Dette øker imidlertid ikke affiniteten mellom cI og O R3 , som bare vil opptas når cI -konsentrasjonen er høy.
Ved høye konsentrasjoner av cI vil dimererene også binde seg til operatorer O L 1 og O L 2 (som er over 2 kb nedstrøms fra R -operatorene). Når cI -dimerer er bundet til O L 1, O L 2, O R 1 og O R 2 induseres en sløyfe i DNA, slik at disse dimerer kan bindes sammen for å danne en oktamer. Dette er et fenomen som kalles langdistansesamarbeid . Etter dannelse av oktamer, kan ci dimerer samvirkende binde til O L 3 og O R 3, undertrykke transkripsjon av cl. Denne autonegative reguleringen sikrer en stabil minimumskonsentrasjon av repressormolekylet, og hvis SOS -signaler oppstår, muliggjør det mer effektiv profaginduksjon.
- I fravær av cI -proteiner kan cro -genet transkriberes.
- I nærvær av cI -proteiner kan bare cI -genet transkriberes.
- Ved høy konsentrasjon av cI blir transkripsjoner av begge genene undertrykt.
Oversikt over proteinfunksjoner
| Protein | Funksjon i livssyklus | Arrangørregion | Beskrivelse |
|---|---|---|---|
| cIII | Regulerende protein CIII. Lysogeni, cII Stabilitet | P L | (Clear 3) HflB (FtsH) bindende protein, beskytter cII mot nedbrytning av proteaser. |
| cII | Lysogeni, transkripsjonsaktivator | P R | (Clear 2) Aktiverer transkripsjon fra P AQ- , P RE- og P I -promotorene, transkriberer cI og int . Lav stabilitet på grunn av følsomhet for cellulære HflB (FtsH) proteaser (spesielt i friske celler og celler som gjennomgår SOS -respons). Høye nivåer av cII vil presse fagen mot integrering og lysogeni, mens lave nivåer av cII vil resultere i lysering. |
| cI | Repressor, vedlikehold av Lysogeny | P RM , P RE | (Clear 1) Transkripsjonshemmer, binder O R 1, O R 2 og O R 3 (affinitet O R 1> O R 2 = O R 3, dvs. binder fortrinnsvis O R 1). Ved lave konsentrasjoner blokkerer P- R -promoteren (hindring av cro-produksjon). Ved høye konsentrasjoner nedregulerer sin egen produksjon gjennom O R 3 -binding. Repressor også hemmer transkripsjon fra P- L -promoteren. Følsom for spaltning av RecA * i celler som gjennomgår SOS -responsen. |
| cro | Lysis, kontroll av repressorens operatør | P R | Transkripsjonsinhibitor, binder O R 3, O R 2 og O R 1 (affinitet O R 3> O R 2 = O R 1, dvs. fortrinnsvis binder O R 3). Ved lave konsentrasjoner blokkerer pRM -promotoren (forhindrer cI -produksjon). Ved høye konsentrasjoner nedregulerer sin egen produksjon gjennom O R 2 og O R 1 binding. Ingen kooperativ binding (se nedenfor for cI -binding) |
| O | Lysis, DNA -replikasjon | P R | Replikasjonsprotein O. Starter Phage Lambda DNA -replikasjon ved binding på ori -stedet . |
| P | Lysis, DNA -replikasjon | P R | Initierer Phage Lambda DNA -replikasjon ved binding til O- og DnaB -underenhet. Disse bindingene gir kontroll over vert -DNA -polymerasen. |
| gam | Lysis, DNA -replikasjon | P L | Hindrer vert RecBCD -nuklease fra å forringe 3' -ender - la replikering av rullende sirkler fortsette. |
| S | Lysis | P R ' | Holin , et membranprotein som perforerer membranen under lysis. |
| R | Lysis | P R ' | Endolysin , Lysozym, et enzym som går ut av cellen gjennom hullene som produseres av Holin og klyver celleveggen fra hverandre. |
| Rz og Rz1 | Lysis | P R ' | Danner et membranproteinkompleks som ødelegger den ytre cellemembranen etter nedbrytning av celleveggen av endolysin. Spanin, Rz1 (ytre membranenhet) og Rz (indre membranenhet). |
| F | Lysis | P R ' | Fagkapsidhodeproteiner. |
| D | Lysis | P R ' | Hodedekorasjonsprotein. |
| E | Lysis | P R ' | Stort hodeprotein. |
| C | Lysis | P R ' | Mindre kapsidprotein. |
| B | Lysis | P R ' | Portalprotein B. |
| EN | Lysis | P R ' | Stort terminase -protein. |
| J | Lysis | P R ' | Vertsspesifisitet protein J. |
| MVUGLTZ | Lysis | P R ' | Mindre haleprotein M. |
| K | Lysis | P R ' | Sannsynligvis endopeptidase. |
| H | Lysis | P R ' | Hale målebånd protein H. |
| Jeg | Lysis | P R ' | Hale samling protein I. |
| FI | Lysis | P R ' | DNA-pakningsprotein FI. |
| FII | Lysis | P R ' | Hale festeprotein. |
| tfa | Lysis | P R ' | Hale fiber samling protein. |
| int | Genomintegrasjon, eksisjon | P I , P L | Integrase , administrerer innsetting av faggenomet i vertens genom. I tilstander med lav int konsentrasjon er det ingen effekt. Hvis xis er lav i konsentrasjon og int høy, fører dette til innsetting av faggenomet. Hvis xis og int har høye (og tilnærmet like) konsentrasjoner, fører dette til utskæring av faggener fra vertens genom. |
| xis | Genome Excision | P I , P L | Excisionase og int proteinregulator, administrerer eksisjon og innsetting av faggenomet i vertens genom. |
| N | Antitermination for transkripsjon av sent tidlige gener | P L | Antiterminator , RNA-bindende protein og RNA-polymerase-kofaktor, binder RNA (på Nut-steder) og overfører til det begynnende RNApol som nettopp transkriberte mutterstedet. Denne RNApol -modifikasjonen forhindrer gjenkjenning av termineringssteder, så normale RNA -polymerasetermineringssignaler ignoreres og RNA -syntese fortsetter til distale faggener ( cII, cIII, xis, int, O, P, Q ) |
| Sp | Antiterminering for transkripsjon av senlytiske gener | P R | Antiterminator , DNA -bindende protein og RNApol -kofaktor, binder DNA (på Qut -steder) og overføres til det initierende RNApol. Denne RNApol -modifikasjonen endrer gjenkjennelsen av avslutningssekvenser, så normale blir ignorert; spesielle Q -avslutningssekvenser som er 20 000 bp unna er effektive. Q-utvidede transkripsjoner inkluderer fagstrukturelle proteiner (AF, ZJ) og lyseringsgener ( S, R, Rz og Rz1 ). Nedregulert av P antiq antisense mRNA under lysogeni. |
| RecA | SOS -svar | Vertsprotein | DNA-reparasjonsprotein, fungerer som en co-protease under SOS-respons, auto- cleaving LexA og cI og letter lysering. |
Lytisk vs. lysogen
Et viktig skille her er det mellom de to avgjørelsene; lysogeni og lysering ved infeksjon, og fortsatt lysogeni eller lysis fra en profag. Sistnevnte bestemmes utelukkende av aktiveringen av RecA i SOS -responsen til cellen, som beskrevet i avsnittet om induksjon. Førstnevnte vil også bli påvirket av dette; en celle som gjennomgår en SOS -respons vil alltid bli lysert, ettersom intet cI -protein får lov til å bygge seg opp. Imidlertid er den første lytiske/lysogene beslutningen om infeksjon også avhengig av cII- og cIII -proteinene.
I celler med tilstrekkelige næringsstoffer er proteaseaktiviteten høy, noe som bryter ned cII. Dette fører til den lytiske livsstilen. I celler med begrensede næringsstoffer er proteaseaktiviteten lav, noe som gjør cII stabil. Dette fører til den lysogene livsstilen. cIII ser ut til å stabilisere cII, både direkte og ved å fungere som en konkurrerende hemmer for de relevante proteasene. Dette betyr at en celle "i trøbbel", dvs. mangel på næringsstoffer og i en mer sovende tilstand, er mer sannsynlig å lysogenisere. Dette ville bli valgt fordi fagen nå kan ligge i dvale i bakterien til den faller på bedre tider, og så kan fagen lage flere kopier av seg selv med de ekstra ressursene som er tilgjengelige og med den mer sannsynlige nærheten til ytterligere smittbare celler.
En fullstendig biofysisk modell for lambdas lysis-lysogeni-beslutning gjenstår å utvikle. Datamodellering og simulering antyder at tilfeldige prosesser under infeksjon driver valg av lysering eller lysogeni i individuelle celler. Nylige eksperimenter antyder imidlertid at fysiske forskjeller mellom celler, som eksisterer før infeksjon, forhåndsbestemmer om en celle vil lysere eller bli et lysogen.
Som et genetisk verktøy
Lambda -fag har blitt brukt tungt som modellorganisme , og har vært en rik kilde til nyttige verktøy innen mikrobiell genetikk , og senere i molekylær genetikk . Bruksområder inkluderer dets anvendelse som en vektor for kloning av rekombinant DNA ; bruk av sin stedsspesifikke rekombinase (int) for blanding av klonede DNA-er ved hjelp av gateway-metoden ; og anvendelsen av dens røde operon , inkludert proteinene Red alpha (også kalt 'exo'), beta og gamma i DNA -teknikken som kalles rekombinering . 48 kb DNA -fragmentet av lambda -fag er ikke avgjørende for produktiv infeksjon og kan erstattes av fremmed DNA. Lambda -fag vil lettere komme inn i bakterier enn plasmider, noe som gjør den til en nyttig vektor som kan ødelegge eller kan bli en del av vertens DNA. Lambda fag kan manipuleres og brukes som en vaksine mot kreft, nanopartikkel, rettet mot human aspartyl (asparaginyl) β-hydroksylase (ASPH, HAAH). Lambda fag har også vært av stor betydning i studiet av spesialisert transduksjon .
Se også
- Esther Lederberg
- Lambda holin familie
- Molekylvektstørrelsesmarkør
- Sankar Adhya
- Zygotisk induksjon
- Corynebacteriophages - Corynephages β (beta) og ω (omega) er (foreslått) medlemmer av slekten Lambdavirus
Referanser
Videre lesning
- James Watson, Tania Baker, Stephen Bell, Alexander Gann, Michael Levine, Richard Losick Molecular Biology of the Gene (International Edition) - 6. utgave
- Mark Ptashne og Nancy Hopkins , "The Operators Controlled by the Lambda Phage Repressor", PNAS , v.60, n.4, s. 1282–1287 (1968).
- Barbara J. Meyer, Dennis G. Kleid og Mark Ptashne, "Lambda Repressor Turns Off Transcription of Its Own Gene", PNAS , v.72, n.12, s. 4785–4789 (desember 1975).
- Brüssow H, Hendrix RW (januar 2002). "Faggenomikk: lite er vakkert" . Cell . 108 (1): 13–6. doi : 10.1016/S0092-8674 (01) 00637-7 . PMID 11792317 .
- Dodd IB, Shearwin KE, Egan JB (april 2005). "Revidert genregulering i bakteriofag -lambda". Nåværende mening i genetikk og utvikling . 15 (2): 145–52. doi : 10.1016/j.gde.2005.02.001 . PMID 15797197 .
- Friedman DI, Court DL (april 2001). "Bacteriophage lambda: lever og lever og gjør fortsatt sitt". Nåværende mening i mikrobiologi . 4 (2): 201–7. doi : 10.1016/S1369-5274 (00) 00189-2 . PMID 11282477 .
- Gottesman, M. og Weisberg, RA 2004 "Little lambda - who made thee?", Micro and Mol Biol Revs , 68, 796-813 (tilgjengelig online på Microbiology and Molecular Biology Reviews , American Society for Microbiology )
- Hendrix RW, Smith MC, Burns RN, Ford ME, Hatfull GF (mars 1999). "Evolusjonære forhold mellom forskjellige bakteriofager og profager: hele verden er en fag" . Prosedyrer fra National Academy of Sciences i USA . 96 (5): 2192–7. Bibcode : 1999PNAS ... 96.2192H . doi : 10.1073/pnas.96.5.2192 . PMC 26759 . PMID 10051617 .
- Kitano H (mars 2002). "Systembiologi: en kort oversikt" (PDF) . Vitenskap . 295 (5560): 1662–4. Bibcode : 2002Sci ... 295.1662K . doi : 10.1126/science.1069492 . PMID 11872829 . S2CID 2703843 .
- Ptashne, M. "A Genetic Switch: Phage Lambda Revisited", 3. utgave 2003
- Ptashne M (juni 2005). "Regulering av transkripsjon: fra lambda til eukaryoter". Trender innen biokjemiske vitenskaper . 30 (6): 275–9. doi : 10.1016/j.tibs.2005.04.003 . PMID 15950866 .
- Snyder, L. og Champness, W. "Molecular Genetics of Bacteria", 3. utgave 2007 (Inneholder en informativ og godt illustrert oversikt over bakteriofag lambda)
- Splasho, Online oversikt over lambda (illustrerer gener som er aktive på alle stadier i livssyklusen)
Eksterne linker
- Livssyklus, grunnleggende animasjon av Lambda Lifecyecle (illustrerer infeksjon og lytiske/lysogene veier med litt protein og transkripsjonsdetaljer)
- Time-lapse mikroskopi video fra MIT som viser både lysis og lysogeni av fag lambda
- Lambda Phages livssyklus (grunnleggende visuell demonstrasjon av Lambda bakteriofag livssyklus)
- Lambda Phages genom i GenBank
- Lambda Phage Reference Proteome fra UniProt
- Lambda Phage Protein Structures i NCBI (3D -visning av proteinstrukturer for bakteriofag Lambda)